Для построения диаграммы плавкости на неё наносят точки, отвечающие температурам изломов и ступенек на кривых охлаждения смесей с соответствующим составом (в массовых или мольных процентах), которые затем соединяют линиями ликвидуса и солидуса. Область на диаграмме выше ликвидуса отвечает жидким расплавам, область ниже солидуса – твердым кристаллам обоих компонентов (две твердые фазы), области между ликвидусами и солидусом – гетерогенным системам (жидким расплавам, в которые погружены кристаллы одного из компонентов, а именно того, который присутствует в количестве, большем по сравнению с его содержанием в эвтектике). Точка Э на диаграмме плавления, в которой пересекаются ликвидусы и солидус, соответствует эвтектической смеси (или эвтектике). Она представляет собой смесь компонентов с определенным составом, плавящуюся и отвердевающую подобно чистым веществам при постоянной температуре (температуре эвтектики).
Соотношение масс жидкой и твердой фазы в гетерогенной системе можно определить по правилу рычага. Например, для системы с составом Х при температуре Тх, если состав выражен в массовых процентах,
Масса жидкости KL ¾¾¾¾¾¾¾¾¾ = ¾¾¾ Масса твердой фазы LM |
(при этом длина отрезка КМ пропорциональна общей массе смеси).
В том случае, когда компоненты смеси А и В образуют устойчивое химическое соединение, которое может быть выделено в твердом виде, на диаграмме плавления появляется максимум, отвечающий составу этого соединения и его температуре плавления. Такие соединения называют конгруэнтно плавящимися (см. рисунок ниже). В таких системах имеются две точки эвтектики ( Э1 и Э2).
А Э1 х Э2 В состав |
Для систем с химическим соединением состав на диаграммах удобнее указывать в мольных процентах (или мольных долях), так как при этом можно легко определить состав соединения. Например, если максимум соответствует составу 50 мольн.% А + 50 мольн.% В, то соединению отвечает формула А·В, а если максимум приходится на состав 25 мольн.% А + 75 мольн.% В, то соединение имеет формулу А·3В (или АВ3).
При образовании в системе неустойчивого химического соединения (плавящегося инконгруэнтно) на одном из ликвидусов появляется излом, положение которого отвечает составу этого соединения:
состав |
Если компоненты смеси не выделяются из расплава в виде самостоятельной фазы, а образуют смешанные кристаллы неопределенного состава (изоморфные смеси или твердые растворы), то диаграммы плавления таких смесей принимают вид:
2
А состав В |
1- кривая затвердевания расплава
2- кривая плавления твердого раствора.
Индивидуальное задание студенту.
1. Получить у преподавателя данные о температурах начала кристаллизации двухкомпонентной системы.
2. Построить по этим данным диаграмму плавления бинарной системы. Указать области, соответствующие жидкой, твердой и гетерогенной системам.
3. Вычертить все типы кривых охлаждения, возможных в данной системе.
4. Определить составы и температуры плавления эвтектических смесей и химических соединений.
5. Определить физическое состояние систем, содержащих а, б, в % вещества А при температуре Т1 (см. таблицу с исходными данными).
6. Показать, что произойдет с этими системами при изменении температуры до Т2.
7. Определить вариантность систем с содержанием компонента А: а) 95 мольн.% и б) 5 мольн.% при температуре Т1.
8. Определить вариантность системы в точке эвтектики и в любой точке, указанной преподавателем.
9. Определить, при какой температуре начнет плавиться смесь, содержащая а% вещества А, и при какой температуре она расплавится полностью.
10. Показать результаты анализа диаграммы плавления преподавателю.
11. Сформулировать выводы.
Работа 2.2.
Построение диаграммы кипения бинарной смеси.
Цель работы: построение и анализ диаграммы кипения бинарной смеси.
Целевые задачи: освоение принципа построения диаграмм кипения бинарной смеси; их анализ.
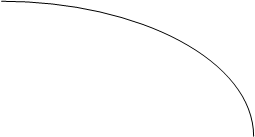
Диаграммы состояния, отражающие равновесие жидких и парообразных фаз, называются диаграммами кипения. Наиболее удобной формой представления диаграмм кипения является их изображение в координатах температура–состав. Если смесь двух летучих жидкостей представляет собой раствор с небольшими отклонениями от закона Рауля, её диаграмма кипения будет иметь вид, изображенный на рисунке:
Ткип А 3
4 1 Ткип В
A y B состав |
Диаграмма кипения. 1 - область жидкости, 2 - область кипящей жидкости, находящейся в равновесии с паром, 3 - область пара, 4 - ликвидус, 5 - линия пара.
Каждая точка линии ликвидуса 4 отвечает температуре начала кипения при нагревании смеси с определенным составом (или полной конденсации пара при охлаждении). Точки линии 5 соответствуют окончанию кипения при полном переходе жидкости в пар ( или началу конденсации пара в жидкость при охлаждении). Область диаграммы над линией 5 отвечает парообразным (газообразным) системам, область под линией 4 – жидким растворам. Фазовое поле между линиями 4 и 5 соответствует гетерогенным системам, в которых находятся в равновесии кипящая жидкость и пар.
При значительных положительных отклонениях от закона Рауля, когда общее давление пара над раствором превышает давление пара любого из чистых компонентов, и на диаграммах температура – состав появляется минимум, две ветви ликвидуса сходятся в точке Х с линией пара. При значительных отрицательных отклонениях от закона Рауля, когда общее давление пара над раствором становится ниже давления пара любого из чистых компонентов, на диаграммах температура - состав появляется максимум:
А х В А х В состав состав а б |
Диаграммы кипения:
а) положительное отклонение б) отрицательное отклонение
от закона Рауля (минимум от закона Рауля (максимум
температуры кипения) температуры кипения)
Растворы, состав которых отвечает этим экстремальным точкам, называются азеотропными (нераздельно кипящими или азеотропами). Их состав не меняется при кипении, и температура остается постоянной до полного перехода жидкости в пар (или до полной конденсации пара в жидкость при охлаждении). Такие смеси, в отличие от остальных, нельзя разделить перегонкой. Примером азеотропа с минимумом температуры кипения является смесь, содержащая 96% (по объёму) этилового спирта и 4% воды, иначе называемая спиртом-ректификатом.
Относительное количество жидкой и газообразной фаз для гетерогенной системы при температуре Тy можно рассчитать по правилу рычага (см. рис. на стр. 51):
Масса жидкости KL ¾¾¾¾¾¾¾¾ = ¾¾¾¾ Масса пара KM |
Индивидуальное задание студенту.
1. Получить у преподавателя данные о зависимости температуры кипения от состава жидкой (Х) и газообразной (У) фаз бинарной смеси.
2. Построить по этим данным диаграмму кипения.
3. Определить температуру начала кипения системы, содержащей “а” мольн. % компонента А, и состав первого пузырька пара.
4. Определить температуру, при которой исчезнет последняя капля жидкости, и состав этой капли.
5. Определить состав пара, находящегося в равновесии с жидкой бинарной системой, кипящей при температуре Т1.
6. Определить состав и температуру кипения азеотропа.
7. Определить вариантность системы в азеотропной точке и в любой точке, указанной преподавателем.
8. Показать результаты анализа диаграммы кипения преподавателю.
9. Сформулировать выводы.
Работа 2.3.
Определение критической температуры растворения
системы «фенол--вода».
Цель работы: Определение критической температуры растворения (КТР) системы «фенол - вода».
Целевые задачи: Овладение техникой термического анализа; построение фазовой диаграммы системы «фенол - вода»; графическое определение КТР; выяснение прикладных возможностей фазовых диаграмм.
Существуют жидкости с ограниченной взаимной растворимостью. Она наблюдается в том случае, когда переход молекул через поверхность раздела сопряжён с совершением работы, заметно превышающей среднюю энергию движения молекул жидкостей при данных условиях. Если жидкости химически не взаимодействуют, то изменение температуры влияет на растворимость лишь постольку, поскольку оно вызывает перераспределение энергии поступательного движения молекул. В большинстве случаев из-за возрастания доли молекул с большим запасом энергии взаимная растворимость жидкостей при повышении температуры увеличивается и при некоторой температуре, называемой критической температурой растворения (КТР), она становится неограниченной.
Диаграмма состояния, отражающая растворимость жидкостей друг в друге при различных температурах, называется диаграммой растворения (растворимости).
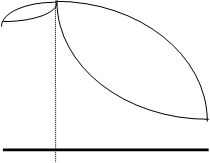
На рисунке показана типичная диаграмма растворимости с верхней КТР.
KTP
С D D
A E* F* B состав |
Кривая СКD - кривая растворения (расслоения). Точки, лежащие выше этой кривой, отвечают полной растворимости с образованием гомогенных систем; точки на кривой и ниже её, в заштрихованной области - ограниченной растворимости с образованием гетерогенных систем. Отрезки изотерм, соединяющие точки кривой расслоения, лежащие на её разных ветвях при одной температуре (например, Е и F при Т1), называются коннодами. Точки Е и F соответствуют составам Е* и F* сопряжённых растворов (фаз), находящихся в равновесии при данной температуре. При этом одна фаза представляет собой насыщенный раствор А в В (с составом F*), а другая - насыщенный раствор В в А (с составом Е*). Точка К, отвечающая максимуму кривой расслоения, лежит при температуре, равной КТР. При нагревании смеси с составом Е* после достижения температуры Т1 произойдет гомогенизация (полное взаимное растворение компонентов). При охлаждении её при этой же температуре произойдет гетерогенизация (разделение на две несмешивающиеся фазы).
Оснащение рабочего места
Фенол кристаллический Вода дистиллированная
Пробирка на 20 мл Ртутный термометр (до 100оС)
Водяная баня Весы технические
Разновес Пипетка на 1 мл
Проведение опыта
1. Проверить оснащение рабочего места.
2. Включить водяную баню. Нагреть воду дооС.
3. Взвесить чистую сухую пробирку с точностью до 0,01 г.
4. Поместить во взвешенную пробирку навеску фенола (0,48 - 0,52 г).
ВНИМАНИЕ: Остерегаться попадания фенола на руки и в глаза! В случае попадания - промыть пораженное место водой, кожу рук протереть раствором спирта. После окончания работы раствор, содержащий фенол, слить в специальный сосуд в вытяжном шкафу. |
5. Взвесить пробирку с фенолом и по разности определить точную массу фенола.
6. Закрыть пробирку пробкой со вставленным в неё термометром.
ВНИМАНИЕ: Ртутный резервуар термометра должен находиться на расстоянии приблизительно 1 мм от дна пробирки. |
7. Поместить нижнюю часть пробирки в горячую воду водяной бани, после расплавления фенола нагреть его до температуры около 50оС.
8. Вынув пробирку из водяной бани, дать фенолу охладиться до комнатной температуры, записывая показания термометра с интервалом по 0,5 минуты. По полученным данным построить кривую охлаждения фенола в координатах температура - время (см. рис.). Определить по ней температуру плавления (отвердевания) фенола.
Примечание: Для большей наглядности рекомендуется использовать следующий масштаб: по оси температур – 1 см =1 градус, а по оси времени – 1 мм =1 мин. |
9. Не вынимая полностью термометр из пробирки (во избежание потери массы) внести в неё пипеткой первую добавку дистиллированной воды (см. табл.).
10. Поместить пробирку в горячую воду. После гомогенизации (взаимного растворения воды и фенола) вынуть её из воды и охладить на воздухе до гетерогенизации (помутнения). Для равномерного охлаждения жидкости её можно перемешивать термометром. Записать температуру, при которой произошла гетерогенизация, в таблицу экспериментальных данных.
11. Повторить операции, описанные в п. п, поочередно со всеми добавками воды. Сверить результаты у преподавателя и занести их в таблицу.
12. Привести в порядок рабочее место и сдать его дежурному.
13. Заполнить таблицу, рассчитав все указанные в ней величины.
№№ п. п. | Масса фенола, г | Объём добавленной воды, мл | Общая масса смеси, г | Содержание фенола в смеси, % | Содержание воды в смеси, % | Температура гетеро- генизации, оС |
1 | 0,25 | |||||
2 | 0,05 | |||||
3 | 0,05 | |||||
4 | 0,05 | |||||
5 | 0,1 | |||||
6 | 0,1 | |||||
7 | 0,1 | |||||
8 | 0,1 | |||||
9 | 0,2 | |||||
10 | 0,5 | |||||
11 | 0,5 | |||||
12 | 0,5 | |||||
13 | 0,5 | |||||
14 | 1,0 | |||||
15 | 1,0 |
14. Построить по данным о температуре гетерогенизации диаграмму растворения (см. рис.), проведя плавную усредняющую линию через экспериментальные точки. Указать на ней области существования гомогенных и гетерогенных смесей.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 |







 Т Т
Т Т

 T T
T T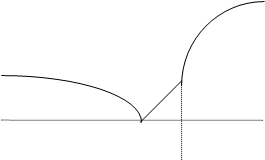
 Т 1 Т
Т 1 Т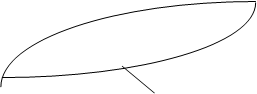


 Т Т
Т Т
 5
5





 T Т Т Т
T Т Т Т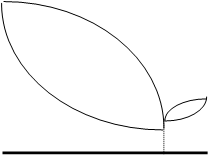
 Т K Т
Т K Т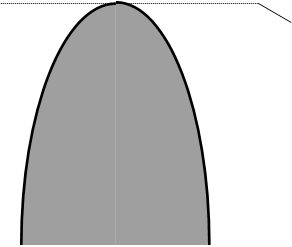



 T1 E A F
T1 E A F