9. Получить у преподавателя контрольный раствор кислоты неизвестной концентрации. Провести кондуктометрическое титрование. Данные показать преподавателю и занести в таблицу экспериментальных данных.
10. Привести в порядок рабочее место и сдать его дежурному.
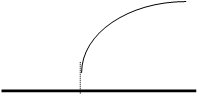
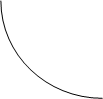
11. Построить по экспериментальным данным кривые титрования для учебного и контрольного растворов в координатах R – VNaOH и 1/R – VNaOH, как показано на рисунке.
а б
Vx VNaOH Vx VNaOH |
Кривые кондуктометрического титрования:
а) R - VNaOH; б) 1/R - VNaOH
Vx - Объём титранта, соответствующий точке эквивалентности
12.Проверить соответствие кривой титрования учебного раствора исходным данным. Рассчитать по закону эквивалентов концентрацию кислоты в учебном и контрольном растворе:
СНСl = (СNаОН·Vx)/VНСl.
13.Данные сверить у преподавателя и занести в таблицу.
14.Сформулировать выводы.
Работа 3.3
Определение растворимости и произведения растворимости труднорастворимой соли
Цель работы: определение растворимости и произведения растворимости труднорастворимой соли кондуктометрическим методом.
Целевые задачи: выяснение прикладных возможностей кондуктометрии; закрепление навыка пользования кондуктометром.
По значению удельной электрической проводимости насыщенного раствора труднорастворимой соли можно рассчитать её концентрацию и, следовательно, вычислить растворимость и произведение растворимости.
Так как в насыщенном растворе труднорастворимой соли концентрация очень мала, его эквивалентная проводимость практически совпадает с l¥. Поэтому для данного случая можно принять:
С = (1000 k)/l¥.
Поскольку для бинарного электролита l¥ равна сумме подвижностей ионов (закон Кольрауша), её можно рассчитать с помощью справочных данных.
Ввиду малой удельной проводимости раствора в расчетное уравнение следует ввести поправку на проводимость воды. При этом получаем окончательное уравнение:
1000 (k – kH2O) С = ¾¾¾¾¾¾¾ (1) l¥. |
Примечание. Для прецизионных измерений используется бидистиллят, k которого не должна превышать 2´10-6 Ом-1см-1. Такая вода получается и хранится в посуде из кварца или стекла марки «пирекс». |
Если С – концентрация насыщенного раствора бинарного электролита, то его произведение растворимости будет равно:
ÏÐ = С
Методику определения растворимости трудно растворимых солей можно использовать также и для определения констант устойчивости комплексных соединений.
Оснащение рабочего места
Кондуктометр Водяная баня
Термометр
Ячейка для определения электропроводимости
Растворы малорастворимых солей
Проведение опыта
1. Проверить оснащение рабочего места. Измерить и записать температуру, при которой проводится опыт.
2. Получить у преподавателя насыщенный раствор трудно растворимой соли.
3. Собрать кондуктометрическую установку (см. работу 3.1). Ячейку промыть дистиллированной водой (не менее 3 раз) и измерить сопротивление дистиллированной воды. Рассчитать удельную электрическую проводимость воды. Результат занести в таблицу экспериментальных данных.
4. Залить в ячейку эталонный раствор KCl и измерить его сопротивление для расчета константы ячейки.
5. Вновь промыть не менее 5 раз ячейку дистиллированной водой. Заполнить ячейку исследуемым раствором соли. Измерить его сопротивление и рассчитать удельную проводимость.
6. Пользуясь справочными таблицами, рассчитать по закону Кольрауша эквивалентную электрическую проводимость соли при бесконечном разведении.
7. С помощью уравнений (1) и (2) рассчитать концентрацию насыщенного раствора соли (моль/л) и её произведение растворимости.
8. Считая, что из-за малой концентрации раствора его плотность близка к плотности воды, и, следовательно, молярная концентрация приблизительно равна моляльности, вычислить растворимость (s) соли в г на 100 г воды:
s = (C M)/10 ,
где М - молярная масса соли, г/моль; 10 – пересчетный коэффициент для перехода от 1000 к 100 г воды.
9. Результаты сверить у преподавателя и занести в таблицу. Сравнить полученное значение со справочным.
Малорастворимая соль _______ Молярная масса М = | Температура Т = оС |
Константа ячейки Кя = см-1 | |
Сопротивление, Ом дистиллированной воды RН2О = | |
исследуемого раствора R = | |
Удельная электрическая проводимость, Ом-1см-1 | дистиллированной воды kН2О = |
исследуемого раствора k = | |
Концентрация насыщенного раствора С = моль/л Произведение растворимости ÏÐ = Растворимость s = г/100 г воды |
10. Сформулировать выводы.
Тема 4. Потенциометрия
Значение темы для фармации определяется широким применением потенциометрических методов анализа и исследования (определение водородного показателя рН, потенциометрическое титрование и др.). Контроль рН необходим как в ходе технологических процессов при получении различных веществ, в том числе лекарственных, так и при анализе лекарственных форм. рН-метрия и основанная на том же принципе ионометрия используется в клинических исследованиях, например, при определении кислотности желудочного сока, рН крови, концентрации СО2 и различных ионов в крови и других жидкостях организма.
Потенциометрическое титрование, а также другие электрохимические методы анализа, основанные на измерении потенциалов электродов, контактирующих с исследуемым раствором (полярография, амперометрическое титрование) являются фармакопейными методами и используются в фармацевтическом анализе.
Потенциометрические методы исследования могут быть применены для определения широкого спектра физико-химических характеристик выделенных из природного сырья веществ (например, константы диссоциации, показателя кислотности рКа, растворимости труднорастворимых соединений, активности растворов электролитов и др.). Кроме того, они могут быть использованы для определения констант равновесия реакций, в том числе применяемых в фармацевтическом анализе, и связанных с ними термодинамических величин.
Изучив данную тему и выполнив лабораторные работы, относящиеся к ней, студент должен знать:
n что такое буферные растворы, буферная ёмкость, механизм буферного действия;
n устройство электродов 1-го и 2-го рода;
n методы определения рН растворов;
n расчет концентрации водородных ионов;
n виды гальванических элементов и принципы их действия;
n понятие об электродвижущей силе (ЭДС) и о потенциалах, возникающих в гальваническом элементе;
n уравнение Нернста для расчета ЭДС гальванических элементов и электродных потенциалов.
Студент должен уметь:
n проводить измерения с помощью рН-метра;
n рассчитывать концентрацию водородных ионов и определять величину буферной ёмкости буферных растворов;
n рассчитывать объёмы сопряжённых кислоты и основания, необходимые для приготовления буферных растворов с заданными значениями рН.
Студент должен приобрести или закрепить навыки:
n работы с рН-метром;
n приготовления и отмеривания растворов;
n титрования;
n табулирования величин, построения и анализа графиков.
Вопросы для самоподготовки
1. Химические источники тока (гальванические элементы), их виды. Электроды, полуэлементы, цепи. Электродвижущая сила (ЭДС), её связь с энергией Гиббса протекающей в элементе реакции.
2. Электродные потенциалы. Контактный и диффузионный потенциалы и способы сведения их к минимуму.
3. Уравнения Нернста для расчета электродных потенциалов и для расчета ЭДС.
4. Обратимые электроды 1-го рода. Формула записи, электродная полуреакция. Примеры. Водородный электрод, его применение в качестве стандартного.
5. Обратимые электроды 2-го рода. Формула записи, электродная полуреакция. Хлоридсеребряный и каломельный электроды. Устройство и применение в качестве электродов сравнения.
6. Ионоселективные электроды. Стеклянный электрод (устройство и применение). Принципиальное устройство рН-метра. Потенциометрическое определение рН.
7. Концентрационные гальванические элементы и их применение для определения растворимости труднорастворимых солей.
8. Окислительно-восстановительные электроды и гальванические элементы. Применение их для расчета констант равновесия окислительно-восстановительных реакций.
Решение типовых задач
Задача 1. Рассчитать объёмы растворов 0,5 М уксусной кислоты и 0,2 М ацетата натрия, необходимые для приготовления 10 мл буферного раствора с рН = 3,2.
Решение: Расчет ведется по уравнению
Vсопр. осн. · Ссопр. осн. рН = рКа + lg ¾¾¾¾¾¾¾¾¾¾ , Vк. · С к. |
где рКа - показатель кислотности уксусной кислоты, равный 4,756,
Vк. и Ск. - соответственно объём и концентрация раствора уксусной кислоты,
Vсопр. осн. и Ссопр. осн. - соответственно объём и концентрация раствора сопряжённого основания (в данном случае - СН3СООNа).
Vсопр. осн. · Ссопр. осн. lg ¾¾¾¾¾¾¾¾¾¾ = рН - рКа Vк. · Ск. |
Решаем уравнение относительно объёмов:
Примем объём раствора СН3СООН, необходимый для приготовления 10 мл буферного раствора, за х мл. Тогда объём раствора ацетата натрия будет равен 10 - х мл. Отсюда
(10 – х)´0,2 lg ¾¾¾¾¾¾ = 3,2 – 4,74 = -1,556; 0,5 х |
(10 – х)´0,2 ¾¾¾¾¾¾ = 10-1,556 » 0,028; 0,5 х |
2 – 0,2 х = 0,028´0,5х = 0,014х; 0,214 х = 2;
х = 2/0,214 » 9,34 мл (объём 0,2 М СН3СООН);
10 – х = 0,66 мл (объём 0,2 М СН3СООNa).
(-) Zn | ZnSO4 || CuSO4 | Cu (+) C = 0,5 M C = 1 M |
Задача 2. Рассчитать электродные потенциалы, электродвижущую силу, изменение энергии Гиббса и константу равновесия реакции, протекающей в гальваническом элементе
при замыкании цепи. Указать катод и анод. Т = 25оС.
Решение: Потенциалы электродов ЕМеn+/Ме рассчитаем по уравнению Нернста:
RT 0,059 ЕМе n+/Ме = ЕоМе n+/Ме + ¾¾¾ ln aMen+ = ЕоМе n+/Ме + ¾¾¾ lg aMen+ , nF n |
где ЕоМеn+/Ме – стандартный электродный потенциал;
aMen+ – активность ионов, участвующих в электродной реакции.
Коэффициенты активности g и стандартные электродные потенциалы ЕоМеn+/Ме возьмем в справочнике:
аCu2+ = gCu2+CCu2+ = 0,043´1 = 0,043 моль/л; ЕоCu2+/Cu = +0,337 В;
аZn2+ = g Zn+CZn+ = 0,063´0,5 = 0,0315; ЕоZn2+/Zn = -0,763 В.
Подставляем данные:
0,059 ЕСu2+/Cu = +0,337 + ¾¾¾ lg 0,043 = +0,297 В (E+); 2 |
0,059 ЕZn2+/Zn = -0,763 + ¾¾¾ lg 0,0315 = –0,807 В (E–). 2 |
ЭДС элемента равна разности потенциалов более положительного и более отрицательного электродов:
Е = Е+ – Е– ,
то есть в данном случае:
Е = ЕCu2+/Cu - EZn2+/Zn = +0,,807) = 1,104 B.
В гальваническом элементе катод заряжен положительно, а анод - отрицательно, значит, катодом является медный электрод, а анодом - цинковый. На катоде при замыкании цепи идет реакция восстановления меди, на аноде - реакция окисления цинка.
Зная ЭДС, можно рассчитать изменение энергии Гиббса в ходе реакции: DGо = - nFE, где n - число электронов, участвующих в реакции, F - число Фарадея.
Подставляем значения:
DGо = -2 ´ 96500 ´ 1,104 = -212300 Дж/моль.
Так как DGо < 0, равновесие в реакции
Zno + Cu2+ = Zn2+ + Cuo
будет смещено вправо. По величине DGо можно вычислить константу равновесия реакции (так как в реакции не участвуют газообразные вещества, то Kp = Kc):
DGо -212300 lnKp = lnKc = – ¾¾ = - ¾¾¾¾¾ = 85,6887. RT 8,314´298 |
Отсюда Кр = Кс = е85,6887 = 1,64´1037.
Задача 3. ЭДС элемента, составленного из водородного и нормального хлоридсеребряного электродов, при 25оС равна 0,300 В. Рассчитать рН раствора, с которым контактирует водородный электрод и активность ионов водорода в нём.
Решение: Поскольку потенциал хлоридсеребряного электрода ЕХСЭ равен +0,222 В, а потенциал водородного электрода ЕВЭ близок нулю и Е = Е+ - Е-, можно записать:
Е = ЕХСЭ - ЕВЭ.
Помня, что ЕоВЭ = 0 и значит ЕВЭ = 0,059 lg aH+ = -0,059 pH, получаем
Е = ЕХСЭ + 0,059 рН,
Е - ЕХСЭ 0,,222 рН = ¾¾¾¾¾ = ¾¾¾¾¾¾ = 1,32 ; 0,059 0,059 |
откуда
и аН+ = 10-рН = 10-1,32 = 0,0479 моль/л.
Задача 4. Рассчитать растворимость и произведение растворимости AgI при 25оС, если электродвижущая сила элемента, составленного из двух серебряных электродов, погруженных соответственно в насыщенный раствор иодида серебра и в раствор AgNO3 c активностью 1 моль/л, равна 0,4535 В.
Е = Е+ - Е- = ЕоAg+/Ag + 0,0591 lg aAg+ ЕоAg+/Ag + 0,0591 lg aAg+ (2)) . |
Решение: В случае концентрационного элемента, которым является элемент, описанный в условии,
Отсюда получаем
aAg+ (1) Е = 0,0591 lg ¾¾¾ = 0,4535. aAg+ (2) |
Индекс 1 в данном случае относится к более положительному электроду, контактирующему с раствором AgNO3, индекс 2 - к более отрицательному, погруженному в насыщенный раствор AgI. Так как коэффициент активности g 1М AgNO3 равен 0,429, то aAg+ (1) = 0,429´1 = 0,429. Решаем уравнение относительно искомой концентрации, которая в очень разбавленном растворе практически совпадает с активностью:
lg [aAg+ (1)/ aAg+ (2)] = 0,4535/0,0591 = 7,6734;
0,429/aAg+ (2) = 107,6734 = 4,7141´107;
aAg+ (2) = 0,429/4,7141´107 = 9,1´10-9 моль/л.
Произведение растворимости AgI при этом будет равно
ПР = aAg+ ´ аI = (9,1´10-9)2 = 8,3´10-17.
Задачи для самостоятельного решения
Задача 1. ЭДС элемента, состоящего из водородного и нормального каломельного электродов, погруженных в исследуемый раствор, при 298К равна 0,664 В. Рассчитать рН и активность ионов водорода в растворе.
Ответ: 6,50; 3,16´10-7.
Задача 2. Рассчитать ЭДС гальванического элемента
Zn|Zn2+ a=0,0004||Cd2+ a=0,2|Cd
и изменение энергии Гиббса протекающей в нём при 25оС реакции
Znо + Cd2+ =Zn2+ + Cdî,
если стандартные электродные потенциалы соответственно равны: ЕоZn2+/Zn = –0,763 B и EоCd2+/Cd = 0,403 В.
Ответ: 0,4398 В; 84,88 кДж/моль.
Задача 3. Рассчитать ЭДС двух элементов с общей формулой Pt|H2; HCl||Cl2(газ); Cl-|Pt, отличающихся концентрацией HCl: 1) СHCl = 0,01 М (g = 0,906); 2) СНСl = 0,05 М (g = 0,833) (в скобках приведены коэффициенты активности растворов). Потенциал хлорного электрода PtçCl2(газ); Cl - равен +1,3595 В.
Ответ: 1) 1,602 В; 2) 1,5225 В.
Задача 4. Рассчитать DGо реакции Mgо + 2Ag+ ® Mg2+ + 2Agо, протекающей в гальваническом элементе при стандартных условиях (активность ионов равна единице). Стандартные электродные потенциалы: ЕоMg/Mg2+ = -2,37 B, EоAg/Ag+ = +0,799 B. Указать, пойдет ли реакция в данных условиях в прямом направлении.
Ответ: -611,6 кДж/моль; реакция может идти самопроизвольно, так как DGо <0.
Задача 5. Вычислить константу равновесия реакции
SnCl2 + 2 FeCl3 « SnCl4 + 2 FeCl2,
идущей в гальваническом элементе. Соответствующие окислительно-восстановительные потенциалы равны: ЕоFe3+/Fe2+ = 0,771 В, EоSn4+/Sn2+ = 0,150 В.
Ответ: K = 1021.
Задача 6. Рассчитать растворимость и произведение растворимости сульфида цинка при 25оС. ЭДС концентрационного гальванического элемента
Zn | ZnS || ZnSO4 | Zn a = x C = 0,5M |
равна 0,276 В (gZnSO4 = 0,063).
Ответ. 1,39´10-11 моль/л; 1,93´10-22.
Работа 4.1
Потенциометрическое и колориметрическое определение рН растворов и концентрации водородных ионов
Цель работы: измерение водородного показателя (рН) растворов при помощи потенциометрического и колориметрического методов.
Целевые задачи: приготовление буферных растворов с заданными значениями рН, освоение методики работы на рН–метре, сравнение достоинств и недостатков колориметрического и потенциометрического методов определения рН растворов.
Термодинамическая константа равновесия реакции диссоциации (автопротолиза) воды Н2О « Н+ + ОН– определяется соотношением:
аН+ · аОН- Ка = ¾¾¾¾¾ = 1,8 ·10-16, аН2О |
где а – активности.
Так как активность недиссоциированной воды аН2О = 1 , то Ка = аН+·аОН- = Кв.
Величина Кв представляет собой ионное произведение воды. Оно зависит только от температуры. При 25оС Кв = 1,008´10-14. Отсюда при той же температуре активность ионов водорода в воде
аН+ » СН+ = ÖКв » 10-7 моль/л.
Активность ионов водорода выражается следующими соотношениями:
n в воде: аН+ » СН+
n в сильной одноосновной кислоте аН+ = g±С
n в слабой одноосновной кислоте аН+ = aС,
где С – молярная концентрация раствора кислоты, g± – средний ионный коэффициент активности, a – степень диссоциации.
Величину аН+ называют активной кислотностью, а С – общей кислотностью.
Активную кислотность принято выражать с помощью водородного показателя рН, т. е. логарифма активности водородных ионов, взятого с противоположным знаком:
рН = -lg aН+
При 25оС в нейтральном растворе рН = 7, в кислом рН < 7, в щелочном рН > 7. (Аналогично можно ввести понятие гидроксидного показателя рОН).
Во многих случаях необходимо иметь растворы с устойчивым значением водородного показателя (буферные растворы).
Буферными растворами называются растворы, которые поддерживают определенное значение рН при разбавлении или введении небольших количеств сильных кислот, сильных оснований и других веществ.
Буферный раствор может быть образован смесью кислоты и сопряжённого основания, а именно смесью слабой кислоты с её солью (например, смесь уксусной кислоты с ацетатом натрия в водных растворах), или смесью основания и сопряженной кислоты, а именно смесью слабого основания с его солью (например, аммиака с хлоридом аммония), или смесью двух или более солей многоосновных слабых кислот.
Рассмотрим подробно первый пример. В соответствии с уравнением диссоциации уксусной кислоты
СН3СООН « СН3СОО– + Н+
её термодинамическая константа диссоциации равна:
аСН3СОО– · аН+ Ка = ¾¾¾¾¾¾¾ , аСН3СООН |
откуда
аСН3СООН aН+ = Ка ¾¾¾¾¾ . аСН3СОО– |
Введение в раствор уксусной кислоты её полностью ионизированной соли - ацетата натрия - смещает равновесие диссоциации влево. В результате активность недиссоциированной кислоты становится практически равной её общей (аналитической) концентрации, а активность ацетат-иона – равной активности иона прибавленной соли. Поэтому
Скисл aН+ = Ка ¾¾¾¾¾¾¾¾¾ . Ссоль (сопр. основание) |
В обычно используемых на практике буферных растворах концентрации кислоты и соли не очень велики, поэтому можно принять g± » 1. Отсюда:
Скисл рН = рКа, кисл – lg ¾¾¾¾¾¾¾¾¾ , Ссоль (сопр. основание) |
где рКа, кисл = - lg Ка, кисл.
Таким образом, рН буферного раствора зависит от величины рКа слабой кислоты и от соотношения концентраций кислоты и её соли в растворе, т. е. для приготовления буферного раствора с заданным значением рН необходимо ввести в раствор слабую кислоту и её соль в определенных, легко рассчитываемых соотношениях.
Аналогичное уравнение можно получить для буферного раствора, образованного слабым основанием и его солью, и для солевых буферных растворов.
Буферные растворы обладают тем важным свойством, что разбавление их почти не изменяет концентрации водородных ионов, так как при разбавлении отношение Скисл/Ссоль меняется очень мало (в основном из-за изменения коэффициента активности соли).
Многие биологические жидкости, в том числе кровь, являются буферными растворами. Компоненты таких растворов - карбонаты, фосфаты, белки.
Для измерения водородного показателя растворов разработан ряд методов, из которых наиболее часто применяются потенциометрический и колориметрический.
При использовании потенциометрического метода рН определяют с помощью гальванического элемента, один из электродов которого (индикаторный) обратим относительно ионов водорода, т. е. его потенциал может изменяться пропорционально рН раствора; другой электрод (электрод сравнения) имеет постоянный потенциал, не зависящий от состава и свойств исследуемого раствора.
Индикаторными электродами могут быть, например, водородный, хингидронный, стеклянный; электродами сравнения – каломельный или хлоридсеребряный.
В лабораторной практике чаще всего используются стеклянный и хлоридсеребряный электроды.
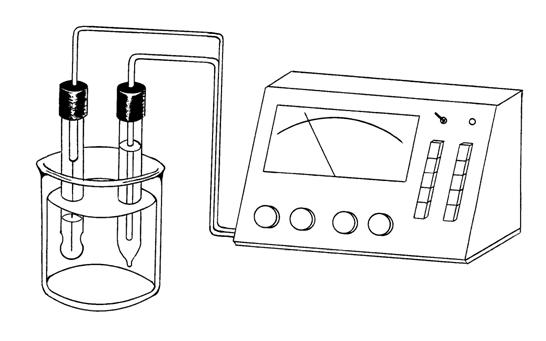
Внутреннее сопротивление гальванического элемента, состоящего из стеклянного и хлоридсеребряного электродов, велико и может достигать десятков МОм. По этой причине для измерения его ЭДС используют специальные приборы с большим внутренним сопротивлением, что позволяет практически исключить из измеряемой ЭДС падение напряжения в стеклянной мембране. Широкое применение для этих целей нашли электронные потенциометры с логарифматорами, получившие название рН-метров (например, рН-метры-милливольтметры рН-340, pH-121 рН-150 и др.).
Хлоридсеребряный электрод в рН-метре помещается в насыщенный раствор КСl для поддержания постоянной величины его потенциала. Стеклянный электрод надо хранить в воде или в 0,1М растворе НСl.
|
- стеклянный электрод (индикаторный); - хлоридсеребряный электрод (электрод сравнения); - исследуемый раствор; - измерительный прибор.
Перед началом измерений правильность работы рН-метра должна быть проверена с помощью эталонных буферных растворов.
При колориметрическом методе рН растворов измеряется с помощью особых веществ – индикаторов. В качестве индикаторов используются некоторые слабые органические кислоты или основания, имеющие в недиссоциированном и диссоциированном состояниях различную окраску. Перемена окраски в случае индикатора – слабой кислоты связана с изменением электронной структуры молекул при их диссоциации:
НInd « H+ + Ind– .
В достаточно кислой среде равновесие сдвинуто влево и окраска раствора определяется цветом недиссоциированного индикатора (кислой формы); в достаточно щелочной среде – цветом анионов (щелочной формы). При употреблении терминов «кислая» и «щелочная форма» речь идет о состоянии индикаторов в среде с меньшим или большим значением рН, чем отвечающее перемене окраски, но не обязательно меньшим или большим 7.
Интенсивность окраски раствора определяется степенью диссоциации индикатора, зависящей от рН. В некотором интервале значений рН, который называют зоной перехода индикатора, происходит изменение окраски. Однако из-за малой чувствительности глаза к перемене окраски она ощущается лишь тогда, когда отношение количеств окрашенной и неокрашенной форм достигает »10 (или 0,1). Поэтому область применения индикатора, зависящая от константы его диссоциации (ионизации) КInd, приближенно находится в пределах двух единиц рН:
рН = рКInd ± 1.
Область применения индикаторов зависит также от температуры, природы растворителя и примесей посторонних веществ.
Раньше для колориметрического определения рН растворов в широком диапазоне готовилась так называемая колориметрическая шкала, представляющая собой ряд пробирок с эталонными растворами, имеющими определенное значение рН, и содержащими смесь индикаторов (или «универсальный индикатор»). Цвет индикатора в исследуемом растворе сравнивался (часто с помощью воздушного компаратора) с эталонами. На основании совпадения цвета делалось заключение о рН раствора. В настоящее время в связи с громоздкостью комплекта пробирок, с трудоёмкостью и большим расходом реактивов этот метод вытеснен применением индикаторной бумаги. С её помощью можно быстро и надежно оценить рН раствора с точностью до одной единицы рН.
Оснащение рабочего места
рН-метр
Эталонные буферные растворы
Стаканы на 50 мл
Бюретки
Реактивы для приготовления буферных растворов
Универсальная индикаторная бумага
Проведение опыта
1. Проверить оснащение рабочего места.
2. Включить рН-метр и дать ему прогреться не менее 20 минут.
3. Приготовить серию буферных растворов с различными значениями рН (по указанию преподавателя).
4. С помощью универсальной индикаторной бумаги ориентировочно определить рН каждого буферного раствора. Результаты занести в таблицу.
Компоненты | Номера буферных растворов | Контрольный | ||||
буферных | 1 | 2 | 3 | 4 | 5 | раствор |
растворов | Объёмы (мл) растворов компонентов, взятых для приготовления буферных смесей | N | ||||
1. | - | |||||
2. | - | |||||
3. | - | |||||
рН, найденный колориметрически | ||||||
рН, найденный потенцио-метрически | ||||||
аН+, моль/л |
5. Проверить правильность работы рН-метра, измерив рН эталонных буферных растворов.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 |





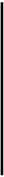


 R 1/R
R 1/R