На правах рукописи
ПАНТЕЕВА
Ольга Николаевна
ДИНАМИКА ГЛУБИНЫ АНЕСТЕЗИИ
И ПОДДЕРЖАНИЕ ЕЕ СТАБИЛЬНОСТИ
ВО ВРЕМЯ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ
14.01.20 - анестезиология и реаниматология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург – 2011
Работа выполнена в Государственном образовательном учреждении дополнительного профессионального образования «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию».
Научный руководитель:
доктор медицинских наук
профессор
Официальные оппоненты:
доктор медицинских наук
профессор
доктор медицинских наук
Ведущая организация:
ГОУ ВПО «Санкт-Петербургская государственная педиатрическая медицинская академия Федерального агентства по здравоохранению и социальному развитию»
Защита состоится "____" ____________2011 года в ____ часов на заседании диссертационного совета Д 208.089.02 при ГОУ ДПО «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию» ( Санкт-Петербург, Кирочная ул., д. 41)
С диссертацией можно ознакомиться в фундаментальной библиотеке ГОУ ДПО «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию» ( Санкт-Петербург, Заневский пр., 1/82).
Автореферат разослан «___» «_________» 2011 г.
Ученый секретарь диссертационного совета |
| |
доктор медицинских наук |
Актуальность проблемы. Одной из наиболее серьезных проблем современной анестезиологии остается риск пробуждения пациентов во время выполнения оперативного вмешательства. Частота сохранения сознания во время операций, по разным данным, колеблется от 11 до 43% (Ghoneim M. M., 2000). По данным Объединенной комиссии по аккредитации организаций здравоохранения (JCAHO, 2004) частота интраоперационных пробуждений у пациентов во время оперативного вмешательства в США достигает 20000–40000 случаев ежегодно, составляя 0,1–0,2% от всех пациентов, подвергающихся общей анестезии. Это подтверждается и рядом других публикаций (Lennmarken C., Sandin R., 2004; Osterman J. E. et. al., 2001; Sebel P. S. et. al., 2004). Приведенные цифры убеждают, что проблема поверхностной анестезии не относится к разряду редких и незначительных.
Риск незапланированного пробуждения особенно велик во время операций на открытом сердце. Это обусловлено изменением концентраций лекарственных средств в крови при использовании аппарата искусственного кровообращения (АИК), в том числе, и в связи с увеличением объема распределения препаратов (Yoshitani K. et al., 2003), гипотонией, гипотермией и непульсирующим кровотоком, градиентом температур, при согревании и охлаждении больного, а также желанием избежать отрицательного инотропного эффекта анестетиков путем снижения их дозы (Deepak K. Tempe et al., 2006).
В силу изложенных причин, коронарное шунтирование и протезирование клапанов в условиях искусственного кровообращения (ИК) сопровождаются недостаточной глубиной сна в 4,7 и 4% случаев соответственно (Wang Y. et al., 2005). Большинство случаев интраоперационных воспоминаний, связанных со слуховыми восприятиями, наиболее часто встречается непосредственно в момент начала ИК, что подтверждает изменение концентраций анестетиков в первые минуты перфузии. Сложившееся положение дел привело к разработке и применению различных методик стабилизации глубины сна в период ИК: дополнительное введение анальгетиков (Celebioglu B. et al., 2002), гипнотиков (Dowd N. P. et al., 1998) и включение в контур АИК дополнительного испарителя ингаляционных анестетиков ( и др., 2009).
Несмотря на широко распространенное использование электроэнцефалографии (ЭЭГ) в качестве инструмента контроля глубины сна, следует помнить, что ее параметры были выбраны эмпирически, и в настоящее время нет ясного и теоретически обоснованного критерия оценки глубины гипнотического компонента.
Для оценки глубины сна предложено несколько вариантов электрофизиологических показателей и их производных, а одним из наиболее распространенных является биспектральный индекс (BIS), который используется с 1996 г. BIS задуман как показатель, коррелирующий с уровнем седации и глубиной наркотического состояния. Однако в ряде работ выявлены некоторые недостатки метода. При моноанестезии ксеноном BIS-индекс отстает от клинических проявлений ксеноновой анестезии (, , 2003). В своей работе Kim H. S. с коллегами (2005), показали повышение показателей BIS при увеличении концентрации анестетика у детей младшего возраста.
При некоторых видах общей анестезии, такой как комбинированная анестезия с применением кетамина, BIS может указывать на 100% бодрствование пациента, в то время как по всем клиническим и гемодинамическим параметрам он находится в глубоком наркозе (Hayashi K. et al., 2008). Таким образом, разработка методов оценки глубины сна, мониторинга ее динамики, в том числе при кардиохирургических операциях в условиях ИК, на сегодняшний день не прекращается и остается актуальной ( и др., 2010; Bruhn J. et al., 2006).
Цель исследования: Повысить качество анестезиологического обеспечения кардиохирургических вмешательств в условиях искусственного кровообращения посредством мониторинга и коррекции глубины сна.
Задачи исследования:
1. Изучить динамику глубины сна во время кардиохирургических операций с искусственным кровообращением, оценив частоту и факторы риска непреднамеренного пробуждения пациента.
2. Исследовать возможность динамической оценки глубины сна с помощью производных электроэнцефалограммы – частоты спектрального края и спектральной энтропии.
3. Обосновать возможность поддержания стабильности глубины сна путем добавления в объем первичного заполнения аппарата искусственного кровообращения дозы пропофола, рассчитанной по целевой концентрации препарата в плазме крови.
4. Изучить роль гемодилюции, динамики температуры тела и напряжения углекислого газа в крови как возможных факторов риска непреднамеренного пробуждения пациента во время кардиохирургической операции с искусственным кровообращением.
Научная новизна результатов исследования
– разработана новая методика поддержания стабильности гипнотического компонента анестезии при использовании искусственного кровообращения, основанная на создании в первичном объеме заполнения аппарата искусственного кровообращения целевой концентрации пропофола;
– впервые количественно определена прогностически значимая для непреднамеренного пробуждения степень снижения гематокрита при начале искусственного кровообращения;
– впервые количественно установлено граничное значение градиента температур при охлаждении и согревании пациента на этапе искусственного кровообращения для прогнозирования непреднамеренного пробуждения;
– доказана возможность использования показателей 95% частоты спектрального края и спектральной энтропии с верификацией по нативной электроэнцефалограмме для контроля глубины сна во время кардиохирургических вмешательств в условиях искусственного кровообращения.
Практическая значимость полученных результатов
– доказана важность использования мониторинга глубины сна во время операций с применением искусственного кровообращения;
– выявлены наиболее критические моменты с точки зрения глубины гипнотического компонента анестезии во время искусственного кровообращения;
– предложен способ определения дополнительной дозы гипнотика, основанный на поддержании целевой плазменной концентрации препарата, для обеспечения стабильности гипнотического компонента анестезии во время искусственного кровообращения;
– установлен числовой показатель степени гемодилюции при начале искусственного кровообращения, практически значимый для профилактики непреднамеренного пробуждения;
– доказана важность поддержания минимального градиента между температурой, измеренной назофарингеально и ректально, в фазу охлаждения и согревания искусственного кровообращения;
– установлено, что для большей достоверности инструментального мониторинга глубины сна целесообразно анализировать минимум две производные ЭЭГ с оценкой их сонаправленности и верификацией с нативной ЭЭГ.
Положения, выносимые на защиту
1. Доза пропофола, рассчитанная по целевой плазменной концентрации и добавленная в первичный объем заполнения аппарата искусственного кровообращения, компенсируя дилюционный компонент непреднамеренного пробуждения в момент начала искусственного кровообращения, стабилизирует глубину сна.
2. Снижение гематокритного числа более чем на 40% от его уровня перед началом искусственного кровообращения повышает риск непреднамеренного пробуждения во время операций с использованием аппарата искусственного кровообращения.
3. Увеличение градиента между ректальной и назофарингеальной температурами более чем на 1,8°C повышает риск непреднамеренного пробуждения во время этапа искусственного кровообращения.
Апробация работы
Результаты исследования доложены и обсуждены:
– на шестом всероссийском съезде по экстракорпоральным технологиям (Санкт-Петербург, 2008 г.);
– на научной конференции совета молодых ученых и специалистов ФГУ «Федеральный центр сердца, крови и эндокринологии имени » (Санкт-Петербург, 2009 г.);
– на седьмой Всероссийской научно-методической конференции с международным участием «Стандарты и индивидуальные подходы в анестезиологии и реаниматологии» (г. Геленджик, 2010 г.);
– на 539-м заседании научно-практического общества анестезиологов и реаниматологов Санкт-Петербурга (2010 г.);
– на заседании проблемной комиссии № 2 «Эфферентная терапия, токсикология, анестезиология и реаниматология, трансфузиология, трансплантология, патофизиология» ГОУ ДПО СПбМАПО (Санкт-Петербург, 2010 г.).
Реализация результатов работы
Результаты исследования внедрены в практическую работу отделения анестезиологии и реанимации клиники СПбМАПО и используются в учебной работе кафедры анестезиологии и реаниматологии им. СПбМАПО и кафедры функциональной диагностики СПбМАПО.
Публикация материалов исследования
По теме диссертации опубликовано 8 работ, из которых три – в журналах, рекомендованных ВАК РФ.
Личный вклад автора в получении научных результатов,
изложенных в исследовании
Автор непосредственно участвовала в составлении плана исследования, в отборе пациентов, их предоперационном обследовании, подготовке к оперативным вмешательствам, в операциях в качестве анестезиолога, а также в ведении послеоперационного периода. Весь материал, представленный в диссертации, получен, обработан и проанализирован лично автором.
Структура и объем диссертации
Диссертация состоит из введения, 4 глав, заключения, выводов, практических рекомендаций и списка литературы. Работа изложена на 122 страницах машинописного текста, включая 10 таблиц и 14 рисунков. Библиографический указатель включает 140 источников литературы, в том числе 18 – отечественных и 122 – зарубежных авторов.
Содержание работы
Материал и методы исследования
Обследовано 80 пациентов, подвергшихся кардиохирургическому вмешательству в условиях искусственного кровообращения. В исследование включены 64 пациента. Средний возраст исследуемых пациентов составил 55,9 ± 1,5 лет (от 19 до 77 лет). Среди них было: мужчин -,2%) и женщин -,8%). Пациенты были разделены на две группы. В контрольной группе 29 пациентов, им была проведена стандартная, принятая в клинике, методика анестезии с использованием пропофола, фентанила, ардуана. В исследуемой группе 35 пациентов. Методика анестезии отличалась только добавлением в объем первичного заполнения АИК расчетной дозы пропофола исходя из необходимой плазменной концентрации – 7,5 мг∙лˉ¹. Это связано с гемодилюцией при начале ИК в связи с увеличением объема распределения препарата на объем первичного заполнения контура аппарата искусственного кровообращения, т. е. на 1600 мл. При этом дополнительная доза гипнотика составила всего лишь 1,2 мл 1% раствора пропофола. Этим мы не только предотвращали снижение концентрации пропофола в плазме пациента в момент начала искусственного кровообращения, но и обеспечивали – в максимально возможной степени! – ее стабильность.
Критерии включения пациентов в исследование: выполнение планового оперативного вмешательства в условиях искусственного кровообращения и одинаковая методика внутривенной анестезии в условиях искусственной вентиляции легких. Основания для исключения: оперативные вмешательства, выполняемые на работающем сердце, некачественная регистрация ЭЭГ, оперативные вмешательства, выполняемые в условиях глубокой гипотермии.
Для контроля глубины сна использовалась мультипараметрическая электрофизиологическая система «NicoletOne Monitor» (VIASYS). Она позволяет записывать полноценную нативную ЭЭГ – до 16 каналов, а также до нескольких десятков ее производных (частотных, амплитудных, спектральных и т. д.). Преимущество системы - это возможность оценивать сразу несколько производных ЭЭГ с одновременной оценкой качества исходного сигнала с помощью полноценной нативной ЭЭГ. Данное преимущество позволило выявить некачественные записи ЭЭГ (20%) несмотря, на первый взгляд, правильно регистрируемые тренды. Это обстоятельство значительно повысило достоверность полученных результатов.
Регистрация осуществлялась с помощью чашечковых ЭЭГ–электродов. Активные электроды располагались в точках Fp1, Fp2, C3, C4; с референтом на точке Fz (по системе 10–20). Импеданс поддерживался менее 5 кОм. Проводился анализ нативной ЭЭГ (при стандартной развертке 30 мм∙с-1) и ее производных, выводимых в виде трендов с временным сжатием. Для каждого отведения вычисляли по два производных – 95% частоты спектрального края (SEF) и спектральную энтропию (SEM). Оценивали согласованность (однонаправленность) обеих производных, но количественная оценка производилась по тренду 95% частоты спектрального края, т. к. там наблюдалась более отчетливая динамика. Для оценки влияния искусственного кровообращения на глубину сна проводилась оценка параметров 95% частоты спектрального края. Результаты сохранялись в виде непрерывного тренда за все время оперативного вмешательства. Для последующего анализа дополнительно фиксировались данные в нескольких точках: до индукции, непосредственно перед подключением аппарата искусственного кровообращения (эти данные принимались за исходные), затем в течение первых 10 мин искусственного кровообращения, каждые 10 мин на этапе охлаждения, на этапе достижения целевой температуры, каждые 10 мин на этапе согревания, и через 10 мин после окончания искусственного кровообращения. В итоге был вычислен показатель, отражающий относительное изменение глубины сна до и после подключения АИК в сравнении с уровнем ее активности во время бодрствования, т. е. перед началом анестезии. Вычисления проводились по следующей формуле:
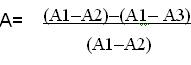
, где (1)
А – показатель, отражающий динамику и направление изменения частоты спектрального края
А1 – частота спектрального края до начала индукции анестезии;
А2 – частота спектрального края перед началом ИК;
А3 – частота спектрального края через 10 мин после начала ИК. Значение А3 соответствовало частоте спектрального края в каждой точке измерения активности ЦНС в течение искусственного кровообращения и через 10 мин после окончания ИК.
Таким образом, полученный показатель отражает динамику изменения частоты спектрального края при подключении АИК, а значит степень изменения глубины сна. Кроме того, были проанализированы тренды 95% частоты спектрального края (SEF) и спектральной энтропии (SEM) во время наименее травматичных этапов операции с целью оценки пределов изменения показателей, которые соответствуют стабильному уровню глубины анестезии. Диапазон вычисляемого индекса, который соответствует стабильному уровню анестезии, был определен в пределах от -0,2 до +0,2. Значения выше или ниже этих границ расценивались как изменение глубины сна.
Исследования, связанные с анализом данных электроэнцефалограммы были выполнены при консультативной поддержке кандидата медицинских наук доцента кафедры функциональной диагностики ГОУ ДПО СПбМАПО Николая Юрьевича Александрова, за что автор приносит ему глубочайшую благодарность.
Результаты исследования
Полученные результаты показывают, что в течение оперативного вмешательства динамика глубины сна была отличной у пациентов двух групп:
• от начала индукции до начала ИК разницы в глубине сна не определяется;
• с началом ИК значения частоты спектрального края в контрольной группе пациентов повышались, что говорит об уменьшении гипнотического компонента анестезии, т. е. снижении глубины сна, причем это различие статистически высокодостоверно (р<0,001);
• на этапе охлаждения мы наблюдали снижение глубины сна в обеих группах. Но в контрольной группе показатель частоты спектрального края превышал этот же параметр до начала ИК, а в исследуемой группе превышал в достоверно меньшей степени (рис. 1).
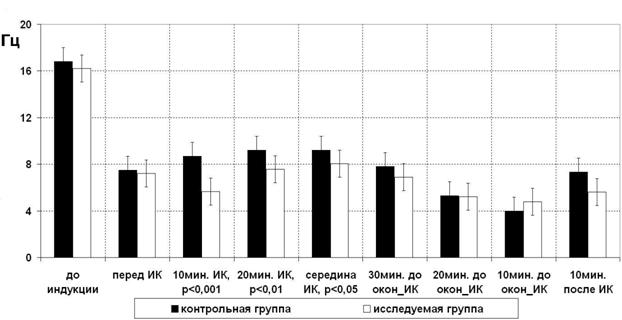
Рисунок 1. Динамика частоты спектрального края на разных этапах оперативного вмешательства, средние значения.
Таким образом, влияние ИК наименьшим образом сказалось на глубине сна у пациентов исследуемой группы.
Пациентов обеих групп проанализировали по степени изменения глубины сна в течение периода искусственного кровообращения:
• во время начала ИК и в течение периода охлаждения у 45-52% пациентов в контрольной группе наблюдается снижение глубины сна. В исследуемой группе их доля уменьшилась до 9-15% (рис. 2-А);
• число пациентов со стабильной глубиной сна в контрольной группе составляет от 22 до 24%, а в исследуемой группе их число составило от 49 до 52% (рис. 2-В);
• количество пациентов с увеличением глубины сна больше в исследуемой группе и составляет от 27 до 40%, а в контрольной от 29 до 31% (рис. 2-С).
Таким образом, добавление в объем первичного заполнения АИК дополнительной дозы пропофола позволяет обеспечить достоверно (p<0,001) бóльшую стабильность глубины сна и доказывает дилюционный механизм снижения глубины сна при начале искусственного кровообращения.
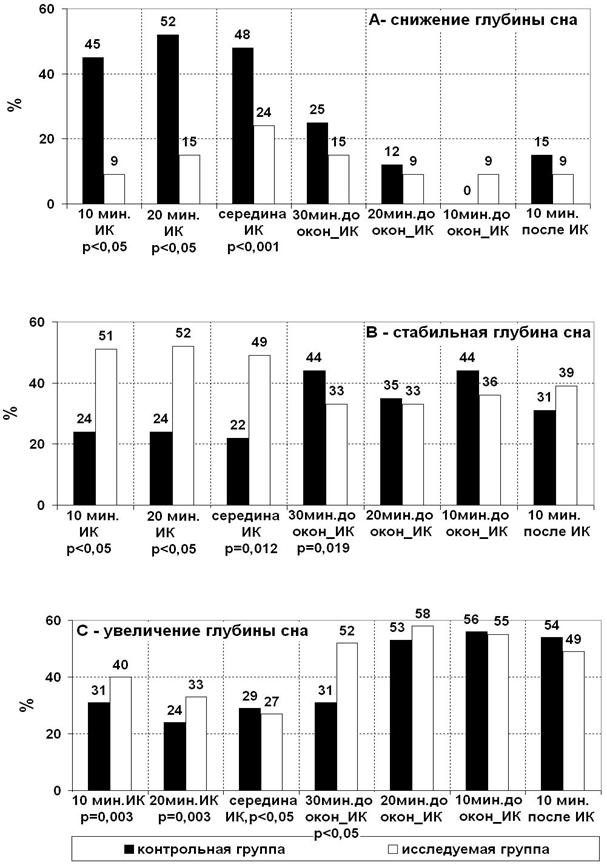
Рисунок 2. Динамика глубины сна в течение периода искусственного кровообращения: А – снижение глубины сна, В – стабильная глубина сна, С – увеличение глубины сна, % от числа пациентов в группе.
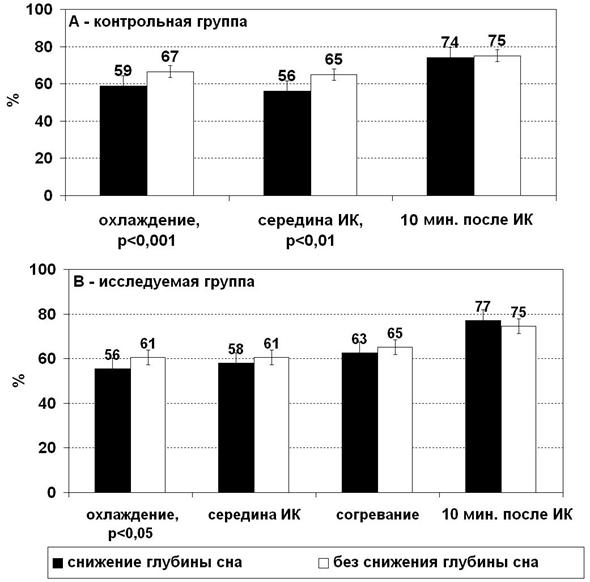
Рисунок 3. Изменение гематокрита (в % от значения перед искусственным кровообращением) у пациентов: А – контрольной группы, В – исследуемой группы в зависимости от динамики глубины сна.
Подтвердив дилюционный механизм снижения глубины сна при начале ИК, мы проанализировали динамику гематокрита с началом и в течение ИК. Также проведен анализ динамики этого показателя у пациентов со снижением глубины сна и у тех, у кого глубина сна не снижается с началом перфузии. В качестве исходных данных брали гематокритное число перед подключением АИК и сравнивали его со значением гематокритного числа после начала перфузии. В итоге получили показатель, отражающий долю гематокритного числа при начале перфузии относительно его значения до подключения АИК. Степень снижения гематокрита менее выражена у тех пациентов, у кого глубина сна не снижается. Это заметно на этапе охлаждения (p<0,001) и в середине ИК (p<0,01) в контрольной группе. У пациентов со снижением глубины сна гематокрит снижается до 59% и менее от его уровня перед подключением АИК (рис. 3-А).
У пациентов исследуемой группы закономерность сохраняется, но достоверность выявляется только на этапе охлаждения (p<0,05). На последующих этапах искусственного кровообращения степень снижения гематокрита у пациентов с различной динамикой глубины сна различается недостоверно, но тенденция сохраняется (рис. 3-В).
Таким образом, снижение гематокритного числа более чем на 40% от его уровня перед началом искусственного кровообращения повышает риск непреднамеренного пробуждения во время операций с использованием аппарата искусственного кровообращения.
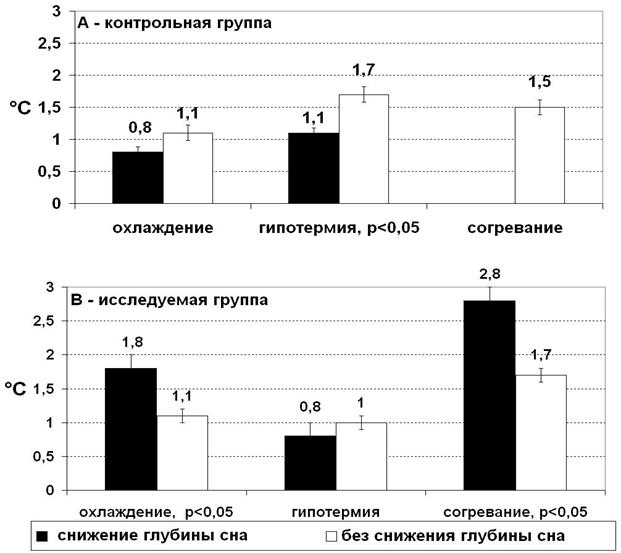
Рисунок 4. Градиент температур у пациентов с различной динамикой глубины сна: А – контрольная группа, В – исследуемая группа.
Учитывая, что температура тела пациента в течение основного этапа операции изменяется (охлаждение, гипотермия, согревание), была исследована взаимосвязь градиента между ректальной и назофарингеальной температурами и степенью глубины сна в каждой из двух групп пациентов.
Результаты показали, что в контрольной группе достоверная разница по этому показателю выявлена только в период гипотермии (p<0,05; рис. 4-А). Однако считаем, что делать вывод о градиенте температур как о факторе риска незапланированного восстановления сознания (НВС) по данным, полученным в контрольной группе нельзя. Это связано с отсутствием в одной из точек пациентов со снижением глубины сна, а также с более выраженным влиянием на глубину сна других факторов, которые маскируют значимость градиента температур. В данном случае это вероятно гемодилюция, которая влечет за собой снижение гипнотического компонента анестезии.
В исследуемой группе взаимосвязь между градиентом температур и глубиной сна наиболее выражена на этапах охлаждения и согревания (p<0,05). Убрав такой важный фактор, как недостаточность гипнотика в результате дилюции, мы выявили значение градиента температур на глубину сна (рис. 4-В).
Полученные результаты свидетельствуют, что увеличение градиента между ректальной и назофарингеальной температурами более чем на 1,8°C повышает риск непреднамеренного пробуждения во время этапа искусственного кровообращения.
Всем пациентам была проведена оценка риска хирургического вмешательства и прогнозируемой летальности по критериям шкалы EuroScore (сокр. англ. European System for Cardiac Operative Risk Evaluation). Был проведен анализ изменения этого показателя у пациентов с разной динамикой глубины сна.
В контрольной группе, при снижении глубины сна, преобладают пациенты с более высокой прогнозируемой оценкой летальности по шкале EuroScore (рис. 5-А). У тех, у кого не отмечалось снижения глубины сна во время искусственного кровообращения, прогнозируемая оценка летальности ниже. Эти различия достоверны (p < 0,05). В исследуемой группе ситуация изменилась с точностью до наоборот. У пациентов со снижением глубины сна прогнозируемая оценка летальности ниже (p < 0,01; рис. 5-В).
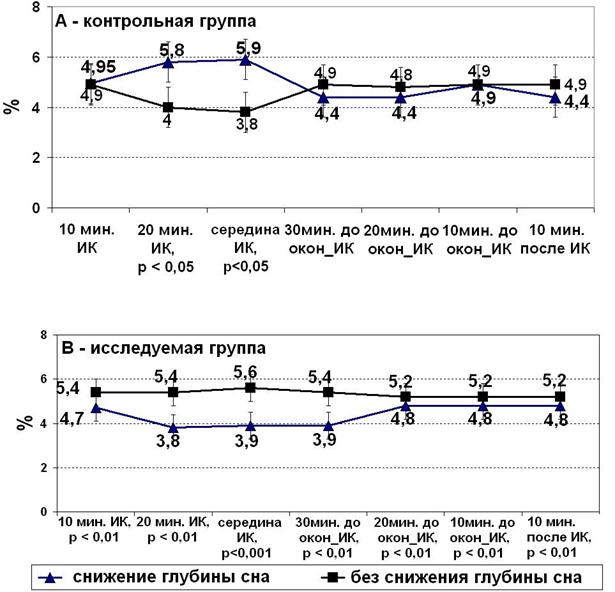
Рисунок 5. Оценка прогнозируемой летальности по шкале EuroScore у пациентов с различной динамикой глубины сна: А – контрольная группа, В – исследуемая группа.
Таким образом, зависимости риска непреднамеренного пробуждения во время кардиохирургической операции от результатов прогнозируемой оценки летальности по шкале EuroScore не выявлено.
Для выявления влияния уровня РаСО2 на активность ЦНС мы сравнили количество пациентов с нормо - и гипокапнией отдельно среди пациентов со снижением глубины сна с началом ИК и среди тех, у кого начало ИК не сопровождалось снижением глубины сна. Гипокапнией считали уровень РаСО2 ≤ 32,0 мм рт ст, остальные пациенты были отнесены к группе с нормокапнией.
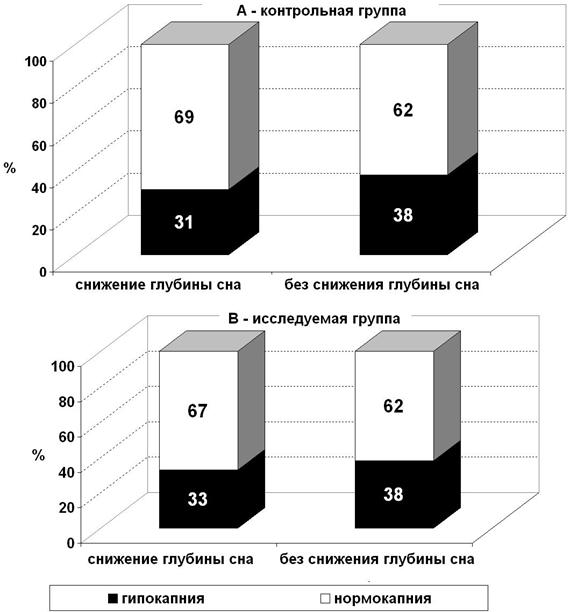
Рисунок 6. Число пациентов с разным уровнем РаСО2 при различной динамике глубины сна при подключении АИК: А – контрольная группа, В – исследуемая группа.
Доля пациентов с гипо - и нормокапнией на фоне различной глубины сна в обеих группах практически одинаковая (рис. 6). При анализе взаимосвязи между значениями частоты спектрального края и различными диапазонами значений РаСО2 на разных этапах операции, достоверных различий обнаружено не было (таб. 1).
На этом основании мы считаем, что зависимости между уровнем РаСО2 и глубиной сна во время искусственного кровообращения также не выявлено.
Таблица 1
Частота спектрального края в зависимости от уровня РаСО2
этапы операции значение РаСО2 , мм. рт. ст. | пЕРЕД ИК | НачАЛО ИК | СерЕДИНА ИК | Конец ИК |
РаСО2 ≤ 32,0 | 7,3 ± 0,9 | 5 ± 1,0 | 8,6 ± 0,38 | 4,8 ± 0,9 |
РаСО2 ≥ 41,0 | 8,8 ± 3,7 | 7,8 ± 1,8 | 8,5 ± 0,53 | 4,1 ± 1,1 |
РаСО2= 33,0-40,0 | 7,2 ± 0,75 | 7,2 ± 0,52 | 8,5 ± 0,4 | 4,4 ± 0,66 |
РаСО2 ≥ 41,0 | 8,8 ± 3,7 | 7,8 ± 1,8 | 8,5 ± 0,53 | 4,1 ± 1,1 |
Для выявления возможных последствий недостаточной глубины сна во время оперативного вмешательства, мы решили сравнить осложнения в послеоперационном периоде у пациентов с различной динамикой глубины сна при начале ИК (таб. 2). При статистическом анализе полученных данных достоверных различий обнаружено не было.
Мы не включили в анализ количество рестернотомий по поводу кровотечений, т. к. все случаи были связаны с наличием хирургического источника кровотечения. Три эпизода острой почечной недостаточности (ОПН), также на наш взгляд, не были связаны с изменением глубины сна во время оперативного вмешательства. Это осложнение было результатом большого объема кровопотери и синдромом массивной гемотрансфузии.
Летальные исходы у пяти пациентов не были связаны с предметом данного исследования, а обусловлены течением основного заболевания, объемом хирургического вмешательства или сопутствующей патологией.
Таблица 2
Длительность ИВЛ, пребывания в ОРИТ и частоты осложнений у пациентов с различной динамикой глубины сна при начале ИК
уровень глубины сна п/о период | снижение глубины сна | без снижения глубины сна |
Энцефалопатия | 3 (18,7%) | 5 (10,5%) |
Длительность ИВЛ, ч | 28,5 ± 14,2 | 31,2 ± 10,5 |
Длительность нахождения в ОРИТ, ч | 72,6 ± 20,6 | 99,6 ± 23,0 |
Летальность | 1 (6,25%) | 4 (8,3%) |
В контрольной группе у трех пациентов начало ИК сопровождалось значительным снижением глубины сна, согласно показателю частоты спектрального края, значение которого повысилось с началом ИК до его уровня перед началом анестезии. Мы проанализировали их отдельно (таб. 3). Никто из них не сообщил об интраоперационных воспоминаниях.
У всех пациентов значение гематокритного числа при подключении АИК уменьшилось более чем на 40%. У одного пациента из них высокий риск летальности по шкале EuroScore (сокр. англ. European System for Cardiac Operative Risk Evaluation). Градиент температур не достиг критического значения ни у одного пациента. Продленная ИВЛ была связана с дыхательной недостаточностью на фоне хронической обструктивной болезни легких, а смерть пациента произошла уже на профильном отделении, через 39 суток после операции, что, вряд ли связано с недостаточной глубиной сна во время хирургического вмешательства. Таким образом, полученные результаты подтверждают значимость механизма дилюции в уменьшении глубины сна при начале ИК.
Таблица 3
Характеристика пациентов со значительным снижением
глубины сна при начале ИК
Признак | Пациент 1 | Пациент 2 | Пациент 3 |
Пол | муж | муж | муж |
EuroScore | 4/2,6% | 5/3,5% | 7/8,6% |
Объем операции | АКШ, плМК | ПАК | АКШ |
Снижение Ht | > 40% | > 40% | > 40% |
Градиент t на разных этапах ИК, oC | 1,4*; 1,6**; 1,7*** | 1,1*; 1,4**; 0,6*** | 0,5*; 0,5**; 1,2*** |
Уровень РаСО2 | нормокапния | нормокапния | нормокапния |
Длительность ИВЛ, ч | 7 | 16 | 6 |
Длительность в ОРИТ, ч | 24 | 288 | 48 |
Осложнения | нет | дыхат. нед-ть, энцефалопатия | нет |
Исход | выписан | смерть на 39-е сутки | выписан |
Примечание: *- период охлаждения, **- период гипотермии, ***- период согревания; АКШ - аортокоронарное шунтирование, плМК – пластика митрального клапана, ПАК – протезирование аортального клапана.
Исходя из множества публикаций (Auroy Y. et. al., 2004; Eger E. I. et. al., 2005; Orser B. A. et. al., 2008; Pollard R. J. et. al., 2007), становится понятным, что проблема НВС актуальна, но, в то же время, еще находится в стадии изучения. Остается множество вопросов, которые не имеют однозначного ответа: частота встречаемости НВС и значимость (Hans P. et. al., 2005; Pollard R. J. et. al., 2007), факторы риска НВС (Akavipat P. et al., 2009; Blussé Van Oud-Alblas H. J. et. al., 2008; Errando C. L. et al., 2008; Ezri T. et. al., 2007), необходимость применения монитора глубины анестезии (International Standards for a Safe Practice of Anaesthesia, 2008; Ekman A. et. al., 2004; Sneyd J. R et. al., 2008), какой из мониторов наиболее объективен (Hans P. et. al., 2005; Shin H. W. et. al., 2004).
Одним из факторов риска, характерных для операций с искусственным кровообращением, является гемодилюция (Habib R. H. et. al., 2005; Karkouti K. et. al., 2005; Mathew J. P. et. al., 2007; Ranucci M. et. al., 2010). Снижения концентрации гипнотика при начале ИК не избежать из-за, практически одномоментного, увеличения объема распределения лекарственных препаратов (Ahonen J. et. al., 2000; Yoshitani K. et. al., 2003). Следовательно, необходимость в контроле уровня глубины сна становится очевидной. Предложенная методика поддержания стабильности анестезии при начале ИК, подтверждает дилюционный механизм снижения глубины сна, и выявляет другие факторы, которые, по всей видимости, имеют значение в увеличении риска НВС.
Обнаружив зависимость степени глубины сна от степени снижения гематокрита, мы получаем в руки еще один механизм, который позволит предупреждать критическое снижение концентрации гипнотика при использовании АИК, а, следовательно, и развитие НВС. Это становится актуальным для практического анестезиолога, особенно при отсутствии в операционной монитора функций ЦНС или иного монитора глубины анестезии.
Контроль градиента между назофарингеальной и ректальной температурами также способствует поддержанию стабильности глубины сна. В результатах нашего исследования мы не нашли подтверждение зависимости глубины сна от уровня РаСО2 и результатов дооперационной оценки тяжести состояния и прогнозируемой летальности по шкале EuroScore.
Считаем, что полученные результаты, безусловно, не ставят точку в решении вопроса о факторах риска НВС при операциях с использованием АИК, но надеемся, что они внесут свою лепту в решение этой проблемы в будущем.
Согласно официальным документам, использование мониторов глубины анестезии носит лишь рекомендательный характер (American Society of Anesthesiologists, 2006). Игнорирование использования мониторов глубины анестезии рассматривается как фактор риска НВС (Akavipat P. et. al., 2009; Ghoneim M. M., 2007).
Исходя из анализа современной научной литературы и собственного опыта использования монитора для контроля глубины сна, мы делаем вывод, что «идеального» монитора глубины анестезии пока нет и необходимы дальнейшие исследования в этой области. Перспективными представляются дальнейшие исследования, направленные на поиск параметров ЭЭГ, изменения которых будут отражать непосредственный риск НВС. «Идеальный» монитор должен обладать одновременно необходимой и достаточной чувствительностью. Его показатели должны быть максимально клинически значимыми. Представляется важным разработка монитора (возможно отечественного) способного достоверно отражать глубину сна при работе с различными анестетиками. Возможно, разработчики должны откалибровать аппарат в условиях работы с различными гипнотиками. Тогда анестезиолог сможет выбрать на панели управления, соответствующий методике анестезии, режим работы монитора. Исходя из специфики пациентов кардиохирургического профиля, полезным был бы монитор, способный достоверно отражать глубину сна в условиях различной температуры, особенно в условиях глубокой гипотермии.
Однако, несмотря на некоторые недостатки существующих мониторов глубины анестезии, с учетом всего изложенного мы убеждены, что возможные последствия после перенесенного НВС слишком серьезны, чтобы игнорировать их профилактику в практической работе.
Выводы
1. Риск непреднамеренного пробуждения пациента наиболее высок в начале искусственного кровообращения, когда снижение глубины сна отмечается примерно у 45% больных.
2. Динамическая совместная оценка частоты спектрального края и спектральной энтропии электроэнцефалограммы позволяет достоверно выявлять моменты, опасные в отношении непреднамеренного пробуждения пациента.
3. Добавление в объем первичного заполнения аппарата искусственного кровообращения дозы пропофола, рассчитанной по целевой концентрации препарата в плазме крови и компенсирующей дилюционный механизм непреднамеренного пробуждения, позволяет обеспечить достоверно бóльшую стабильность глубины сна.
4. Вероятность непреднамеренного пробуждения пациента во время кардиохирургической операции с искусственным кровообращением повышается при снижении гематокритного показателя в момент начала искусственного кровообращения более чем на 40% от исходной величины.
5. При условии поддержания постоянной целевой плазменной концентрации гипнотика вероятность непреднамеренного пробуждения пациента повышается с ростом градиента температур между ядром и оболочкой тела свыше 1,8°C.
6. Уровень РаСО2 и показатель предоперационного прогноза летальности по шкале EuroScore не являются предикторами непреднамеренного пробуждения во время кардиохирургической операции с использованием искусственного кровообращения.
Практические рекомендации
1. При кардиохирургических вмешательствах в условиях искусственного кровообращения целесообразно проводить мониторинг глубины сна.
2. Для профилактики снижения концентрации гипнотика в плазме пациента необходимо добавлять в аппарат искусственного кровообращения пропофол в расчете на его должную плазменную концентрацию в количестве 7,5 мг∙лˉ¹ объема экстракорпорального контура.
3. Гематокритное число, отражающее степень дилюции, можно использовать в качестве косвенного признака повышения риска незапланированного восстановления сознания. При снижении гематокрита более чем на 40% от его уровня до начала искусственного кровообращения следует углубить анестезию под контролем монитора глубины сна.
4. В периоды охлаждения и согревания больного целесообразно поддерживать разницу между назофарингеальной и ректальной температурами не более 1,8°C.
5. Система «NicoletOne Monitor» может использоваться практикующими анестезиологами-реаниматологами в качестве инструмента для оценки глубины сна, однако особенности прибора делают его применение наиболее целесообразным при проведении научных исследований.
6. Для достижения бóльшей достоверности результатов инструментальной оценки глубины сна при анализе нативной электроэнцефалограммы следует использовать минимум две ее производные (частота спектрального края и спектральная энтропия) с целью оценки их однонаправленности.
Список работ, опубликованных по теме диссертации
1. Пантеева глубины анестезии при операциях с искусственным кровообращением / , , // Материалы VI Всероссийского съезда по экстракорпоральным технологиям. – Санкт-Петербург, 2008. – С. 43–44.
2. Пантеева кровообращение и глубина анестезии // Сборник научных трудов I ежегодной научной конференции совета молодых ученых и специалистов ФГУ «ФЦСКЭ имени Росмедтехнологий» 19-20 ноября 2009 года [Электронный ресурс]. – Режим доступа: http://www. *****/files/Thes-konfCMYC. pdf – Проверено 29.11.2009.
3. Пантеева пробуждение пациентов во время операций с искусственным кровообращением: что мы можем и что мы должны делать? / , , // Вестник хирургии. – 2010. – Т. 169. – № 6. – С. 113.
4. Пантеева и профилактика колебаний уровня глубины анестезии при операциях в условиях искусственного кровообращения с использованием производных электроэнцефалограммы / , , // Вестник интенсивной терапии. – 2008. – № 5. – Вопросы общей анестезиологии. – С. 90–92.
5. Пантеева анестезии и ее стабильность при операциях с использованием искусственного кровообращения / , , // Эфферентная терапия. – 2009. – Т. 15. – № 3-4. – С. 101–106.
6. Пантеева анестезии при операциях с использованием искусственного кровообращения: как обеспечить стабильность? / , , // Вестник интенсивной терапии. – 2010. – № 5. – Мониторинг. – С. 68–72.
7. ЭЭГ как инструмент оценки глубины анестезии / , , // Эфферентная терапия. – 2010. – Т. 16. – № 4. – С. 28–34.
8. Пантеева применения трех различных мониторов для контроля глубины сна во время кардиохирургических операций / , , // Эфферентная терапия. – 2011. – Т. 17. – № 1. – С. 58–61.