К частому употреблению алкоголя при сборе анамнеза относили указания на прием крепких спиртных напитков 1 раз в неделю и чаще.
Биохимические исследования проводили на системном автоматизированном анализаторе Konelab 20, с производительностью 200 фотометрических исследований в час. В работе применяли биохимические наборы и контрольные материалы Konelab компании Thermo Clinical Labsystems, Финляндия.
Динамику основных показателей функционального состояния печени осуществляли по данным биохимического анализа крови, который выполняли при поступлении в стационар, а затем – ежемесячно. Оценивали уровень общего, связанного и свободного билирубина, активность маркёрных ферментов печени (АЛТ, АСТ, ГГТП, ЩФ), протромбиновый индекс – ПТИ, фибриноген, тимоловую пробу.
Пациентам с маркёрами гепатитов В и/или С проводили пункционную биопсию печени, воспаление и склероз в гистологических препаратах оценивали по R. G.Knodell (1981), , (1996).
Чрескожную пункционную биопсию печени осуществляли иглой Менгини под наркозом в условиях операционной. Пункционный материал направляли в патоморфологическую лабораторию. Фрагменты ткани фиксировали в 10 %-ном нейтральном формалине, обезвоживали в спиртах восходящей концентрации и заключали в парафин. В срезах, окрашенных гематоксилином и эозином и по ван Гизону, определяли активность некровоспалительных изменений по принципам полуколичественной оценки R. G. Knodell et al., по схеме , с добавлением таких параметров, как жировая дистрофия гепатоцитов (0–3 балла), наличие нейтрофильных гранулоцитов в синусоидах (0–3 балла), перицеллюлярный (0–3 балла), и перицентральный фиброз (0–3 балла), апоптозные тельца перисинусоидально (0–2 балла), плазмоцитарная инфильтрация портальных трактов (0–3 балла).
Использовали усовершенствованный нами антипириновый тест, основанный на методе B. B. Brodie и соавторов (1949) в модификации D. Davidsson, J. Mac Intyre (1956) (Патент на изобретение № /15 от 01.01.2001).
Иммунологические методы исследования. Иммунологическое обследование включало количественную оценку лимфоцитов и их субклассов, несущих молекулы CD3+, CD4+, CD8+, CD16+, CD19+ с помощью моноклональных антител, меченных флюорохромами (ФИТЦ, фикоэритрин, перидид-хлорофильный протелин) производства "Сорбент", "МедБиоСпектр" (Россия) и Becton Dickinson (США). Функциональную активность моноцитарно-макрофагального звена оценивали определением гранулоцитов и моноцитов, поглотивших латекс, меченый ФИТЦ, экспрессии молекул HLA-DR ("Сорбент", Россия) на моноцитах; активированной и спонтанной люцигенинзависимой хемилюминесценции нейтрофилов, содержания клеток, продуцирующих ФНО.
Цитометрию проводили с помощью программы CellQuest (Becton Dickinson, США) на приборе FACSCallibur (Becton Dickinson, США). Данные методы выполняли в соответствии с описаниями, представленными в инструкциях производителей антител.
Режимы противотуберкулёзной терапии. Группа больных с интермиттирующим режимом лечения два раза в неделю получала четыре противотуберкулёзных препарата (ПТП): внутрь этамбутол из расчёта 20 мг/кг или пиразинамид 25 мг/кг, спустя 1 час – внутримышечно стрептомицин или канамицин в дозе 16 мг/кг, и ещё через 1 час – внутривенно капельно изониазид 12 мг/кг, а затем рифампицин 7,5 мг/кг. Соблюдали строгую последовательность назначения лекарственных средств, с учётом скорости создания максимальной концентрации препаратов в лёгких при разных способах их введения.
Ежедневную химиотерапию осуществляли согласно регламентирующим положениям, изложенным в приказе № 000 от 21.03.03.
На фоне проводимой в течение шести и более месяцев химиотерапии изучали динамику туберкулёзного процесса, используя следующие критерии: скорость прекращения бактериовыделения и закрытия полостей распада.
Методика комплексного лечения пациентов туберкулёзом лёгких с сопутствующими ХГ, включающая интермиттирующую терапию противотуберкулёзными препаратами и реафероном. С целью повышения эффективности терапевтического ведения больных туберкулёзом легких с сопутствующими хроническими гепатитами В и С использовали рекомбинантный интерферон-a – реаферон-ЕС («Вектор-Медика», Новосибирск, Россия) в дозе 3 млн. МЕ сухого вещества, растворенного в 50 мл физиологического раствора ректально капельно в течение 30 минут спустя 15–20 минут после внутривенного введения химиопрепаратов 2 раза в неделю, в дни проведения противотуберкулёзной терапии.
В среднем пациенты получали реаферон в течение 6-ти месяцев параллельно с интермиттирующей противотуберкулёзной терапией (Патент на изобретение № /14 от 01.01.2001).
Статистические методы исследования. Cтатистическую обработку результатов исследования исследования проводили по стандартным методикам с использованием программного обеспечения Microsoft Excel 2000, Statistica 6.0 и SPSS 12.0. При этом определяли такие статистические показатели, как среднюю арифметическую, стандартное отклонение, стандартную ошибку средней. При выполнении условия нормальности распределения (тест Колмогорова–Смирнова) статистическую значимость различий (р) определяли с помощью t критерия Стьюдента, c² Пирсона, u-критерия Манна–Уитни, парного теста Вилкоксона. Если в таблице 2 х 2 хотя бы одна из сравниваемых частот была менее 5, использовали точный тест Фишера для получения значения достигнутого уровня значимости р.
Относительный риск рассчитывали как отношение заболеваемости среди лиц, подвергавшихся и не подвергавшихся воздействию факторов риска. Отношение шансов (ОШ) определяли как отношение шансов события в одной группе к шансам события в другой группе. Статистическую точность оценки наблюдаемой величины эффекта выражали с помощью 95 % доверительного интервала (ДИ 95 %).
Вероятность исхода (прекращение бактериовыделения или закрытие полостей) оценивали методами Каплана–Майера (К–М) и попарного сравнения с помощью логарифмического рангового критерия. Данные в таблицах представлены в виде среднего арифметического ± стандартная ошибка средней. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Сочетание туберкулёза легких и хронического вирусного гепатита В и/или С является актуальной проблемой медицины из-за частой встречаемости, отсутствия выработанной тактики ведения и лечения таких пациентов, неизученности прогноза течения и исходов туберкулёза легких у больных с сопутствующими хроническими гепатитами.
Исследования отдельных авторов и собственные наблюдения свидетельствуют о высокой частоте встречаемости НВV - и НСV-инфекции среди больных туберкулёзом лёгких. Цифры этой выявляемости значительно варьируют, что можно объяснить различиями эпидемической ситуации (в зависимости от территории и от временного промежутка), объёмом используемых методов диагностики ХГ, а также различиями контингентов обследованных больных.
Так, (1997) и (2003) приводят сведения о пациентах с впервые выявленным туберкулёзом лёгких. Ведущей у них являлась НВV-инфекция.
При обследовании 188-ми пациентов с впервые выявленным туберкулёзом лёгких, последовательно поступивших в НИИТ в 2002 – 2003 году (инфильтративный туберкулёз легких – 165 человек, диссеминированный туберкулёз легких – 19, туберкулёзный плеврит – 4) установлено, что 60 человек (31,9 %) имели положительный результат по одному или нескольким ИФА-маркёрам НВV - и НСV-инфекций. У них гораздо чаще встречалась НСV - и НВV + НСV-инфекция, чем в вышеуказанных исследованиях (таблица 1).
В 2003 – 2004 г. г. обследовано 154 пациента, последовательно поступивших в туберкулёзную больницу № 3 Новосибирска, на маркёры НВV - и НСV-инфекции. Из них у 74-х пациентов (48 %) были выявлены маркеры. Преимущественно инфицированными оказались мужчины (65 больных – 87,8 %) с обострением хронических форм ТЛ, длительно болеющие. Так, обострение туберкулёзного процесса в виде диссеминированного туберкулёза наблюдалось у 7-ми человек (9,5 %), инфильтративного – у 15-ти (20,3 %), фиброзно - кавернозного ТЛ – у 19-ти (25,7 %), казеозной пневмонии (как исход фиброзно-кавернозного туберкулёза) – у 3-х (4 %), т. е. всего таких длительно болеющих пациентов было,5 %). Впервые выявленных больных с диссеминированным туберкулёзом было 7 (9,5 %), с инфильтративным –%). Доли пациентов с различными вариантами гепатитов оказались примерно одинаковыми (рисунок 2).
Таблица 1. Частота встречаемости различных ИФА-маркёров НВV - и НСV-инфекции у больных туберкулёзом лёгких по данным разных авторов (в %)
|
Показатель |
Наши результаты n = 188 |
Данные (1997) n = 266 |
Данные (2003) n = 252 |
|
Маркеры НВV-инфекции |
14,9 % |
43 % |
47,5 % |
|
– в том числе только HBsAg |
4,2 % |
12,1 % |
5,1 % |
|
Маркёры НСV-инфекции |
6,9 % |
2,0 % |
4,8 % |
|
Маркеры НВV + НСV |
10,1 % |
5,4 % |
нет данных |
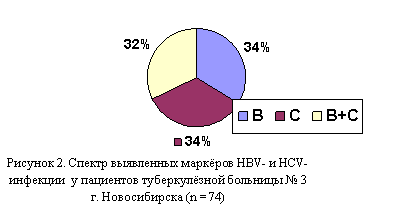
Выявлены следующие маркёры: аHBcorIgM – у 1 (1,35 %), HBsAg – у 8 (10,8 %), аHBcorIgG – у,9 %), HBeAg – у 1 (1,35 %), аHCVIgG – у,6) %, аHCVIgM – у,7 %), то есть, наиболее часто встречали аHBcorIgG и аHCVIgG, причем у 22-х из 50-ти пациентов с аHCVIgG (44 %) обнаруживали аHCVIgM, что указывает на возможную репродуктивную активность вируса HCV.
В группе пациентов, длительно болеющих ТЛ (n = 44), оказались большими доли пациентов с НСV-инфекцией (43,2 %) и НВV + НСV (43,2 %), а доля больных с НВV-инфекцией составила 13,6 %. В группе пациентов с впервые выявленным ТЛ (n = 30) преобладала доля лиц с НВV-инфекцией (63,3 %), чем с НСV (20 %) и НВV + НСV (16,7 %) (в сравнении с длительно болеющими р = 0,0001, χ²). Таким образом, у вирус-инфицированных пациентов с длительно протекающим туберкулёзом в сравнении с впервые выявленными выше относительные риски наличия HCV-инфекции (в 2,2 раза, 95 % ДИ 1,8–2,5), HCV + HBV (в 2,6 раза, 95 % ДИ 2,1–3), а относительный риск HBV-инфекции, наоборот, уменьшается (в 4,6 раза, 95 % ДИ 3,7–5,6). Это можно объяснить тем, что длительно болеющие туберкулёзом больные в 4,3 раза чаще указывают на пребывание в местах лишения свободы в прошлом (р = 0,006, χ²). Также определенную роль в данном процессе, возможно, играет большая частота интегративных форм HBV-инфекции, трудных для диагностики.
Выявление факторов, свидетельствующих о социальной дезадаптации пациентов с туберкулёзом лёгких, повышает у них относительные риски выявления хронических вирусных гепатитов В и С:
- отсутствие постоянной работы (р = 0,03);
- злоупотребление алкоголем (р = 0,009), курение (р = 0,047), употребление наркотиков (р = 0,0005);
- пребывание в местах лишения свободы в прошлом (р = 0,0003);
- слабая приверженность к противотуберкулёзной терапии (р = 0,01).
Отсутствие клинических симптомов туберкулёза легких выявили у 33-х (34,7 %) из 95-ти больных 1 группы (с туберкулёзом лёгких) и 53-х (41,1 %) из 129-ти больных 2 группы (с сопутствующими туберкулёзу хроническими гепатитами В и С) (p > 0,05, c2). То есть, 38,4 % пациентов указывало на отсутствие каких-либо жалоб. Туберкулёз лёгких был выявлен при прохождении ими флюорографического обследования, чаще всего при устройстве на работу.
Наиболее часто у пациентов 1 и 2 групп с наличием жалоб были кашель (62,9 %) с выделением мокроты – (50,4 %), слабость (45,1 %), потливость (41,1 %), снижение массы тела, субфебрилитет, одышка при физической нагрузке. Реже встречались жалобы на повышение температуры до фебрильных цифр, боль в грудной клетке при дыхании и кашле, снижение аппетита. Одной из наиболее часто предъявляемых пациентами жалоб была лихорадка, повышение температуры тела от субфебрильных до фебрильных цифр (50,9 %), побуждавшая пациентов обращаться за врачебной помощью. Данная жалоба значимо реже наблюдалась у пациентов с гепатитами: 58 из 129-ти в сравнении с 56 из 95-ти (р = 0,04, c2).
Пациенты 1 и 2 групп одинаково редко предъявляли гастроинтестинальные жалобы при поступлении: 6 из 95-ти в 1 группе и 11 из 129-ти больных 2 группы (р = 0,7, c2). Наиболее частыми были жалобы на тошноту, тяжесть и боли в правом подреберье, отсутствие аппетита.
Оценка физикальных данных (притупление перкуторного звука, измененное дыхание, хрипы над легкими) при поступлении не выявила значимых различий у больных сравниваемых групп. Не обнаружено и различий показателей общего анализа крови в сравниваемых группах, а также частоты бактериовыделения, выявлявшегося в 1 группе у 74-х (77,9 %) из 95-ти, а в группе больных ТЛ в сочетании в хроническими гепатитами В и С – у 105-ти (81,4 %) из 129-ти пациентов (р = 0,4, c2).
Обращает на себя внимание факт более высокого, в 2,2 раза, риска лекарственной устойчивости к этамбутолу (р < 0,05) и в 2,9 раза – к канамицину (р < 0,05) у пациентов с микст-инфекцией. Оказалось неприемлемым использовать эти весьма активные противотуберкулёзные препараты с наименьшим гепатотоксическим действием у больных с компрометированной вирусом печенью.
Наличие гепатита в 3 раза увеличивало шансы на повышение уровней АЛТ (р < 0,01), в 3,3 раза – АСТ (р < 0,001) и в 4,6 раза – ГГТП (р < 0,0001) в начале противотуберкулёзной терапии. Морфологическая активность гепатита (по шкале Knodell R. G., 1981) прямо коррелировала с уровнями АЛТ (r = 0,49, p = 0,000003), АСТ (r = 0,45, p = 0,00002) и ГГТП (r = 0,4, p = 0,00033).
Таким образом, у пациентов ТЛ с сопутствующими ХГ чаще встречали малосимптомные формы хронического гепатита В и/или С (91,5 %), для которых характерно отсутствие каких-либо гастроинтестинальных симптомов, отсутствие или слабовыраженное повышение активности АЛТ и АСТ (в 1,25–2,45 раза). У них не наблюдали желтухи за всё время пребывания в стационаре.
Скрытое течение ХГ нередко приводит к гиподиагностике и недооценке роли поражения печени при туберкулезе. Оказалось, что хронический гепатит неблагоприятно влияет на легочный процесс: наличие вирусного гепатита у пациентов с туберкулёзом лёгких в 2 раза уменьшало вероятность раннего (до 3-х месяцев) прекращения бактериовыделения и в 2,3 раза уменьшало вероятность благоприятной рентгенологической картины при выписке из стационара.
Пункционная биопсия печени выполнена 84-м больным с впервые выявленным ТЛ, у которых при поступлении в клинику ННИИТ обнаружены: хронический гепатит В –,9 %), С –,4 %), В + С –,8 %). В группе сравнения было 49 больных ТЛ без признаков гепатита.
Обнаружены морфологические особенности гепатитов у больных туберкулезом легких: более частое выявление реактивного компонента воспаления – полиморфноядерных лейкоцитов среди клеток воспалительного инфильтрата портальных трактов и дольковой паренхимы; липофусциноз, преимущественно перицентральных отделов долек; центро-перицентральное полнокровие, иногда сопровождающееся атрофией гепатоцитарных трабекул центральных отделов долек; перицентральный фиброз. Все эти особенности указывают, по всей видимости, на наличие у больных длительного нарушения венозного оттока от печени и являются также морфологическим отражением изменений, связанных с более частым употреблением алкоголя и наркотиков больными рассматриваемых групп (на частое употребление алкоголя указывала половина пациентов ТЛ с ХГ, на употребление наркотиков внутривенно – 1/5 больных).
По всем параметрам полуколичественной оценки гистологических изменений в печени показатели при ХГС и ХГВС превышали аналогичные показатели при ХГВ. Представляет интерес сравнение морфологических изменений, которые входят в число так называемых «морфологических маркеров» этиологии ХГ. Триада признаков, характерных для ХГС (жировая дистрофия гепатоцитов, лимфоидные фолликулы, повреждение желчных протоков), значимо реже встречалась у пациентов с ХГВ. Наличие двух вирусов (В + С) приводило к усилению повреждений в печени (таблица 2). Наши данные также свидетельствуют о более выраженной стадии хронизации (фиброза) на момент исследования у больных с ХГС и ХГВС, что позволяет рассматривать эту группу пациентов противотуберкулезных учреждений как группу повышенного риска развития гепатотоксических реакций при проведении противотуберкулезной терапии.
Таблица 2. Результаты полуколичественной оценки* патоморфологических показателей биоптатов печени у пациентов с вирусными гепатитами
|
Параметры (баллы) |
Тип гепатита |
р** | |||
|
I ХГВ (n = 36) |
II ХГС (n = 23) |
III ХГВС (n = 25) |
I–II |
I–III | |
|
Некрозы перипортальные |
0,4 ±0,6 |
2,2±1,5 |
2,1±1,6 |
0,001# |
0,001# |
|
Некрозы лобулярные |
0,5±0,9 |
1,8±1,3 |
1,5±1,4 |
0,001# |
0,005# |
|
Жировая дистрофия |
1,3±1 |
2,1±1 |
2,1±1,1 |
0,02# |
0,02# |
|
Лимфоидные фолликулы |
0,1±0,3 |
0,9±1,1 |
1,3±1,3 |
0,01# |
0,001# |
|
Повреждение эпителия желчных канальцев |
0,2±0,5 |
0,9±0,9 |
1±1 |
0,01# |
0,003# |
|
Портальный фиброз, стадия |
1,5±0,5 |
2±0,7 |
2,1±0,6 |
0,03# |
0,001# |
|
Активность, степень |
1,1±0,3 |
1,8±0,4 |
1,7±0,7 |
0,001# |
0,001# |
|
Перицеллюлярный фиброз |
0,3±0,6 |
0,6±0,7 |
0,8±0,8 |
– |
0,05# |
|
Липофусциноз |
1,9±0,7 |
0,8±1 |
1±1,1 |
0,001# |
0,01# |
Примечания: * – по и (1996, с доп.);
** – критерий Манна–Уитни; # – статистически значимые различия (p < 0,05)
Нередко выраженность выявленных морфологических изменений не соответствовала благополучной биохимической и клинической картине, но позволяла установить активность воспаления и стадию фиброза печени, уточнить диагноз ХГ у пациентов с ТЛ.
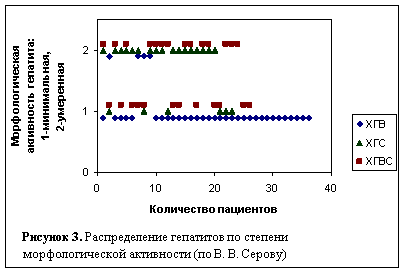
На момент выполнения пункционной биопсии печени у больных со всеми типами гепатитов преобладала минимальная – у 49-ти человек (58,3 %) и умеренная – у 35-ти (41,7 %) степень морфологической активности воспаления (по , , 1996). Вместе с тем, распределение степеней активности среди гепатитов было неравным (рисунок 3), при ХГВ активность статистически значимо ниже, чем при ХГС и ХГВС (р = 0,0001, c2).
Оказалось, что увеличение степени морфологической активности гепатита (ХГС + ХГВС суммарно) приводит к уменьшению среднего срока прекращения бактериовыделения: при активности 2–3 балла по – 3,4 месяца (95 % ДИ 2,5–4,3), а при активности 1 балл – 7,4 месяца (95 % ДИ 4–10,8, р = 0,014, анализ Каплана-Майера).
При ХГС + ХГВС и наличии выраженного фиброза (3–4 балла по Ishak) бактериовыделение прекратилось у всех 14-ти больных, а при слабом (1–2 балла) фиброзе – только у 18-ти из 25-ти (р = 0,08, c2).
Установлена связь между маркерами цитолиза печени и эффективностью лечения туберкулеза: прекратилось бактериовыделение при повышенном уровне АЛТ у 23-х из 24-х больных (ТЛ + ХГ), а при нормальном – у 9-ти из 15-ти (р = 0,016, χ²); полости закрылись (терапевтически) при повышенном уровне АЛТ у 23-х из 24-х больных (ТЛ + ХГ), а при нормальном – у 11-ти из 20-ти (р = 0,0045, χ²). Для АСТ найдена подобная же тенденция. Таким образом, при исходно более высоких показателях биохимической активности гепатитов ответ на лечение туберкулёзного процесса был выше.
Отсутствие или слабая выраженность морфологических и биохимических проявлений ХГ, т. е. гипорегенераторный тип ответа макроорганизма на вирусную инфекцию, свидетельствует о несостоятельности механизмов адаптации и иммунитета, что не позволяет пациенту достичь полноценного клинического излечения туберкулёза лёгких.
При слабо выраженном нейтрофилезе синусоидов только у 2-х больных из 44-х не было закрытия полостей, а при значительном – у 10-ти из 34-х (р = 0,007, c2). Нейтрофилез синусоидов отражает как общий уровень нейтрофилов крови, так и выраженность реактивного компонента гепатита, и в значительной степени может быть связан с алкогольной болезнью печени. Данные свидетельствуют, что при более выраженном реактивном компоненте гепатита нарушается регенерация легких: полости распада закрываются чаще при наличии минимального уровня синусоидного нейтрофилеза в сравнении со значительным (ОШ 8,8; ДИ 95 % 1,8–43,5).

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 |




