ЛАБОРАТОРНАЯ РАБОТА ПО ТЕПЛОФИЗИКЕ № 5
ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
Ознакомьтесь с теорией в конспекте и учебнике (Савельев, т. 1, § 147, 148). Запустите программу. Выберите «Термодинамика и молекулярная физика», «Испарение и конденсация».
ЦЕЛЬ РАБОТЫ:
Знакомство с компьютерными моделями фазового перехода. Исследования зависимости точки фазового перехода в изотермическом процессе.КРАТКАЯ ТЕОРИЯ:
Любое вещество может находится в различных состояниях (фазах) - твердом, жидком и газообразном. Переход из одного состояния в другое называют фазовым переходом. Испарение и конденсация являются примерами фазовых переходов. Все реальные газы способны при определенных условиях превращаться в жидкость. Поэтому изотермы реальных газов сильно отличаются от изотерм идеальных газов.
В закрытом сосуде жидкость и её пар могут находится в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным. Давление насыщенного пара зависит только от его температуры и не зависит от его объема. Поэтому изотермы реального газа на плоскости P, V содержат горизонтальные участки, соответствующие двухфазной системе.
Кипением называют процесс, при котором по всему объему жидкости образуются быстро растущие пузырьки пара, которые всплывают на поверхность. Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках равно давлению в жидкости. При нормальном атмосферном давлении Р = 1.01•105 Па вода кипит при температуре 373 К (100°С). При подъеме в горы атмосферное давление уменьшается, поэтому понижается температура кипения воды (приблизительно на 1°С на каждые 300 метров высоты). На высоте 7000 м давление составляет примерно Р = 0.4•105 Па, и температура кипения воды понижается до 70°С.
В герметически закрытом сосуде жидкость кипеть не может. При каждом значении температуры в сосуде устанавливается равновесие между жидкостью и ее насыщенным паром. По кривой равновесия можно определить температуры кипения жидкости при различных давлениях.
Фазовые переходы реального газа в PV-координатах выглядят следующим образом:
На рисунке Тк – критическая температура, выше которой вещество не разделяется на пар и жидкость, т. н. суперкритическая жидкость. Соответственно, точка К называется критической и является точкой перегиба.
Колоколообразная кривая МАКЕN ограничивает область кипения жидкости, т. е. кривая МАК – нижняя точка кипения жидкости, KEN – верхняя.
Состояние справа от кривой KEN – газообразное, слеот от кривой MAK – жидкость. Между ними жидкость и газ существуют в равновесии.
Кривая ABCDE – расчет изменение давления от объёма для иделаьного газа. В реальности, кривые ABCDE не встречаются, потому что если мы при постоянном давлении и температуре будем уменьшать объём, то будут образовываться капельки жидкости, т. е. одновременно будут существовать 2 фазы вещества. При достижении точки А, при уменьшении объёма будет резко увеличиваться давление, и всё вещество будет однородным, только это будет уже не газ, а жидкость. Если жидкость очень чиста, то можно продвинуться на некоторое расстояние в вдоль кривой АВ. В таких условиях жидкость называется перегретой. Тоже и к газу: если в нем нет неоднородностей, то можно продвинуться вдоль кривой ED, и газ называется перенасыщенным. Состояния на линиях AB и ED являются метастабильными (слабоустойчивыми).
МЕТОДИКА И ПОРЯДОК ИЗМЕРЕНИЙ
Внимательно рассмотрите картинку на рисунке. Ознакомьтесь с графиками в правой части изображения.
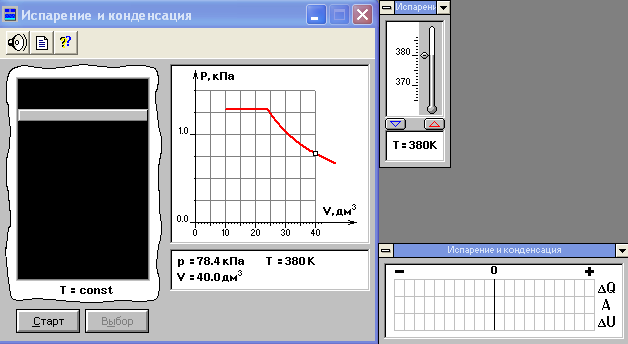
Зарисуйте необходимое в свой конспект лабораторной работы.
Получите у преподавателя допуск для выполнения измерений.
ИЗМЕРЕНИЯ:
ТАБЛИЦА 1. Значение температуры (не перерисовывать)
Бригада | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Т | 365 | 367 | 369 | 371 | 373 | 375 | 377 | 379 |
Т | 381 | 383 | 385 | 366 | 382 | 374 | 368 | 380 |
Запустите программу. Нажмите мышью кнопку «Старт» на экране и наблюдайте перемещение белой точки по красной кривой. Попробуйте останавливать процесс нажатием кнопки «СТОП». Последующий запуск процесса осуществляется нажатием кнопки «Старт». Нажмите мышью кнопку «Старт» и «ВЫБОР». С помощью мыши установите необходимые значения температуры. Снова нажмите «СТАРТ». При значения объёма, равных 40, 35, 30, 25, 20 запишите показания давления, объёма в таблицу. Определите значения объёма и давления, при которых в сосуде начинается кипение жидкости. Повторите пункты 2 – 4 для другой температуры. Сделайте вывод.
ТАБЛИЦЫ Результаты измерений
V, дм3 |
p, кПа |
А, кДж |
Q, кДж |
ОБРАБОТКА РЕЗУЛЬТАТОВ И ОФОРМЛЕНИЕ ОТЧЕТА:
Начертите на одном графике в PV-координатах наблюдаемые вами процессы. Рассчитать в каждой точке изменение работы и теплоты. Запишите ответы и проанализируйте ответы и графики.Вопросы и задания для самоконтроля
Что такое фаза? Что такое фазовый переход? Типы фазовых переходов. Примеры. Кипение. Испарение. Конденсация. Насыщенный, ненасыщенный пар? Фазовая диаграмма идеального газа? Фазовая диаграмма реального газа газа? Проанализируйте фазовые диаграммы реального и идеального газа.






