Кроме того, в условиях длительного тканевого повреждения, стимулируются процессы репарации тканей за счет активного деления стволовых клеток, что также повышает вероятность приобретения ими мутаций. К моменту наступления менопаузы на фоне длительных постовуляторных репаративных процессов эпителиальной выстилки яичника могут образовываться мутантные раковые стволовые клетки, инициирующие процессы канцерогенеза. Немаловажным фактором, способствующим трансформации и малигнизации поверхностного эпителия яичников, является воздействие эстрогенных метаболитов в постменопаузальном периоде, на различных звеньях возникновения опухоли, вследствие доказанных нашими исследованиями, имеющихся гормонально - обменных нарушений, а так же наличие ВПЧ - инфекции, в качестве ко-фактора, стимулирующего процессы канцерогенеза. И наконец, последнее, понимание совокупности гормональных и микробиологических изменений позволит нам целенаправленно и эффективно восстановить нарушенный баланс гормонов, предотвратить неблагоприятное воздействие эстрогенных метаболитов и инфекционных агентов и выделить группы риска для более активного наблюдения. Что, в конечном итоге, позволит добиться более значительного прогресса в профилактике и лечении данной патологии. Таким образом, этапы канцерогенеза на модели яичников могут формироваться в следующей последовательности (рис. 12).
 |
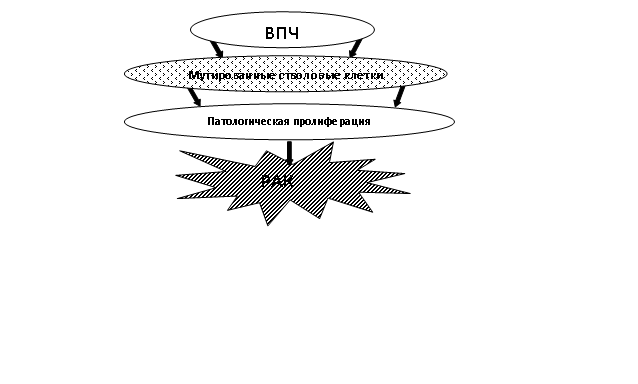
Рис. 12. Этапы канцерогенеза на модели яичников
Рак молочной железы
На сегодняшний день достигнут существенный прогресс в вопросах патогенеза, диагностики и лечения рака молочной железы. Если для “гормонозависимого” варианта рака молочной железы вполне очевидна схема взаимодействия гормон - рецептор, то при “гормононезависимом” варианте или в постменопаузе эти два звена претерпевают значительные изменения: смещается спектр секретируемых гормонов, падает уровень рецепторов. Общеизвестно, что с возрастом падает реактивность тканей к действию гормонов, вследствие снижения числа специфических рецепторов в клетках, реагирующих на действие того или иного гормона (Hess G., 1982). Проблема заключается в том, насколько синергичны процессы формирования гормональной и рецепторной недостаточности в постменопаузе, с одной стороны, а с другой, - каков принцип “реанимации” стероидных рецепторов в тканях-мишенях при развитии гиперпластических процессов и злокачественной опухоли. С нашей точки зрения, наиболее значимые направления в патогенезе рака молочной железы, которые требуют сегодня пристального внимания, это эндокринологическое и инфекционное.
Проведено изучение уровня эстроген - рецепторов в ткани молочной железы с помощью иммуногистохимического исследования у 68 пациенток с наличием рака молочной железы (РМЖ), 50 пациенток с узловыми формами мастопатии (УФМ) и 64 пациентки постменопаузального периода, имеющих картину инволютивных (соответствующих возрасту) изменений. В группе контроля в 62,3% случаев среди женщин постменопаузального возраста рецепторы эстрогенов не определялись. В группе пациенток с УФМ получены эстроген – негативные результаты у 52,0% пациенток.
У 32 больных имелся “гормонозависимый” и у 36 – “гормононезависимый” рак молочной железы, по данным иммуногистохимического исследования.
Таб. 10 Уровень эстроген - рецепторов (%) в ткани молочной железы при раке молочной железы, узловых формах мастопатии и в контрольной группе (иммуногистохимический метод)
Группы пациенток | Число пациенток | Уровень рецепторов | |||
ЭР- | ЭР+ | ЭР++ | ЭР+++ | ||
РМЖ | 68 | 47,0% | 14,0% | 21,5% | 19,0% |
УФМ | 50 | 52,0% | 18,0% | 12,0% | 18,0% |
Контрольная группа | 64 | 62,3% | 18,7% | 1,9% | 17.1% |
р<0,1
Следует отметить, что примерно одинаковая доля образцов ткани молочной железы при раке, узловых формах мастопатии и в группе контроля сохраняла высокий, клинически значимый уровень рецепторов. По нашему мнению, в этой группе создаются наибольшие предпосылки для возникновения и развития рака молочной железы, что требует более тщательного динамического мониторинга за состоянием молочных желез у этих пациенток.
В то же время мы посчитали необходимым дополнить иммуногистохимическое исследование методикой полимеразной цепной реакцией в «режиме реального времени» с предварительной реакцией обратной транскрипции у 14 пациенток в группе больных “гормононезависимого” рака. Стоит отметить то, что изучались образцы, которые по данным иммуногистохимического метода в отношении уровня ЭР были отрицательны. Во всех образцах опухоли отмечена экспрессия мРНК эстрогеновых рецепторов, однако уровень экспрессии был весьма вариабелен. Наше объяснение этого факта сводится к тому, что иммуногистохимический метод отражает количественно уровень белка рецептора, в то время, как метод ОТ-ПЦР дает информацию о генетическом фрагменте, ответственном за экспрессию этого белка. Таким образом, при РМЖ всегда запущена генетическая программа синтеза белка эстрогенового рецептора. Причем, эстрогеновый рецептор способен взаимодействовать с любым лигандом, у которого “молекулярный диапазон” близок к эстрогенам. Очевидно, что молекулярная формула метаболита 16α-ОН в этом смысле наиболее близка.
Для доказательства наших предположений в настоящей работе изучен ИМТ у 120 больных РМЖ, 100 пациенток с УФМ и у 100 пациенток группы контроля.
Полученные нами данные подтверждают наличие метаболических нарушений у больных РМЖ, включенных в исследование. В группе пациенток с наличием РМЖ лишь у 23 пациенток (19,1%) имелся нормальный ИМТ, у 48 больных (40%) он был повышен, а у,9%), свидетельствовал о наличии ожирения различной степени выраженности. В группе пациенток с УФМ, так же отмечена тенденция к повышению ИМТ – так у 33 пациенток отмечено превышение нормальных показателей и у 30 пациенток данной группы имелось ожирение. Нормальные показатели ИМТ были лишь у 37 женщин, что значительно отличается от группы контроля. При анализе данных ИМТ в группе больных РМЖ, следует отметить, что в 106 наблюдениях – 94,8% пациенток РМЖ – отмечено превышение показателей ИМТ, что достоверно отличается от показателей группы контроля (р<0,05).
С целью изучения уровня метаболитов и коэффициента их соотношения, мы обследовали 86 больных раком молочной железы, 50 пациенток с узловыми формами мастопатии и 100 пациенток контрольной группы, определяя уровень метаболитов в моче (2-ОНЕ1, 16α-ОНЕ1) и их соотношение.
Средний уровень метаболита 16α-ОНЕ1 в группе пациенток РМЖ оказался более, чем в 4 раза выше, чем в группе контроля – на 76,0%, а в сравнении с группой пациенток с УФМ – на 35,6%. В то же время уровень 2-ОНЕ1 в группе больных РМЖ был в 19,4% ниже, чем в группе контроля и на 68,9% ниже, чем при УФМ. Соотношение метаболитов в группах также демонстрировало существенные, статистически достоверные (р<0,05), различия. Если в контрольной группе и у пациенток с УФМ величина 2-ОНЕ1/16α-ОНЕ1 была примерно одинакова и укладывалась в нормальные значения для пациенток постменопаузального периода, то при РМЖ этот показатель был снижен более чем в 5 раз. Полученные данные статистически достоверны (р для 16α - ОНЕ1 = 0,013 и р для 2-ОНЕ1= 0,001) и свидетельствуют о том, что в группе больных РМЖ метаболизм эстрона через систему цитохромов Р450 чаще ориентирован на продукцию «агрессивного» метаболита 16α-ОНЕ1, в отличие от контрольной группы и группы женщин с УФМ.
Таб. 11 Средний уровень соотношения метаболитов эстрогенов 2-ОНЕ1/16α-ОНЕ1 в зависимости от индекса массы тела при раке молочной железы и узловых формах мастопатии
ИМТ | Рак молочной железы (N=86) | Узловые формы мастопатии (N=50) | Контрольная группа (N=100) |
нормальный ИМТ 18,50-24,99 | 0,80±0,28* | 2,24±0,48 | 2,14±0,39 |
повышенный ИМТ 25,00-29,99 | 0,52±0,12** | 2,17±0,42 | 2,03±0,29 |
ожирение ИМТ >30, 00 | 0,39±0,09** | 1,99±0,26 | 2,00±0,31 |
*р<0,05, **р<0,01 в сравнении с группой контроля
Обращает на себя внимание то, что при РМЖ даже в группе больных с нормальным ИМТ, в отсутствии клинически выраженных проявлений метаболического синдрома, отмечен низкий (0,8) коэффициент соотношения метаболитов (Табл. 11). Отчетливо прослеживается и следующая тенденция: по мере нарастания ИМТ снижается соотношение метаболитов, о чем свидетельствует более высокий уровень экспрессии 16α-ОНЕ1. При значении соотношения уровня метаболитов 2ОНЕ1/16α-ОНЕ1 менее 1, пациенток в контрольной группе и при доброкачественных процессах не выявилось. Напротив, при РМЖ данное соотношение было получено у большинства пациенток. Коэффициент более 2 имел место значительной доли пациенток контрольной группы – 82, в то время как при РМЖ он отмечен лишь в 4 случаях. Все данные статистически достоверны – Р = 0,0006. Таким образом, низкое соотношение 2-ОНЕ1 к 16α-ОНЕ1 можно считать фактором риска развития РМЖ.
Низкий коэффициент соотношения метаболитов при высоком ИМТ может служить признаком высокого риска развития в будущем опухолей репродуктивных органов, что наиболее отчетливо показано результатами исследований в отношении РМЖ и РЭ. Понимание и учет этих фактов формирует совершенно новые принципы профилактики, мониторинга и ранней диагностики рака репродуктивных органов. Полученные результаты могут дополнить и расширить понимание механизмов возникновения опухоли при так называемом «гормонозависимом» РМЖ.
Следующий этап исследований был связан с изучением инфекционной составляющей при РМЖ. Опираясь на данные литературы о возможной связи ВПЧ и герпес - вирусов с возникновением РМЖ и отсутствие данных о возможном участии бактериальных агентов в промоции канцерогенеза при РМЖ, нами был изучен спектр вирусных инфекций в ткани молочной железы у 68 больных РМЖ I-IV стадий, 48 пациенток c УФМ и у 50 пациенток контрольной группы.
ВПЧ был выявлен в 7,4% образцов опухолевой ткани молочной железы – у трех пациенток со второй стадией РМЖ и у двух пациенток с первой стадией РМЖ. В группе пациенток с УФМ ВПЧ был выявлен так же в 14% образцов опухоли молочной железы. Доля ВПЧ-положительных образцов в группе контроля была так же не велика и составила 12%. Полученные данные позволяют Заключить, что наличие папилломавирусной инфекции не играет существенной роли в этиопатогенезе РМЖ, вследствие отсутствия достоверных различий (р>0,1) в исследуемых группах.
Эпштейн –Барр вирус (ВЭБ) был выявлен при ПЦР - диагностике в 1 образце ткани при раке молочной железы (1,5%). Ни у одной из пациенток с узловыми формами мастопатии и в контрольной группе не было выявлено ВЭБ - инфекции. Цитомегаловирус и вирус простого герпеса II не определялись в ткани опухоли молочной железы у пациенток как при злокачественных и доброкачественных новообразованиях молочных желез так и в контрольной группе.
Данные литературы, касающиеся оценки инфекционной составляющей при неоплазиях молочной железы, более всего обосновывают участие в опухолевой трансформации ткани молочной железы MMTV - ретровируса, родственного вирусу опухолей молочных желез мышей. В нашей работе была изучена частота выявления данного вируса в опухолевой ткани молочной железы при раке и УФМ, в сравнении с группой контроля. При детекции вируса MMTV в 20-ти образцах ткани молочной железы при раке (29,4%) и в 10 образцах (20,8%) при УФМ были получены положительные результаты. При этом в нормальной ткани данный вирус выявлен не был ни в одном образце. Полученные данные не выявили достоверную разницу в детекции ММТV при РМЖ, УФМ в сравнении с группой контроля (p>0,05), что позволяет высказаться о сомнительной роли MMTV в патогенезе как доброкачественных, так и злокачественных опухолей молочной железы, вследствие чего, его определение не может использоваться для ранней диагностики рака молочной железы.
Таким образом, подводя итог исследованиям гормонального и инфекционного факторов в патогенезе РМЖ, следует отметить наиболее важные моменты. Первое, это то, что при РМЖ у преимущественного числа больных имеются проявления метаболического синдрома; второй факт - при РМЖ имеется высокий уровень продукции агрессивного метаболита 16α-ОНЕ1 и низкая экспрессия 2-ОНЕ1; третьим является тот факт, что во всех образцах РМЖ определяется экспрессия мРНК эстрогеновых рецепторов и, наконец, четвертое – в патогенезе РМЖ инфекционный фактор не несет выраженной значимости.
Учитывая клиническое разнообразие рака молочной железы, мы считаем вправе представить этапность канцерогенеза при данной локализации рака в виде следующей схемы (Рис. 13), принимая во внимание, что она строго детерминирована для пациенток постменопаузального возраста и не в состоянии дать исчерпывающую траковку всего спектра факторов злокачественной трансформации для ткани молочной железы.


 |  |
 | |
![]()
![]()
Рис. 13. Компоненты, формирующие канцерогенез молочной железы в постменопаузальном периоде
Принципы патогенетической профилактики и ранней диагностики опухолей женской репродуктивной системы
На основании полученных нами результатов нами выделен ряд важных факторов, определяющих некоторую общность в патогенезе опухолей женской репродуктивной системы, что диктует необходимость комплексного подхода к ранней диагностике и профилактике рака репродуктивных органов.
В настоящее время, основываясь на большом количестве исследований, соотношение метаболитов эстрогенов 2-ОНЕ1/16α-ОНЕ1считается универсальным диагностическим биомаркером при определении риска развития рака эстроген – зависимых органов (, , 2004, 2008, 2009гг).
В ходе проведенных исследований установлено, что в группах больных раком органов женской репродуктивной системы коэффициент соотношения метаболитов 2-ОНЕ1/16α-ОНЕ1 был в два раза, и даже более, ниже показателей группы контроля. В постменопаузе, на фоне снижения синтеза эстрогенов яичниками, происходит усиление синтеза эстрогенов в жировой ткани путем ароматизации. Анализируя показатели коэффициента соотношения метаболитов при раке органов женской репродуктивной системы различной локализации в зависимости от ИМТ, мы видим, что коэффициент соотношения метаболитов находится в обратной зависимости от ИМТ – при увеличении массы тела, а, следовательно, количества жировой ткани, отмечается снижение данного соотношения. Таким образом, у большинства больных раком ОЖРС, особенно при наличии метаболического синдрома, в отличие от здоровых пациенток, метаболизм эстрогенов, который осуществляется через систему цитохромов Р-450, ориентирован на синтез «канцерогенных» метаболитов, что, в свою очередь, создает предпосылки для образования устойчивого комплекса гормон – рецептор, индуцирующего длительный пролиферативный сигнал.
Итак, одним из ключевых моментов гормонального гомеостаза в постменопаузе становится взаимодействие системы эстрогенный метаболит и эстроген-рецептор, формируя гиперпластическую или инволютивную направленность тканей-мишеней.
Представляется очевидным, что в постменопаузе формируются четыре варианта состояния гормональной системы. При первом, протекающем на фоне высокой экспрессии 16а-гидроксиэстрона, при сохраненном рецепторном статусе, формируется патогенетическая база гиперпластических процессов. Остальные три варианта ассоциируются с инволютивными, атрофическими процессами, низким индексом массы тела, остеопенией и остеопорозом.
Определяя вероятную модель канцерогенеза в постменопаузе, мы столкнулись с тем, что вся физиология постменопаузы формирует ряд существенных нарушений, способствующих увеличению фактора хронической патологической пролиферации (Рис. 14).
При этом можно выделить два основных вектора:
- вектор, способствующий развитию пролиферативных процессов через систему гормональной регуляции (сохраненный рецепторный статус, высокий уровень экспрессии агрессивных метаболитов);
- вектор, индуцирующий пролиферацию через этап инволютивно - атрофических процессов, с нарушением трофики тканей, её травматичностью, с явлениями хронического воспаления, выраженными нарушениям микробиоценоза, индуцирующие мутированные стволовые клетки органов-мишеней.
Учет этих особенностей постменопаузы формирует дифференцированные подходы к реализации профилактических мероприятий и в этом смысле профилактика приобретает патогенетическую направленность.
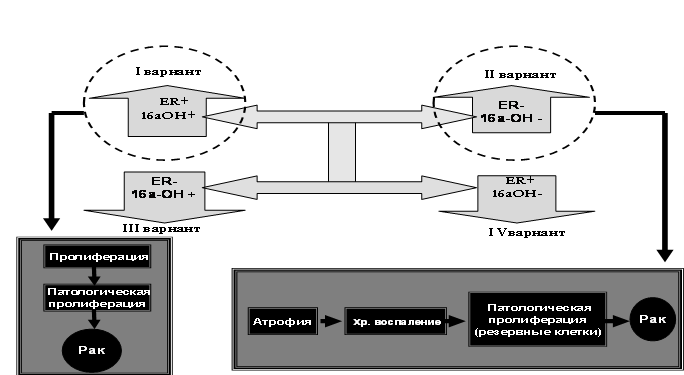
Рис. 14 Варианты формирования гормонального гомеостаза в постменопаузальном периоде
Полученные результаты свидетельствуют о необходимости блокировки указанного ключевого пути патологической пролиферации в гормон – зависимых органах. Одним их способов является применение антиметаболических препаратов, обладающих антиэстрогенным эффектом, вследствие стимуляции выработки 2-ОНЕ1.
В рамках нашей работы было важно выяснить, можно ли каким-то образом повысить в организме уровень 2-ОНЕ1 и тем самым блокировать один из ключевых путей патологической пролиферации в гормонзависимых тканях? В многочисленных экспериментальных и клинических исследованиях было показано, что активно действующий компонент индинола – индол-3-карбинол, а также его физиологический метаболит - 3,3’-дииндолилметан (DIM) обладают выраженным антиэстрогенным эффектом, стимулируя образование в гормонзависимых тканях антипролиферативного 2-гидроксиэстрона и улучшая таким образом соотношение 2-ОНЕ1/16a-ОНЕ1 в пользу первого (Bradlow HL, 1994; Michnovicz JJ, 1998; Chatterji U., 2004; Brandi G., 2012). Имеются данные, указывающие и на прямое ингибирование со стороны I3C и DIM сигнальных каскадов, опосредуемых эстрадиол - активируемыми эстрогеновыми рецепторами (ERα) (Meng Q., 2000; Ho JN, 2012).
Опираясь на эти данные, была предпринята попытка изменить уровень экспрессии эстрогенных метаболитов в сторону усиленной продукции антипролиферативного метаболита 2-ОНЕ1 (2-гидроксиэстрона) у больных РМЖ, преследуя, как бы две цели: предупреждение новых очагов рака в контралатеральной молочной железе и предупреждение рецидива заболевания и метастазирования.
С этой целью 68 больных РМЖ в течение 6 месяцев получали индинол в дозировке 2 капсулы 2 раза в день (400мг в сутки) и в интервале 3 и 6 мес. у них определялся уровень 2-гидроксиэстрона и 16α-гидроксиэстрона в моче.
Результаты исследования свидетельствуют (Рис. 15), что заметное улучшение в метаболизме эстрогенов проявляется уже после 3-х месяцев приема: существенно снизился уровень 16а-ОНЕ1 (с 18,63 нг/мл до 12,00нг/мл) и возрос уровень экспрессии 2-ОНЕ1 (с 7,8 нг/мл до 11,31нг/мл), а коэффициент соотношения метаболитов увеличился более чем в 2 раза: с 0,42 до начала лечения до 0,94 через 3 мес. Последующие 3 месяца приема привели к полному восстановлению нормального соотношения метаболитов. Коэффициент 2-ОНЕ1/16а-ОНЕ1 достиг 2,31 (р<0,05).
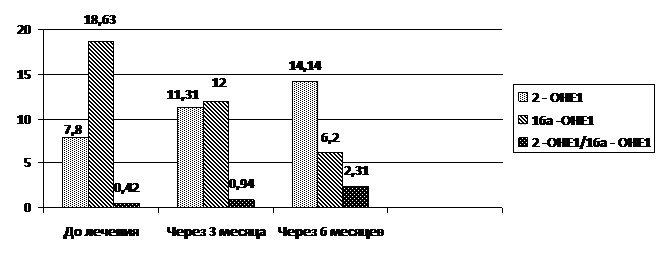
Рис. 15 Средний уровень и соотношение метаболитов у больных раком молочной железы при приеме индинола в динамике
При этом экспрессия 16а-ОН снизилась в 3 раза по сравнению с данными до начала лечения. Иными словами, для достижения полного «метаболического» эффекта необходим длительный, не менее полугода, прием препарата. Этот факт вполне вписывается в механизм фармокинетики таргетных препаратов, эффект действия которых сопряжен с формированием нормальных физиологических процессов и формирует благоприятную перспективу в патофизиологии рака молочной железы и делают ещё один шаг в реализации патогенетической терапии и профилактике этого заболевания.
Учитывая простоту определения уровня метаболитов в моче, а так же невысокую стоимость, данное исследование может использоваться при формирования групп риска по возникновению пролиферативных заболеваний ОЖРС, а так же для их мониторинга.
Проведенными исследованиями продемонстрирована ключевая роль вирусной инфекции в патогенезе большинства опухолей женской репродуктивной системы - РВ, РШМ, РЯ. При таких локализациях, как РЭ и РМЖ, значение вирусной составляющей в канцерогенезе не столь велико. Особенно важным представляется исследование ВПЧ, а главное, онкопротеина Е 7, при цервикальных интраэпителиальных неоплазиях, вследствие неуклонного роста больных дисплазиями шейки матки в различные периоды жизни женщин.
Это, прежде всего, связано с увеличением доли инфекционных заболеваний, передающихся половым путем и возрастанием частоты ВПЧ инфекции. Прогресс молекулярной биологии сформировал новое понимание начальных этапов канцерогенеза в развитии неоплазий шейки матки и обозначил новые перспективы в ранней диагностике этого заболевания.


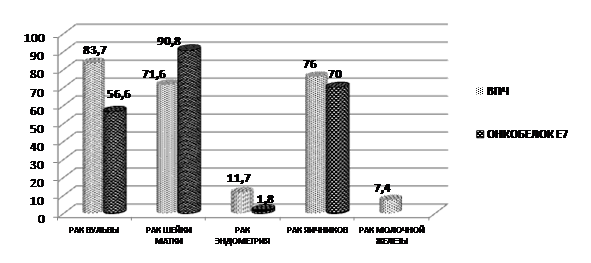
Рис. 14. Соотношение инфицированности ВПЧ (%) и детекции онкобелка Е7 (%) у больных со злокачественными новообразованиями органов женской репродуктивной системы
Полученные данные свидетельствуют о том, что в группе больных с дисплазиями шейки матки имеются значительные качественные различия в молекулярно-биологических критериях. Причем, у части больных эти различия не пропорциональны степени тяжести морфологических проявлений. Иными словами, ориентир на молекулярно-биологические критерии при цервикальных неоплазиях позволяет намного конкретнее судить о злокачественной направленности дисплазии, что неминуемо должно учитываться при формировании принципов терапии и последующего мониторинга. По нашему мнению, иммуноферментный анализ на онкобелок Е 7 открывает совершенно новые перспективы в проблеме ранней диагностики РШМ и РВ. РВ и СЛВ не являются столь частыми заболеваниями, как CIN и РШМ. Однако, тот факт, что показатели запущенности при РВ наиболее высоки, а наличие выраженной экстрагенитальной патологии пациенток РВ и СЛВ, часто не позволяет провести радикальное лечение, делает поиск адекватных маркеров раннего канцерогенеза при данных нозологиях наиболее актуальным. Учитывая механизм экспрессии онкобелка Е 7, можно уверенно обозначить его, как истинный и самый ранний маркер канцерогенеза при наличии ВПЧ инфекции. Высокая чувствительность и низкая стоимость дают возможность вполне реально рассматривать его в качестве теста ранней диагностики процессов малигнизации. Эта модель исследований совершенно по - новому формирует принципы отбора пациенток для последующей уточняющей диагностики и мониторинга. Ориентир на ранние сигнальные маркеры канцерогенеза усилит эффективность ранней диагностики РШМ и РВ и сделает более целенаправленной вторичную профилактику.
Выводы
1. В постменопаузе следует дифференцировать 4 варианта гормонального гомеостаза, который формируется с учетом уровня эстроген - рецепторов в органах - мишенях и экспрессии эстрогенного метаболита 16α-гидроксиэстрона, определяющего патогенетическую базу, на основе которой развивается спорадический рак репродуктивных органов:
· I (ER+ 16a-OHЕ1+) гиперэстрогенный или гиперпластический вариант;
· II (ER- 16a-OHЕ1-) гипоэстрогенный атрофический вариант;
· III (ER+ 16a-OHЕ1-) атрофический вариант;
· IV (ER- 16a-OHЕ1+) атрофический вариант.
2. В этиопатогенетической модели рака вульвы наиболее значимы два аспекта:
· эндокринологический, выражающийся в развитии постменопаузального метаболического синдрома (коэффициент 2-ОНЕ1/16α-ОНЕ1= 0,98) и принципах формирования эстроген – рецепторов в ткани вульвы (пул рецепторов сконцентрирован в базальном слое эпидермиса вульвы, что отмечается лишь в 3,2% наблюдений);
· инфекционный, связанный с персистенцией папилломавирусной инфекции (76,2% наблюдений) в эстроген - чувствительном базальном слое эпителия на фоне глубоких изменений вульво - вагинального микробиоценоза.
3. Анатомо-функциональные нарушения при склеротическом лишае, в сочетании с метаболическим синдромом, выраженными нарушениями микробиоценоза вульвы (вирус папилломы человека) и высоким уровнем эстроген - рецепторов в базальном слое эпителия формируют патогенетическую основу предрака вульвы.
4. Сочетание папилломавирусной инфекции и высокого уровня экспрессии 16α-гидроксиэстрона формирует патогенетическую базу рака шейки матки. Любой вариант эндоцервикоза и, в особенности, цервикальной интраэпителиальной неоплазии на фоне экспрессии онкобелка Е 7 является облигатным предраком шейки матки.
5. В этиопатогенетической модели рака эндометрия наиболее значимы следующие аспекты:
· низкая частота (11,7%) вирус - положительных образцов при раке эндометрия в сравнении с контрольной группой (9,6%) свидетельствует об отсутствии роли папилломавирусной инфекции в этиологии рака эндометрия;
· высокая экспрессия 16α-гидроксиэстрона (коэффициент 2-ОНЕ1/16α-ОНЕ1=0,95) при наличии эстрогеновых рецепторов формирует промоторный вариант гормонального канцерогенеза. При втором, гормонально независимом, варианте заболевания, злокачественный процесс формируется на фоне атрофии эндометрия.
6. Высокий уровень 16α-гидроксиэстрона на фоне сохраненного рецепторного аппарата эндометрия в постменопаузе формирует патогенетическую базу облигатного предрака - I патогенетический вариант заболевания. Атрофию эндометрия на фоне хронического воспаления следует рассматривать как облигатный предрак, соответствующий II патогенетическому варианту заболевания.
7. В этиопатогенетической модели рака яичников наиболее значимы следующие аспекты:
· овуляторный фактор. В группе больных раком яичников частота овуляторных циклов в 2,8 раз выше, чем в контрольной группе;
· инфекционный фактор. Злокачественные эпителиальные опухоли яичников в 76,1% наблюдений сочетаются с папилломавирусной инфекцией. При этом с наибольшей частотой отмечено присутствие ВПЧ,6%),,6%),,6%),,4%) и,3%) генотипов и реже 73, 31, 51, 45, 33, 66, 68 и 16 генотипов. При этом, онкобелок Е7 18 генотипа в ВПЧ-18 позитивных образцах опухолевой ткани яичников зарегистрирован в 70% наблюдений.
8. У 76% больных раком яичников имеется высокая экспрессия 16α-гидроэксиэстрона (коэффициент 2-ОНЕ1/16α-ОНЕ1 = 1,11).
9. В этиопатогенетической модели рака молочной железы наиболее значимы следующие аспекты:
· низкая частота (7,4%) ВПЧ - положительных образцов при раке молочной железы по сравнению с контрольной группой (12%) и отсутствие герпес - вирусов в обеих группах, свидетельствует о сомнительной роли ДНК-содержащих вирусов в этиопатогенезе рака молочной железы. Невысокая частота выявления вируса MMTV (29,4%) в ткани опухоли молочных желез больных раком молочной железы, свидетельствует о сомнительной роли данного вируса в этиопатогенезе рака молочной железы.
· у преимущественного числа больных раком молочной железы (72,5%) коэффициент соотношения метаболитов (2-ОНЕ1/16α-ОНЕ1) соответствует 0,52, в то время, как в контрольной группе это показатель 2,1, что свидетельствует о доминировании промоторного варианта гормонального канцерогенеза.
10. Высокий уровень 16α-гидроксиэстрона на фоне сохраненного рецепторного статуса в эпителии молочной железы в постменопаузе формирует патогенетическую базу облигатного предрака.
11. Ранняя диагностика рака репродуктивных органов может быть обеспечена жестким мониторингом лиц, имеющих патогенетически значимые факторы риска (высокий уровень метаболита 16α-ОНЕ1, экспрессия белка Е7, хронические воспалительные процессы в органах репродуктивной системы на фоне атрофии).
12. Основные направления патогенетической профилактики спорадического рака репродуктивных органов складываются из информации об экспрессии эстрогенных метаболитов (коэффициент соотношений 2-ОНЕ1/16α-ОНЕ1), уровнях эстроген - рецепторов (для вульвы, эндометрия и молочной железы) и инфекционного (вирус папилломы человека) компонентов (вульва, шейка матки и яичники). Важным фактором профилактики рака репродуктивных органов являются мероприятия по предупреждению постменопаузальной атрофии (заместительная гормональная терапия).
Практические рекомендации
1. Эффективное проведение профилактических осмотров с целью раннего выявления облигатного предрака и раннего рака репродуктивных органов среди женщин постменопаузального периода, может быть обеспечено учетом комплекса патогенетических критериев (длительность овуляторного периода, коэффициент соотношения метаболитов эстрогенов 2-ОНЕ1/16α-ОНЕ1, инфекционный фактор (вирус папилломы человека, онкобелок Е7).
2. При неблагоприятном коэффициенте соотношения метаболитов эстрогенов 2-ОНЕ1/16α-ОНЕ1, с преобладанием «агрессивного» компонента, свидетельствующем о возможной промоции неопластических процессов, следует проводить регулярный жесткий мониторинг органов-мишеней с использованием современных методов ранней диагностики. Наряду с этим, целесообразно усилить меры патогенетической профилактики.
3. Современная патогенетическая профилактика рака репродуктивных органов в постменопаузе должна подразумевать предупреждение инволютивно - атрофических процессов, а так же широкое и длительное использование таргетных (индинол, промисан) препаратов.
4. Исследование онкобелка Е 7 должно стать обязательным компонентом обследования среди пациенток с наличием интраэпителиальных неоплазий шейки матки. Положительные результаты детекции онкобелка Е 7, даже при отсутствии данных за наличие цервикальной интраэпителиальной неоплазии, являются признаком интеграции вирусной ДНК в геном клетки и свидетельствуют о необходимости применения более радикальных методов лечения и последующего жесткого мониторинга. Отсутствие экспрессии онкобелка Е 7 в цервикальных пробах больных с дисплазиями шейки матки, позволяет широко использовать консервативные и органосохраняющие варианты лечения.
5. Современная профилактика спорадического рака репродуктивных органов должна формироваться с раннего репродуктивного периода, и подразумевает максимальное снижение числа овуляторных циклов (неоднократные роды, длительная лактация, прием комбинированных оральных контрацептивов), профилактику папилломавирусной инфекции, контроль индекса массы тела. На этапе ранней постменопаузы целесообразно широкое использование заместительной гормональной терапии при явно атрофическом (II, III, IV) варианте постменопаузы.
Список научных работ, опубликованных по теме диссертации:
1. , , Ивашина (склеротический лишай) как предрак вульвы.// «Вопросы онкологии» 2004, №3, Т. 50, С. 320-326.
2. , , Бабаева вульвы – этиопатогенетическая концепция.// «Российский онкологический журнал» 2004, №5, С. 22-25
3. , , Басова принципы первичной и уточняющей диагностики рака эндометрия.// «Практическая онкология», 2004, №1, Т.5. С.16-18.
4. , , Ивашина лишай (крауроз) как предрак вульвы. // «Вестник российского научного центра рентгенорадиологии», 2004 (URL: http:// vestnik.rncrr.ru)
5. , , Степанова склеротического лишая вульвы.// «Вестник российского научного центра рентгенорадиологии», 2004 (URL: http://vestnik. *****)
6. , , Степанова эстроген – рецепторов в ткани вульвы при склеротическом лишае.// «Вестник российского научного центра рентгенорадиологии», 2004 (URL: http://vestnik. *****)
7. , , Антонова Н. В, , Степанова минеральной плотности кости и индекса массы тела при дистрофии вульвы. // «Журнал Российского общества акушеров-гинекологов» 2004, №1, С. 31-35
8. , , ВПЧ-ассоциированные новообразования женского генитального тракта: Роль гормонального фактора в канцерогенезе.// Материалы научно-практической конференции «Современные подходы к диагностике и лечению гинекологического рака», Псков, 2004, С.9-10
9. , , Мухтарулина папилломавирусной инфекции в канцерогенезе неопластических процессов женского генитального тракта на примере рака вульвы.// Материалы научно-практической конференции «Современные подходы к диагностике и лечению гинекологического рака», Псков, 2004, С.6-9
10. , , Бабаева вульвы - этиопатогенетическая концепция.// Материалы III Съезда онкологов и радиологов СНГ часть I, Минск, 2004, С.84-86
11. , , Саратян вульвы: этиопатогенетическая концепция.// Материалы IX Российского онкологического конгресса, Москва, 2005, С.81-82
12. , , Бабаева уровня минерализации кости и уровня эстроген – рецепторов в тканях – мишенях при определении патогенетического варианта постменопаузы.// Материалы II Российского конгресса по остеопорозу, Ярославль, 2005, С. 35-36
13. , , Овчинникова периферической денситометрии у больных раком эндометрия в постменопаузе.// Материалы II Российского конгресса по остеопорозу, Ярославль, 2005, С. 70
14. , , Альбицкий особенности воздействия тамоксифена на эндометрий у пациенток в постменопаузе.// «Вопросы онкологии», 2005, №2 Т. 51, С. 200-205
15. , , Басова сонографии и гистероскопии в уточнении состояния эндометрия у женщин постменопаузального периода на фоне приема антиэстрогенов.// «Журнал акушерства и женских болезней», 2005, Спецвыпуск, Т. LIV, С. 79-80
16. , , Хунова рецепторного аппарата вульвы при склеротическом лишае. // «Вестник Российского университета дружбы народов. Серия: Медицина», 2006, №1, С. 88-94
17. , , Бабаева вульвы: этиопатогенетическая концепция.// Москва: Молодая гвардия, 2006, - 192 с.
18. , , Онкобелок Е 7 как диагностический маркер цервикальных интраэпителиальных неоплазий и рака шейки матки// // Материалы 8-го Всероссийского научного форума «Мать и дитя» 3-6 октября, Москва, 2006, С. 323
19. , , Хунова -биологические аспекты злокачественных трансформаций цервикальных интраэпителиальных неоплазий.// Материалы юбилейной конференции «Современные технологии в диагностике и лечении гинекологических заболеваний», Москва, 2007, С. 440-442
20. Ashrafyan L. A., Antonova I. B., Babaeva N. A., Basova I. O., Budarina S. O. Oncoprotein E7 as a marker of malignant transformation cervical intraepithelial neoplasia.// 15-th international meeting of the European Society of Gynecоlogical Oncology, Berlin, Germany, 2007, P. 211
21. , , // Клинико-морфологическое обоснование микроинвазивного рака эндометрия.// «Сибирский онкологический журнал», 2007, №1, С. 8-15.
22. , , Ивашина вульвы, эндометрия, яичников в постменопаузе – роль инфекционного фактора.// «Опухоли женской репродуктивной системы», 2007, №4, С. 72-78
23. , , Мягкова патогенетического типа постменопаузы на возникновение рака женских половых органов.// «Вестник Российской ассоциации радиологов», 2011, №4, С. 270
24. , , Бабаева тамоксифена на ткань эндометрия у женщин постменопаузального возраста.// «Вестник Российской ассоциации радиологов», 2011, №4, С. 269
25. Ashrafyan L. A., Antonova I. B., Babaeva N. A. Metabolites of estrogens at endometrial cancer and breast cancer.// 17-th international meeting of the European Society of Gynecоlogical Oncology, Milan, 2011, Р. 113
26. , , Огрызкова соноэластометрии для дифференциальной диагностики доброкачественных и злокачественных опухолей яичников.// «Опухоли женской репродуктивной системы», 2012, № 2, С. 55-59
27. , , Люстик – биологические и ультразвуковые методы в оценке лекарственной терапии у больных раком шейки матки и раком яичников.// Опухоли женской репродуктивной системы», 2012, № 4, С. 120-125
28. , Б, , Алешикова метаболитов эстрогенов в патогенезе рака эндометрия.// Материалы Республиканской научно-практической конференции с международным участием «Роль новых радиологических технологий в диагностике и лечении заболеваний молочных желез и органов малого таза у женщин», Астана, 2012, С. 60-62
29. , , Мельникова -биологические факторы в качественной оценке раннего канцерогенеза шейки матки // Материалы Республиканской конференции с международным участием «Роль новых радиологических технологий в диагностике и лечении заболеваний молочных желез и органов малого таза у женщин», Астана, 2012, С. 57-60
30. Ashrafyan L. A., Antonova I. B., Babaeva N. A., Aleshikova O. I., Khunova L. Z. Diagnostic and predictive value of oncoprotein E7 in cervical intraepithelial neoplasia.// «EUROGIN 2012», Prague, Czech Republic, 2012, P. 177.
31. , , Мягкова А. А. Клинико-морфологическая концепция микроинвазивного рака эндометрия.// «Онкология», 2013, № 1, С. 78-83
32. , , Люстик папилломавирусной инфекции при раке женской репродуктивной системы в постменопаузальном периоде.// «Вестник российского научного центра рентгенорадиологии», 2013 (URL: http:// vestnik.rncrr.ru)
33. , , Люстик метаболитов эстрогенов в патогенезе рака молочной железы, эндометрия и яичников.// «Вестник российского научного центра рентгенорадиологии», 2013 (URL: http:// vestnik.rncrr.ru)
Список используемых сокращений
РОЖРС - рак органов женской репродуктивной системы
РВ – рак вульвы
РШМ – рак шейки матки
РЭ – рак эндометрия
РЯ – рак яичников
РМЖ – рак молочной железы
УФМ – узловые формы мастопатии
СЛВ – склеротический лишай вульвы
2-ОНЕ1 – 2 - гидроксиэстрон
16α-ОНЕ1 - 16α – гидроксиэстрона
ЕР (ER) – эстроген – рецепторы
ВПЧ – вирус папилломы человека
ИМТ – индекс массы тела
CIN I-III - цервикальная интраэпителиальная неоплазия шейки матки I-III степени
АГЭ - атипическая гиперплазия эндометрия
ЗЭОЯ – злокачественные эпителиальные опухоли яичников
ПЭОЯ – пограничные эпителиальные опухоли яичников
ДЭОЯ – доброкачественные эпителиальные опухоли яичников
ВЭБ - вирус Эпштейн – Барр
ИФА – иммуноферментный анализ
ММТV - Mouse Mammary Tumor Virus

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 |



