При исследовании рецепторного статуса при РВ отмечено, что в подавляющем большинстве образцов отсутствуют эстроген – рецепторы (ЭР) в ткани вульвы – в 84,4%. Таким образом, в дистрофически измененной ткани вульвы резко снижается количество ЭР, а при злокачественной трансформации ткани вульвы, в большинстве наблюдений, ЭР отсутствуют. Анализируя результаты исследований необходимо отметить, что основной пул рецепторов в нормальной и дистрофически измененной ткани вульвы сконцентрирован в базальном слое эпителия.
Представление об общем пуле эстрогенов в постменопаузе и интенсивности их периферического воздействия можно получить при измерении индекса массы тела, являющегося косвенным свидетельством гормонально-рецепторного баланса. Избыток массы тела в постменопаузе, как субстрат внегонадного синтеза эстрогенов, является маркером гиперэстрогении. Мы изучили индекс массы тела в группах пациенток со склеротическим лишаем (110 пациенток), раком вульвы (80 пациенток) и в группе контроля (100 пациенток). Среди больных РВ выявлено значительное превышение доли женщин с увеличением индекса массы тела, что составило 82,7%, из них с ожирением – 43,7%, при склеротическом лишае вульвы превышение индекса массы тела отмечено у 61,8% пациенток, тогда как в группе контроля он превышал норму лишь у 34,0%.
Учитывая тот факт, что жировая ткань является источником внегонадного синтеза эстрогенов, а при увеличении содержания 16α-ОНЕ1 патологические процессы в гормон - зависимых тканях усиливаются (, , 2009г.), нами изучено соотношение ИМТ и эстрогенных метаболитов в исследуемых группах пациенток (Табл. 2).
При РВ средний уровень «физиологического» метаболита 2-ОНЕ1 на 34,3% ниже, чем в группе контроля, а уровень «канцерогенного» метаболита 16α-ОНЕ1 на 30,0% выше, чем в контрольной группе. Результаты исследования указывают на то, что и при СЛВ метаболизм эстрогенов ориентирован более на синтез «агрессивных» метаболитов. При РВ соотношение эстрогенных метаболитов демонстрирует достоверное (р<0,05) снижение, составляя 0,98, что на 53,3% меньше, чем у пациенток с нормально протекающей постменопаузой.
Табл. 2 Среднее соотношение эстрогенных метаболитов (2-ОНЕ1/16α-ОНЕ1) в зависимости от ИМТ при склеротическом лишае и раке вульвы в сравнении с контрольной группой
ИМТ | Рак вульвы (N=80) | Склеротический лишай вульвы (N=110) | Контрольная группа (N=100) |
нормальный ИМТ 18,50-24,99 | 1,14±0,21 | 1,86±0,27 | 2,14±0,34 |
повышенный ИМТ 25,00-29,99 | 1,08±0,16 | 1,56±0,2 | 2,03±0,24 |
ожирение ИМТ>30,00 | 0,98±0,18* | 1,21±0,16 | 2,00±0,31 |
*р<0,05 в сравнении с группой контроля
Таким образом, очевидно, что при РВ имеет место повышенный синтез «агрессивных» метаболитов, особенно у пациенток с повышением ИМТ более 30, обладающих высоким пролиферативным потенциалом. У пациенток со СЛВ также выявлен дисбаланс производных эстрогенов и вследствие этого, определенные предпосылки для образования устойчивого пролиферативного сигнала в ткани вульвы, что требует пристального динамического мониторинга данной категории пациенток.
В структуре заболеваний половой сферы у женщин, воспалительные процессы вульвы и влагалища занимают лидирующую позицию, составляя 55-70% (, , 2008г.). В постменопаузе проблема нарушения микробиоценоза вульво - вагинальной зоны усложняется тем, что изменяются многие гомеостатические параметры женского организма. Исходя из этого, особого интереса заслуживает изучение инфекционного фактора в патогенезе СЛВ и РВ. В особенности, рассматривая вульву, влагалище и шейку матки как единую биологическую среду. Особое внимание в наших исследованиях было отведено роли папилломавирусной инфекции, в частности дифференцированному изучению частоты генотипов высокого и низкого онкологического риска и их сочетаний при СЛВ и РВ.
Исследования включали два независимых варианта идентификации ДНК ВПЧ в группе 110 пациенток со СЛВ, 80 больных РВ и в группе контроля (100 пациенток). У всех пациенток контрольной группы присутствовала та или иная инфекция, что не сопровождалось какими - либо клиническими проявлениями воспалительного процесса. Наиболее часто в группе контроля отмечено присутствие гарднерелл (24%). Практически в равной мере диагностирован стрептококк (10,0%), кишечная палочка (10,0%) и вирус простого герпеса II (11,0%). В группе больных со СЛВ с высокой частотой отмечено присутствие папилломавирусной инфекции высокого риска (72,4%), гарднерелл (60,3%), вируса простого герпеса II (25,9%). Значительно реже (12-14%) выявлен стрептококк, грибы кандида, уреаплазма и вирус папилломы низкого риска.
Спектр инфекций, сопутствующих РВ достаточно многообразен: чаще всего определялся стрептококк (78,8%) и грибы рода Candida (60,0%). В 47,5% образцов встречалась кишечная палочка, в 41,3% - хламидии. У 31,3% больных отмечено присутствие вируса простого герпеса II. Следует особо отметить, что в большинстве образцов при СЛВ – 86,3% и при РВ – 83,7%, выявлено присутствие вируса папилломы человека высокого и низкого канцерогенного риска.
Таким образом, доминирующими инфекционными агентами при СЛВ являются вирус папилломы человека высокого риска, гарднерелла и вирус простого герпеса II типа, тогда как при РВ лидирующие позиции занимают вирусы папилломы человека низкого риска, стрептококк и кандида.
Анализируя частоту сочетаний различных инфекций, установлено, что, как в образцах ткани вульвы при СЛВ, так и в образцах опухолевой ткани в подавляющем числе наблюдений имеется присутствие двух и более инфекционных агентов. При РВ микробные ассоциации отмечены в 82,5% наблюдений, при склеротическом лишае – у 74,5% пациенток, значительно меньше этот показатель у пациенток контрольной группы – 41,0%.
Проведено дифференцированное изучение частоты генотипов высокого и низкого онкологического риска и их сочетаний при СЛВ, РВ и в группе контроля (Рис.1). Как свидетельствуют данные исследования, при склеротическом лишае имеется весьма широкий и разнообразный спектр генотипов ВПЧ. 16 и 18 генотипы у пациенток со СЛВ определялись в 14,3% и 22,4% наблюдений соответственно. Вирус папилломы человека 55 генотипа также выявлен в 22,4% наблюдений. Гораздо чаще диагностировались,3%) и,8%) генотипы. Из генотипов низкого риска в большей степени встречаются 53, 66 и 42.
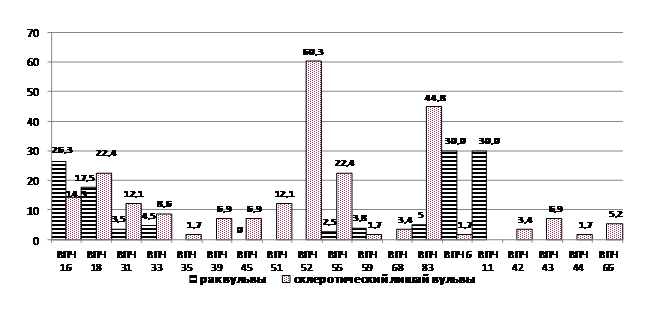
Рис. 1 Частота (в %) выявления различных генотипов вируса папилломы человека при склеротическом лишае и раке вульвы
С наибольшей частотой при РВ выявлялись 6 и 11 генотипы. Исследованиями выявлены следующие ассоциации: 18 генотипа собразец), собразец), собразец); 55 генотипа собразец), 59 и 83 генотипа (1 образец). Наряду с этим, не отмечено ни одного наблюдения ассоциации какого-либо генотипа с 16 генотипом. Как правило, 16 генотип выявлялся изолированно. Генотипы 16 и 18, трактуемые, на модели рака шейки матки, как высокого онкологического риска, при раке вульвы выявлены в 43,8% наблюдений.
При I стадии заболевания в большинстве образцов (58,8%) характерно наличие 6/11 генотипов (при p<0,05). С равной частотой (11,8%) отмечено присутствие 16, 18 и 83 генотипов. При I стадии выявлено также сочетание 59 с 83 генотипом ВПЧ.
Изучена частота выявления различных генотипов, в зависимости от стадии РВ и дифференцировки опухоли. Из проведенного анализа можно сделать следующие заключения: 1. При низкодифференцированном варианте плоскоклеточного РВ у трети пациенток (30,8%) не удается установить присутствие ВПЧ, тогда как при высокой дифференцировке опухоли, ВПЧ - негативных наблюдений значительно меньше – 10,7%. 2. При высокодифференцированных вариантах опухоли чаще выявляется 6/11 и 18 генотипы (42,9 и 32,1% соответственно), чем это имеет место при неороговевающем раке (23,1 и 11,5% соответственно). 3. В группе больных, с высокодифференцированной формой опухоли (ороговевающий рак) определялось сочетание генотипов, в то время как, у пациенток с наличием рака низкой дифференцировки определялась моноинфекция.
Таким образом, нашими исследованиями показано, что в генезе РВ принимают участие несколько генотипов ВПЧ. Причем, наибольшее значение при этом имеют ВПЧ 6/11 типов, которые, как известно, относятся к генотипам низкого риска. Вероятно, что в онкогенной трансформации плоскоклеточного эпителия принимают участие вирусы разных генотипов, имеющие не одинаковую органную тропность.
Следующим этапом наших исследований стало изучение уровня экспрессии онкобелка Е 7 при различных поражениях вульвы для определения интеграции ДНК ВПЧ в клеточный геном. После инфицирования ВПЧ в клетках нарушается нормальный процесс дифференцировки. Условия, при которых вирус способен проникнуть и взаимодействовать с базальными клетками, наиболее ярко проявляются при СЛВ. Наличие онкобелка Е 7 в пробах из опухоли может рассматриваться как однозначное свидетельство вирус - ассоцированного злокачественного процесса. Неоспоримым достоинством Е 7, как маркера является то, что в норме этот белок в тканях не синтезируется. В нашей работе иммуноферментный анализ выполнен в 60 образцах РВ (48 больных с наличием ВПЧ в опухоли и 12 больных без ПЦР данных за наличие ВПЧ) и в 52 образцах при СЛВ (40 пациенток с наличием ВПЧ и 12 пациенток без ПЦР данных за его наличие).
Из 48 больных с вирусассоцированным РВ у 34 имели место 16 и 18 генотипы. Причем, отбирались больные преимущественно I - II стадий. Как и следовало ожидать, положительные результаты получены лишь в образцах, где имелись генотипы 16 и 18 - в 56,7% наблюдений. Значения онкобелка Е 7 были весьма вариабельны и колебались в диапазоне 0,06-12 ng/ml. При вирус - независимых опухолевых процессах онкобелок Е 7 не определялся. При СЛВ имелась похожая картина: онкобелок Е 7 был выявлен только у пациенток с идентифицированными при ПЦР – диагностике 16 и 18 генотипами ВПЧ – в 30,7% . Однако, в 5 наблюдениях с наличием ВПЧ 16 типа и в 8 наблюдениях при ВПЧ 18 типа, онкобелок выявлен не был, а концентрации Е 7 были значительно ниже (до 5,0 ng/ml), чем у пациенток с наличием опухолей вульвы. Этот факт объясняется, тем, что вирус папилломы у данной категории пациенток находится еще в эписомальной форме и не интегрирован в ДНК.
Изучение синтеза онкобелка Е 7 в вирусиндуцируемых опухолях и предраковых заболеваниях актуально с диагностической, лечебной и прогностической точек зрения. Специфичность теста на белок Е 7 позволяет использовать его в ранней диагностике РВ, в особенности при возникновении его на фоне предшествующих дистрофических заболеваний. Все вышесказанное может быть отражено следующей схемой (Рис. 2):
 |
Рис. 2 Этапы злокачественной трансформации при раке вульвы в постменопаузальном периоде
Рак шейки матки
Исследованиями установлено, что в той зоне шейки матки, где наблюдается активная экспрессия вирусных белков, отмечен высокий уровень синтеза 16α - ОНЕ1, сравнимый с таковым в клетках молочных желез при раке (Auborn K,1991). Следует отметить, что нормальные клетки эпителия шейки матки не способны к превращению эстрадиола в 16 – гидроксиэстрон. Активная репликация ВПЧ индуцирует образование агрессивного метаболита в инфицированных им клетках (, И, 2008; , 2010г.). Исходя из вышесказанного, нами проанализированы средние уровни метаболитов 2-ОНЕ1 и 16α-ОНЕ1 у женщин постменопаузального периода при РШМ (125 пациенток), дисплазии шейки матки I – III степени (CIN I-IIIпациенток, в сравнении с группой контроля (100 пациенток).
Выявлено, что в группе пациенток с наличием дисплазий различной степени тяжести данные количественного определения уровней метаболитов и их соотношения достоверно не отличались от показателей возрастной нормы. Соотношение метаболитов 2-ОНЕ1/16α-ОНЕ1, которое является маркером риска развития эстроген – зависимых опухолей, также было снижено лишь на 7,1%, по сравнению с группой контроля. Обращаясь к группе больных РШМ, наблюдается иная картина - средний уровень «физиологического» метаболита 2-ОНЕ1 был на 35,3% ниже, чем в группе контроля, а уровень «агрессивного» метаболита 16α-ОНЕ1 - на 35,2% выше, чем в контрольной группе. Результаты исследования демонстрируют, что при РШМ метаболизм эстрогенов в значительной степени ориентирован на синтез «канцерогенных» метаболитов.
Оценено среднее соотношение эстрогенных метаболитов у пациенток при РШМ и дисплазиях в зависимости от ИМТ (Табл. 3).
Табл. 3 Среднее соотношение эстрогенных метаболитов (2-ОНЕ1/16α-ОНЕ1), в зависимости от ИМТ при раке шейки матки и CIN I - III степени
ИМТ | Рак шейки матки (N=125) | CIN I – III (N=198) | Контрольная группа (N=100) |
Нормальный ИМТ 18,50-24,99 | 1,12±0,18 | 2,00±0,35 | 2,14±0,39 |
Повышенный ИМТ 25,00-29,99 | 1,08±0,16 | 1,88±0,40 | 2,03±0,29 |
Ожирение ИМТ>30,00 | 0,78±0,19* | 1,76±0,29 | 2,00±0,31 |
*р<0,05 в сравнении с группой контроля
При РШМ отмечено значительное снижение коэффициента соотношения метаболитов 2-ОНЕ1/16α-ОНЕ1 по сравнению с группой контроля, причем при повышении ИМТ, а, в особенности, при ожирении, данные различия становятся все более очевидны. При ИМТ более 30 у больных РШМ определяется снижение соотношения метаболитов эстрогенов на 61,0% в сравнении с группой контроля. Таким образом, еще раз подтверждается тот факт, что при РШМ имеет место повышенный синтез «агрессивных» метаболитов, особенно у пациенток с превышением ИМТ. Что касается группы женщин в постменопаузе с наличием CIN различных степеней тяжести, исследование соотношения метаболитов не продемонстрировало столь значимых различий в сравнении с группой контроля. Следует заключить, что при превышении ИМТ, а, следовательно, и метаболических нарушений, в сочетании с другими инициирующими факторами, происходит активизация процессов клеточной пролиферации, постепенно приводя к развитию злокачественной неоплазии эпителия шейки матки.
В нашей работе оценена роль ВПЧ в развитии цервикальных интраэпителиальных неоплазий и РШМ. Проведено исследование ВПЧ высокого и низкого риска в 3 группах пациенток: 100 пациенток контрольной группы, 491 пациентки с цервикальной интраэпителиальной неоплазией шейки матки (CIN I-III), 125 больных раком шейки матки. В контрольную группу были включены пациентки, у которых клинически, кольпоскопически и цитологически не была выявлена патология шейки матки.
Учитывая интерес исследователей к изучению роли онкобелка Е 7, обладающего выраженным трансформирующим действием на клетку, проведено выявление онкобелка Е 7 в качестве маркера развития неоплазии шейки матки. Проводилось выявление онкобелка Е7 к ВПЧ 16 и 18 генотипов.
Каждая из трех групп пациенток была разделена на четыре подгруппы, в зависимости от детекции ВПЧ и онкобелка Е 7:1. ВПЧ+/ Е 7+; 2. ВПЧ +/ Е 7-; 3. ВПЧ -/ Е 7+; 4.ВПЧ -/Е 7-.
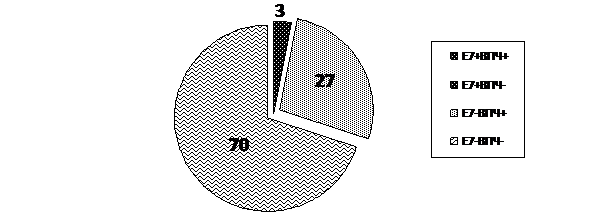
Рис. 3 Результаты исследования на ВПЧ (ПЦР - диагностика) и наличие онкобелка Е 7 у пациенток контрольной группы
Отметим, что интеграция ДНК ВПЧ в геном клеток сопровождается двумя молекулярными событиями: 1.Встраивание вирусной ДНК в хромосому всегда сопровождается нарушением структуры гена Е 2, который является репрессором ЕПри интеграции ДНК вируса синтез белка Е 2 прекращается вследствие нарушения структуры соответствующего гена и активируется синтез белка Е 7 (, 2004г.). То есть, факт интеграции вирусной ДНК может быть зарегистрирован или изучением структуры гена Е 2 (эти методы в стадии разработок) или измерением уровня синтеза онкобелка Е 7. Таким образом, измерение уровня онкобелка Е 7 позволяет уточнить характер вирусной инфекции, возможность ее регрессии и/или злокачественной трансформации в случае интеграции ВПЧ в клеточный геном.
По существующим эпидемиологическим данным, доля ВПЧ - носителей в женской популяции варьирует от 20% до 60% (Cancer Stats, 2006; Cuzick J, 2006; Castle PE, 2005; Goldie SJ, 2000). Однако чаще всего поражение носит транзиторный характер, и в значительном числе случаев регрессирует, даже при дисплазиях различной степени тяжести. Исследованиями доказано, что рак шейки матки развивается последовательно, путем перехода из дисплазии в преинвазивный (in situ), затем в микроинвазивный, и, наконец, в инвазивный рак (Ostor AG, 1993).
В группе контроля (Рис. 3) выявлен факт достаточно широкого носительства папилломавирусной инфекции. Случаи выявления ВПЧ среднего и низкого риска отмечались только в группе CIN – 9 наблюдений (выявили 33 генотип) и в контрольной группе, где с наибольшей частотой обнаруживались вирусы 6 и 11 генотипов (16 наблюдений), а также по 5 случаев 33, 52, 83 генотипы. Полученные результаты свидетельствуют о том, что в большинстве наблюдений в контрольной группе отсутствовала вирусная инфекция – 70,0% женщин. Однако в 27% наблюдений имело место вирусоносительство, а у 3 женщин (3,0%) отмечено присутствие в образцах онкобелка Е 7.
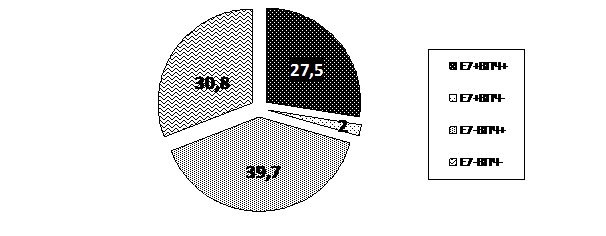
Рис. 4 Результаты исследования на ВПЧ (ПЦР – диагностика) и наличие онкобелка Е 7 у пациенток с дисплазиями шейки матки различной степени выраженности (CIN I-III)
Доля пациенток с наличием дисплазий шейки матки различных степеней тяжести, у которых был выявлен ВПЧ высокого онкогенного риска и определялся онкобелок Е 7 в цервикальном материале (ВПЧ +Е 7+), составила 27,5% (Рис. 4). При исследовании материала на Е 7 16 типа этот показатель составил 56,4% от общего количества обследованных в группе дисплазий, при исследовании Е 7 18 типа - 43,6%. В процессе анализа полученных данных, выявлена статистически достоверная взаимосвязь между фактом наличия CIN и выявлением онкобелков Е7. Для Е7 16 - р=0,403, для Е7 18 - р= 0,315. Эта группа пациенток представляет ВПЧ – зависимый процесс канцерогенеза. То, что белок Е 7 обнаруживается у значительного числа ВПЧ – положительных пациенток с дисплазиями, свидетельствует о значимости его влияния на процессы клеточной трансформации.
В клинической практике это означает, что если у ВПЧ – положительной пациентки выявлен онкобелок Е 7, следовательно, на субклеточном уровне уже запущены процессы клеточной трансформации, что требует активной лечебно – диагностической тактики в отношении данной больной.
Интерес представляет подгруппа пациенток, в цервикальных пробах которых определялся онкобелок Е 7, однако ВПЧ 16/18 генотипов при ПЦР – диагностике выявлены не были. Доля таких наблюдений была 2%. Эта ситуация нам до конца не ясна, но учитывая то, что онкобелок Е 7 высоко специфичен для ВПЧ, являясь продуктом его «жизнедеятельности», можно предположить, что образцы из данной группы тоже являются ВПЧ – положительными и полностью укладываются в схему, описанную нами для предыдущей группы больных. Таким образом, в группе больных с дисплазиями удельный вес пациенток с Е 7 положительными пробами составил 29,5%. То есть, треть пациенток с дисплазиями имеют интегрированный вариант вируса с экспрессией белка Е 7, что, с позиций предрака шейки матки, формирует облигатное состояние.
Среди пациенток с наличием дисплазии имелась подгруппа, в которой в цервикальных пробах определялся ВПЧ высокого онкогенного риска, а онкобелки Е 7 16 и 18 типов не были выявлены при иммуноферментном анализе цервикальных проб – 39,7%. Состояние ВПЧ в клетках эпителия шейки матки в данной подгруппе соответствует эписомальному варианту вирусной инфекции и является значительно более благоприятным в отношении малигнизации.
В следующей подгруппе женщин - 30,8% - с наличием CIN и отсутствием вирусной инфекции, по данным ПЦР – диагностики экспрессия онкобелка Е 7 не определялась. Данная подгруппа пациенток по новому формирует наше понимание причин развития цервикальных неоплазий, в основе которых не только вирусная индукция, но множество других причин, способных стимулировать патологическую пролиферацию. В подавляющем числе наблюдений при CIN (70,5%) отсутствует интеграция ДНК ВПЧ в геном плоского эпителия шейки матки.
Иными словами, одна и та же морфологическая картина при дисплазиях, по-видимому, может формироваться в результате различных причин, среди которых доля ВПЧ – составляющей, по данным наших исследований, – 29,5%.
Далее мы изучили соотношение частоты Е 7- положительных наблюдений в зависимости от степени дисплазии. Как мы и предполагали, частота Е 7-положительных проб увеличивалась от CIN I к CIN III (рис.5).
Важным фактом, следующим из полученных результатов, является то, что у части пациенток с легкими диспластическими изменениями плоского эпителия (CIN 1) в 10,9% наблюдений уже отмечается присутствие белка Е 7, что диктует необходимость принятия более решительных мер вторичной профилактики рака. Второй момент, который следует отметить, – это практически одинаковая частота Е 7 положительных проб при CIN II и CIN III (31,2% и 37,9%), при этом процент наблюдений с Е 7+ для СIN3 относительно невысок, если учесть, что в клинической практике этой группе пациенток, как правило, выполняется хирургическое лечение начиная с конизации шейки матки и заканчивая экстирпацией матки.
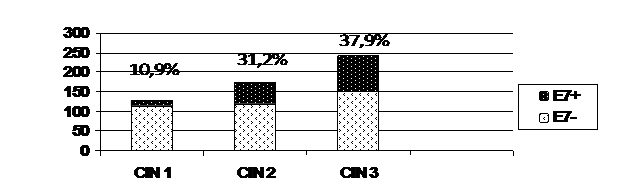
Рис. 5 Соотношение Е 7 - и Е 7 + проб в зависимости от степени дисплазии (CIN I-III)
Очевидно, что в группе дисплазий дифференцируются две биологические модели процесса. В одном случае, где экспрессия белка Е 7 отсутствует, диспластические изменения, по-видимому, индуцированы неблагоприятным биоценозом влагалищной среды и как ответная реакция – патологической пролиферацией плоского эпителия. В этом варианте пролиферация является частью контролируемого регенераторного процесса и отражает состояние хронического воспаления. В другом случае, где отмечен синтез белка Е 7, - уже запущен начальный этап канцерогенеза. С появлением этого белка, как уже было отмечено, включаются разнообразные механизмы, обеспечивающие неконтролируемую пролиферацию. Присутствие белка Е 7, даже без серьезных морфологических изменений эпителия шейки матки, важный и тревожный признак развивающегося злокачественного процесса. По сути дела белок Е 7 отражает биохимический этап канцерогенеза.
Нами были обследованы 125 пациенток с морфологически верифицированным диагнозом плоскоклеточного рака шейки матки.
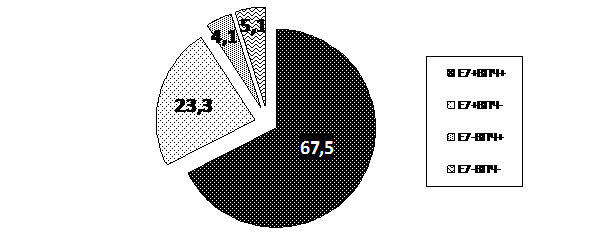
Рис. 6 Результаты исследования на ВПЧ (ПЦР – диагностика) и наличие онкобелка Е 7 при раке шейки матки
Как представлено на рисунке 6, в группе больных РШМ частота детекции 16 и 18 генотипов ВПЧ составила 71,6%. При этом, экспрессия белка Е 7 имела место в 90,8% наблюдений. Различия между этими показателями, возможно, могут быть объяснены способностью иммуноферментного анализа идентифицировать экспрессию онкобелка Е 7 других генотипов ВПЧ. Тогда с уверенностью можно говорить о высокой его чувствительности (практически 100%). Онкобелок Е 7 16 генотипа в нашем исследовании обнаружен у 55,8% больных РШМ, а онкобелок Е 7 18 типа – у 15,8%. Эти данные сопоставимы с данными литературы, где ВПЧ 16 типа выявляется у 50-60% больных цервикальным раком, а ВПЧ 18 – у 15-20%. У 4,1% больных РШМ в цервикальном материале обнаружен ВПЧ высокого онкогенного риска, при этом онкобелок Е 7 выявлен не был (ВПЧ + Е7 -). Возможно, это та группа больных, где за развитие цервикального рака отвечают ВПЧ высокого онкогенного риска, не относящиеся к генотипам, которые регистрируются используемой нами тест - системой. Соответственно в этих случаях в процессе канцерогенеза вирус будет продуцировать типоспецифические онкобелки Е 7. Вопрос этот неоднозначен и требует дальнейшего изучения.
Среди обследованных больных с наличием РШМ, в 5,1% образцов не было выявлено ВПЧ, а так же не определялась экспрессия онкобелка Е7, что предполагает ВПЧ – независимый характер развития цервикального рака.
На основании проведенных исследований при раке шейки матки и дисплазиях различной степени тяжести, становится очевидным, что для запуска механизмов канцерогенеза недостаточно лишь инфицирования эпителиальных клеток ВПЧ. Один из основных путей малигнизации заключается в том, что ВПЧ модифицирует клеточный метаболизм, создавая условия для формирования «агрессивных» метаболитов эстрогенов, активизирующих опухолевую трансформацию клеток, за счет активации онкобелка Е 7. Создается «порочный круг», в котором онкопротеин Е 7 активизирует патологическую пролиферацию и блокирует механизмы иммунологической защиты клетки. В конечном итоге, механизм канцерогенеза при РШМ в постменопаузе может быть отражен следующей схемой (Рис. 7):
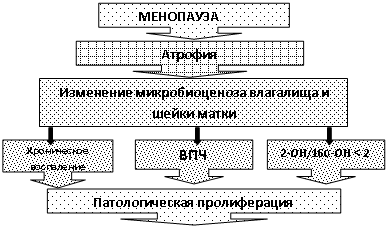

Рис. 7 Этапы злокачественной трансформации при раке шейки матки в постменопаузальном периоде
Рак эндометрия.
Общеизвестно, что эндометрий является гормоночувствительной тканью, находящейся под воздействием половых гормонов, таких как эстрогены и прогестерон. Если для репродуктивного периода полнее очевидно, что гормональный ответ осуществляется посредством воздействия на специфические рецепторы, являющиеся необходимым периферическим звеном эндокринной функции, то в постменопаузе эти два звена претерпевают значительные изменения вследствие изменения спектра секретируемых гормонов, а так же снижения уровня рецепторов.
В наших исследованиях был изучен рецепторный статус опухоли у 100 больных с наличием аденокарциномы эндометрия в постменопаузальном периоде методом иммуногистохимии и у 82 больных раком эндометрия - методом полимеразной цепной реакции в «режиме реального времени» с предварительной реакцией обратной транскрипции (ОТ-ПЦР). Так же было изучено состояние рецепторного аппарата эндометрия при атипической гиперплазии (АГЭ) у 50 женщин, находящихся в постменопаузе. В качестве группы контроля была исследована ткань эндометрия в состоянии атрофии у 64 женщин постменопаузального возраста.
Табл. 4 Уровень эстроген - рецепторов (%) в ткани эндометрия при атипической гиперплазии и раке эндометрия (иммуногистохимический метод)
Группа пациенток | Число пациенток | Уровень рецепторов | |||
ER- | ER+ | ER++ | ER+++ | ||
Рак эндометрия | 100 | 30,0 | 10,0 | 20,0 | 40,0 |
Атипическая гиперплазия эндометрия | 50 | 26,0 | 12,0 | 18,0 | 38,0 |
Контрольная группа | 64 | 44,9 | 21,8 | 11,5 | 21,8 |
р<0,1

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 |



