В клинической практике принято считать положительным значением данные, соответствующие ЭР+++ (50% - 100%). Полученные результаты (Табл. 4) свидетельствуют о значительном повышении количества эстроген - позитивных образцов в группе больных РЭ. В наших исследованиях уровень эстроген - рецепторов при раке эндометрия в два раза превышал данные по контрольной группе (40,0% против 21,8%). Состояние рецепторного аппарата при атипической гиперплазии было близким, по уровню рецепторов, к РЭ.
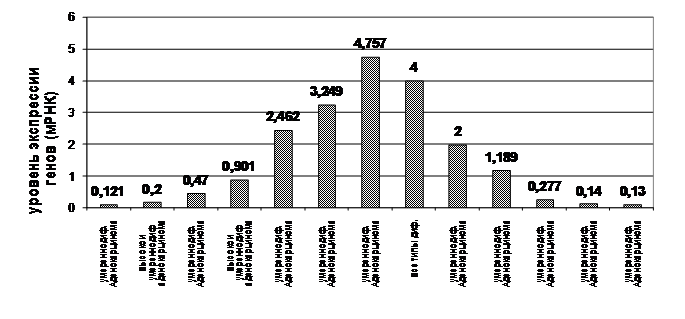
Рис. 8 Относительный уровень экспрессии генов (мРНК) эстрогеновых рецепторов (ESR) методом полимеразной цепной реакции с предварительной реакцией обратной транскрипции (ОТ-ПЦР).
Следующим этапом нашего исследования стало изучение уровня экспрессии генов (мРНК) эстрогеновых рецепторов (ESR) при раке эндометрия
методом полимеразной цепной реакции в «режиме реального времени» с предварительной реакцией обратной транскрипции (ОТ-ПЦР) (Рис. 8).
Во всех образцах опухоли имелась экспрессия мРНК эстрогеновых рецепторов, однако уровень экспрессии был весьма вариабелен.
Основным результатом проведенного исследования явилось то, что экспрессия была прослежена и в тех образцах, где данные иммуногистохимического метода в отношении уровня эстрогеновых рецепторов были отрицательные, а так же, из рисунка 8 видно, что уровень экспрессии был наивысшим при умереннодифференцированном варианте опухоли. Это, по-видимому, связано с тем, что иммуногистохимический метод отражает количественно уровень белка рецептора, в то время, как метод ОТ-ПЦР дает информацию о генетическом фрагменте, ответственном за экспрессию этого белка.
Таким образом, полученные результаты позволяют предположить, что при всех вариантах РЭ присутствует гормональная составляющая. Причем, эстрогеновый рецептор способен взаимодействовать с любым лигандом, у которого “молекулярный диапазон” близок к эстрогенам. Молекулярная формула метаболита 16α-ОНЕ-1 в этом смысле, очевидно наиболее приближена. Таким образом, по-видимому, для реализации гормонального эффекта в присутствии такого «агрессивного» метаболита как 16а-ОНЕ-1, достаточно минимального уровня эстрогеновых рецепторов.
Согласно концепции о двух основных патогенетических вариантах РЭ, в 60-70% наблюдений превалирует так называемый гормонозависимый вариант, характеризующийся выраженными эндокринно-обменными нарушениями. Разделение рака эндометрия на два патогенетических варианта по сути дела обозначило некую концептуальную составляющую в отношении цепочки тех гомеостатических нарушений, в результате которых формируются условия для возникновения и развития злокачественного процесса в эндометрии. Во всяком случае, для I патогенетического варианта основные нарушения сконцентрированы внутри метаболического синдрома.
Одним из проявлений эндокринно-обменных нарушений является ожирение, чему нередко сопутствуют инсулинорезистентность и гиперинсулинемия, являющиеся основным патогенетическим звеном развития метаболического синдрома. На материале наших исследований данная теория наглядно подтверждается при оценке индекса массы тела и соотношения метаболитов эстрогенов в группе больных раком эндометрия (100 больных), атипической гиперплазией эндометрия (50 пациенток), в сравнении с контрольной группой женщин в постменопаузе (100 женщин). У 62 больных раком эндометрия определялся повышенный индекс массы тела, а у 42 женщин этой группы имелось ожирение. При этом в контрольной группе повышенный индекс массы отмечен лишь у 34 женщин, а ожирение – у 14. Из 50 пациенток с наличием АГЭ, повышение ИМТ имелось у 66% женщин, а у 40% из них отмечено наличие выраженного ожирения. Таким образом, такой ключевой фактор метаболического синдрома, как ожирение, приводит к запуску механизма гормонального канцерогенеза, которые в данном случае сопряжены не столько с избыточной продукцией классических эстрогенов, сколько с особенностями метаболизма стероидов в постменопаузе, с образованием «агрессивных» метаболитов, и их влиянием на ткани-мишени, в том числе, на эндометрий.
Для доказательства наших предположений мы изучили уровень метаболитов в моче (16α-ОНЕ1, 2-ОНЕ1) и их соотношение, в зависимости от ИМТ у пациенток при РЭ – у 88 больных, АГЭ – у 32 пациенток и в контрольной группе у 100 женщин (Табл. 5). По мере нарастания ИМТ снижается коэффициент соотношения метаболитов. В то же время в группе пациенток с наличием АГЭ и в группе контроля данное соотношение подвержено меньшим колебаниям.
Таб. 5 Среднее соотношение метаболитов эстрогенов (2-ОНЕ1/16α-ОНЕ1) в зависимости от ИМТ у пациенток с атипической гиперплазией и раком эндометрия
ИМТ | Рак эндометрия (N=88) | Атипическая гиперплазия эндометрия (N=32) | Контрольная группа (N=100) |
нормальный ИМТ 18,50-24,99 | 1,38±0,2 | 1,67±0,21 | 2,14±0,39 |
повышенный ИМТ 25,00-29,99 | 1,12±0,25 | 1,34±0,3 | 2,03±0,29 |
ожирение ИМТ>30,00 | 0,95±0,21* | 1,22±0,23 | 2,00±0,31 |
*р<0,05 в сравнении с группой контроля
Таким образом, полученные данные еще раз подтверждают тезис о том, что соотношение 2-ОНЕ1 к 16α-ОНЕ1 можно считать адекватным маркером и диагностическим критерием при определении риска и прогноза развития гормонально индуцируемого варианта рака эндометрия. Что касается II патогенетического варианта, то понимание истинных механизмов канцерогенеза до настоящего времени не было. Пытаясь объяснить этот путь канцерогенеза, мы изучили возможную инфекционную составляющую при раке эндометрия.
At least 20 million people in this country are already infected. В связи с этим была изучена роль ВПЧ в генезе пролиферативных заболеваний и рака эндометрия. С этой целью были исследованы образцы ткани эндометрия 68 больных раком эндометрия, 35 больных атипической гиперплазией эндометрия и 52 пациенток контрольной группы с атрофией эндометрия.
Результаты данного фрагмента исследования свидетельствуют, о том, что при ПЦР-диагностике вирус папилломы человека в ткани РЭ выявлен лишь в 7 образцах, при АГЭ ВПЧ выявлен у 3 пациенток. В контрольной группе ВПЧ в образцах ткани эндометрия выявлен у 5 женщин.
При изучении остального микробиологического спектра возбудителей в ткани эндометрия исследуемых групп, лишь в 1 образце ткани при РЭ был выявлен вирус простого герпеса.
Тот факт, что частота выявления папилломавирусной и бактериальной инфекции достоверно низка, как в образцах опухоли, так и при атипической гиперплазии, свидетельствует о том, что инфекционный фактор, как вирусный, так и бактериальный, не играет существенной роли в патогенезе рака и предрака эндометрия.
Таб. 6 Частота выявления ВПЧ (%) в образцах опухолевой и нормальной ткани эндометрия с использованием метода ПЦР
Группа исследования | Число пациенток | ВПЧ - позитивные образцы ткани | ВПЧ - негативные образцы ткани |
Рак эндометрия | 68 | 11,7% | 88,3% |
Атипическая гиперплазия эндометрия | 35 | 8,6% | 91,4% |
Контрольная группа | 52 | 9,6% | 90,4% |
р>0,05
Таким образом, обобщая наши данные, можно сказать, что ведущая роль в патогенезе РЭ принадлежит гормональной составляющей. Для формирования процессов опухолеобразования уровень экспрессии рецепторов может быть достаточно низким, но вполне достаточным для реализации канцерогенного эффекта «агрессивных» метаболитов. Этот путь канцерогенеза вполне логически вписывается в концепцию I патогенетического варианта (, 1972). Развитие концепции II патогенетического варианта было связано с исследованиями, которые начались в РНЦРР с 1986 года по настоящее время. В многочисленных работах была показана, морфологическая неоднородность того фона, на котором формируются начальные этапы злокачественного процесса при раннем (микроинвазивном) раке эндометрия.
 |  |  |
![]() I тип II тип III тип
I тип II тип III тип
I вариант
- опухоль - гиперплазия - норма - атрофия
Рис. 9 Соотношение различных вариантов рота опухоли при раке эндометрия в постменопаузальном периоде
При начальном раке можно обозначить три типа макро - и микроскопически определяемых процесса (Рис. 9). При I и II типе явно прослеживается гормональная составляющая, выраженная в наличии гиперпластического фона. При III типе роста развитие злокачественного процесса формируется на фоне абсолютной атрофии, что указывает на явное отсутствие сколь-нибудь существенного гормонального компонента. И именно при этом варианте РЭ особую значимость приобретает функциональное состояние атрофии и хроническое воспаление, следствием которого становится патологическая пролиферация, индуцируемая стволовыми (прогениторными) клетками, имеющими к этому времени целый ряд генетических поломок. Таким сегодня нам представляется второй вариант канцерогенеза при РЭ, что отражено на рисунке 10.
 |  |
![]() I вариант II вариант
I вариант II вариант
рака эндометрия рака эндометрия
![]()

 |
 |
Рис. 10 Компоненты, формирующие канцерогенез эндометрия в постменопаузальном периоде
Рак яичников.
Несмотря на большое количество публикаций, доказывающих или опровергающих причастность папилломавирусной инфекции к злокачественной трансформации эпителиальной ткани яичников, до настоящего времени не существует единого мнения на этот счет. Данные факты подтолкнули нас к изучению ряда принципиальных моментов, обосновывающих и формирующих позиции инфекционной составляющей в канцерогенезе эпителиального РЯ. Предметом изучения в настоящем разделе явились образцы ткани яичников 98 больных эпителиальным раком яичников (ЗЭОЯ), 42 пациенток с пограничными опухолями яичников (ПЭОЯ), 48 женщин с доброкачественными опухолями яичников (ДЭОЯ), в сравнении с образцами ткани 60 женщин контрольной группы, с отсутствием патологии в ткани яичников. В группе больных злокачественными эпителиальными опухолями яичников были выделены подгруппы: пациентки с наличием серозного рака яичников – 76 больных и с муцинозными опухолями – 22 женщины.
Мы изучили спектр бактериальных и вирусных агентов в образцах ткани яичников. При ПЦР-диагностике в образцах опухолевой и нормальной тканей яичников микоплазменная урогенитальная инфекция не была выявлена. Изучение частоты хламидийной и уреаплазменной урогенитальной инфекции в образцах ЗЭОЯ, ПЭОЯ и ДЭОЯ так же наглядно продемонстрировало низкий уровень их выделения, который составил 5,1% и 3,0% образцов при ЗЭОЯ и 2,4% и 2,4% - при ПЭОЯ соответственно. В контрольной группе и при ДЭОЯ положительных результатов установлено не было.
Частота определения вируса Эпштейн – Барр (ВЭБ-инфекция) в группе ЗЭОЯ составила 39,8% наблюдений и была значительно выше по сравнению с контрольной группой – 11,7%. При ПЭОЯ частота ВЭБ – инфекции составила 19,0%, при ДЭОЯ – 6,3%. Надо отметить, что, в контрольной группе отмечалось повышение частоты детекции вируса простого герпеса II типа (30%), которая была в четыре раза выше, чем у больных ЗЭОЯ (8,2%) (p<0,05). Значения частоты цитомегаловирусной инфекции в группах были практически равные – 3% и 4,8%, 2% и 5% случаев соответственно (p>0,05).
Полученные результаты, свидетельствуют о том, что с наибольшей частотой в опухолевой ткани определяется ВЭБ-инфекция, которая, как правило, носит сочетанный характер. Так, ассоциация ВЭБ с ВПЧ отмечена в 27,5% наблюдений при ЗЭОЯ, а изолированное течение инфекционного процесса – в 10,2% случаев. При этом чаще встречалось сочетание ВЭБ-инфекции с,6%),,2%) и 18 (6,1%) генотипами ВПЧ. При пограничных опухолях сочетание ВЭБ – и ВПЧ – инфекции с 52 серотипом имелось в 12,5% и с 55 – в 8,3% наблюдений. Таким образом, ассоциация ВЭБ и ВПЧ, по нашим данным отмечавшаяся в 28,0% случаев, может оказывать взаимопотенциирующее влияние, приводя к выраженным нарушениям генетического гомеостаза клетки.
Следующим этапом наших исследований явилось изучение вируса папилломы человека в тканях опухолей яичников различного гистогенеза в сравнении с группой контроля. При ДНК-диагностике ВПЧ в 76,5% случаев злокачественных опухолей яичников ВПЧ был положительным. В нормальной же ткани яичников лишь 8% случаев зарегистрированы позитивные результаты (p<0,05).
Причем, частота выявления ВПЧ в образцах серозного (n=76) и муцинозного (n=22) РЯ имела практически одинаковые значения – 75,3% и 77,3% соответственно (p>0,05). При пограничных опухолях яичников процент ВПЧ негативных и ВПЧ - позитивных образцов был примерно одинаков (45,8% и 54,2% соответственно), тогда как при ДЭОЯ ВПЧ не был идентифицирован в 65,4% наблюдений. Тот факт, что ВПЧ при различных вариантах РЯ выявляется статистически достоверно выше, чем в нормальных тканях, а так же наличие ВПЧ в 54,2% наблюдений при пограничных опухолях яичников, позволяет предположить его существенную роль в возникновении и развитии неоплазий яичников.
Нами установлено, что с наибольшей частотой эпителиальный РЯ ассоциируется с ВПЧ,6%), ВПЧ,6%), ВПЧ,6%), ВПЧ,4%), ВПЧ,3%) генотипами (рис. 11).
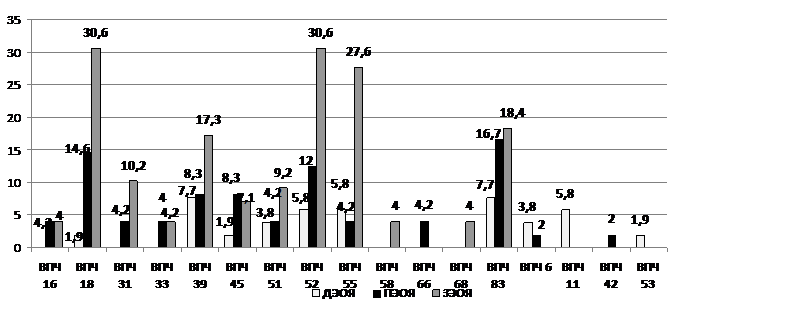 Рис. 11 Частота выявления генотипов ВПЧ (%) в образцах ткани при злокачественных, пограничных и доброкачественных опухолях яичников методом ПЦР
Рис. 11 Частота выявления генотипов ВПЧ (%) в образцах ткани при злокачественных, пограничных и доброкачественных опухолях яичников методом ПЦР
При пограничных опухолях отмечалась такая же тенденция, как и при злокачественных опухолях: в наибольшем числе наблюдений присутствовали ВПЧ 18 и 83 генотипов (16,7%), 39 и 52 генотипа -12,5%. ВПЧ с низким онкогенным потенциалом определялись лишь в образцах ткани при ДЭОЯ. Так ВПЧ 11 генотипа выявлялся в 5,8% случаев, 6 генотипа – в 3,8%, а 53 генотипа - в 1,9%. Как правило, в большинстве случаев (54,2%) определялось сочетание двух и более генотипов ВПЧ высокого онкологического риска. Доля пациенток с наличием 16 и 18 генотипов при ПЭОЯ составила 18,8%, а при ДЭОЯ – лишь у 1 пациентки в ткани яичников определялся ВПЧ 18 генотипа.
Обнаружено, что муцинозный РЯ с наибольшей частотой сочетается с ВПЧ,2%) генотипом (р<0,01), а при серозном РЯ в большинстве овариальных проб выявлено присутствие ВПЧ,8%) и,9%) типов (р<0,01). Разница статистически достоверна.
Оценивая результаты наших исследований в отношении роли ВПЧ в генезе эпителиальных опухолей яичников, хотелось бы отметить три основных обстоятельства. Первое, это то, что ВПЧ 18, 52, 55, 83 и 39 генотипов, обладает высоким онкогенным потенциалом в отношении эпителиального РЯ. Второе - несмотря на низкую частоту выявления ПВИ 73, 31, 51, 45, 33, 66, 68 и 16 генотипов, все же нельзя отрицать их роль в канцерогенезе эпителиальных опухолей яичников. По-видимому, ВПЧ 35, 58, 59, 6, 11, 42, 53 и 54 генотипов, необходимо трактовать как типы низкого онкологического риска для развития ЗЭОЯ. Третьим обстоятельством является то, что, основываясь на различных результатах исследования ВПЧ при серозных и эпителиальных вариантах РЯ, следует предполагать различную значимость того или иного генотипа в зависимости от гистогенеза опухоли.
В исследовании проанализирован уровень экспрессии онкобелка Е 7 методом иммуноферментного анализа (ИФА) с использованием широкой панели моноклональных антител для ВПЧ 18 генотипа в 61 овариальных пробах при раке яичников (из них 20 образцов ткани были ВПЧ-18 позитивны и 41 образец – ВПЧ – негативен), в 18 – при пограничных опухолях яичников и в 15 образцах ткани при доброкачественных опухолях яичников.
Прежде всего, стоит обратить внимание на результаты, касающиеся ВПЧ-18 позитивных образцов. Из 20 образцов ткани больных РЯ I-IV стадий, продукция онкобелка Е 7 отмечена у 14 пациенток (70,0%), при этом в большинстве случаев при ранних стадиях заболевания. Отсутствие онкопротеина отмечено лишь у 6 (30%) пациенток, ВПЧ+ по 18 серотипу, с распространенными стадиями заболевания. Что касается ДЭОЯ из 2 ВПЧ – 18 позитивных образцов ткани, ни в одном не было обнаружено синтеза онкобелка Е 7. При ПЭОЯ, из 8 ВПЧ – 18 позитивных проб, в 2 не было отмечено присутствие онкопротеина Е 7.
Можно предположить, что синтез онкобелка Е 7, начинающийся в клинической стадии, соответствующей предраковым изменениям, по мере прогрессирования заболевания имеет тенденцию к снижению.
Анализ образцов ткани яичников ВПЧ – негативных по 18 генотипу, у пациенток с ДЭОЯ (13 пациенток) и ПЭОЯ (10 пациенток), продемонстрировал отсутствие синтеза онкобелка Е 7 у 100% пациенток.
Таким образом, продукция вирусного белка Е 7 в тканях ЗЭОЯ, происхождение которого полностью связано с жизненным циклом интегративной формы вируса папилломы человека, наряду с ее отсутствием при доброкачественных процессах, является еще одним доказательством участия ВПЧ в канцерогенезе при раке яичников. Тот факт, что в ткани яичников имеет место продукция ВПЧ-18 Е 7 протеина при ЗЭОЯ и ПЭОЯ, позволяет нам рассматривать папилломавирусную инфекцию в качестве экзогенного ко-канцерогенного фактора овариального канцерогенеза. Все полученные нами результаты, с большой долей вероятности, позволяют предположить инициирующее влияние инфекционных агентов, таких как ВПЧ и ВЭБ, в канцерогенезе эпителиального РЭ, ведущее в совокупности с эндогенными модифицирующими факторами (гормональный, генетический и иммунный), к появлению злокачественной опухоли яичников.
Нами был проанализирован ИМТ и состояние баланса метаболитов эстрогенов при раке, пограничных и доброкачественных опухолях яичников.
Индекс массы тела исследован у 100 больных раком яичников, у 50 пациенток с наличием пограничных опухолей и 50 пациенток с наличием цистаденом яичников. Проанализированы так же результаты измерения уровня метаболитов эстрогенов у 80 больных раком яичников, 38 пациенток с пограничными и 46 пациенток с доброкачественными опухолями яичников.
При анализе полученных данных по подгруппам отмечается наибольшее количество пациенток с превышением массы тела среди больных раком яичников – 81,0%, из них ожирение имелось у 31,0% пациенток. При пограничных опухолях яичников данный показатель был выше нормы у 70,0% пациенток, а у женщин с наличием доброкачественных опухолей яичников – у 56,0%, в сравнении с группой контроля отмечаются выраженные различия в группах пациенток с нормальным ИМТ (р<0,05).
Были проанализированы средние уровни и соотношение метаболитов эстрогенов 2-ОНЕ1/16α-ОНЕ1 при различных опухолях яичников в сравнении с группой контроля для определения значимости дисбаланса соотношения 2- и 16α – гидроксипроизводных эстрогенов в процессах опухолеобразования в ткани яичников. (Табл. 7),
Таб. 7 Средний уровень соотношения метаболитов эстрогенов 2-ОНЕ1/16α-ОНЕ1 в зависимости от индекса массы тела при злокачественных, пограничных и доброкачественных опухолях яичников
ИМТ | ЗЭОЯ (N=80) | ПЭОЯ (N=38) | ДЭОЯ (N=46) | Контрольная группа (N=100) |
нормальный ИМТ 18,50-24,99 | 1,20±0,19 | 1,64±0,32 | 2,02±0,34 | 2,14±0,39 |
повышенный ИМТ 25,00-29,99 | 0,88±0,31* | 1,12±0,20 | 1,86±0,25 | 2,03±0,29 |
ожирение ИМТ >30,00 | 1,11±0,19* | 1,22±0,20 | 1,56±0,27 | 2,00±0,31 |
*р<0,05 в сравнении с группой контроля
В контрольной группе наблюдается некоторая, вполне объяснимая, тенденция к снижению соотношения метаболитов при увеличении ИМТ. При РЯ наиболее низкое соотношение выявлено при повышенном ИМТ (25,00-29,99). В группах ПЭОЯ и ДЭОЯ наибольшее снижение данного соотношения отмечено при ИМТ более 30,0, что коррелирует с показателями, полученными для группы контроля. Как при ожирении, так и среди пациенток с нормальным ИМТ, показатели коэффициента снижены не столь значительно. То же касается наблюдений при пограничных и доброкачественных опухолях яичников. Мы предполагаем, что это объясняется длительным бессимптомным течением опухолей яичников (70% выявляется при 3-4 стадиях заболевания), которое сопровождается такими симптомами как слабость, апатия, снижение аппетита и, как следствие, потеря массы тела. Таким образом, на момент установки диагноза, многие больные значительно теряют в весе.
Учитывая многообразие клинических и морфологических форм опухолей и вариантов течения рака яичников, нельзя не остановиться на других этиопатогенетических моментах. Многочисленные эпидемиологические исследования указывают, что на частоту рака яичников оказывают существенное влияние ряд репродуктивных факторов: длительность репродуктивного периода, число доношенных беременностей, длительность лактационного периода. Отмечено, что риск рака яичников снижается с каждой доношенной беременностью на 13-19% и возрастает при раннем менархе и позднем наступлении менопаузы, а также позднем возрасте первой беременности и при бесплодии. Все эти факторы приводят к увеличению количества овуляторных циклов у данной категории больных. Проведенный нами ретроспективный анализ анамнестических данных в группе больных раком яичников в сравнении с группой контроля подтверждает эти данные (Табл. 8).
Интегрируя фактор воспаления, сопровождающий каждую овуляцию, с целым рядом молекулярно-биологических и тканевых перестроек можно с определенной достоверностью описать вероятную модель канцерогенеза при спорадическом раке яичников. Локальное повреждение эпителия яичников на фоне овуляции сопровождается воспалением и сопутствующими изменениями, предрасполагающими клетки поверхностного эпителия к генетическим повреждениям и злокачественной трансформации. Свободные радикалы могут прямо или опосредованно реагировать с ДНК эпителиальных и стромальных клеток и вызывать различные генетические и эпигенетические нарушения ее молекулярной структуры.
Таб. 8 Сравнительная характеристика длительности репродуктивного периода, возраста менархе и менопаузы, репродуктивной функции, длительности лактации, частота бесплодия и приема КОК в группе больных раком яичников и в контрольной группе
Группы пациен - ток | Возраст менархе | Возраст мено-паузы | Число беремен-ностей | Число родов | Дли-тель-ность лакта- ции | Часто- та беспло- дия | Частота примене- ния оральных контра- цептивов | Длитель-ность репродук-тивного периода |
Рак яичников (N=100) | 10,3±0,9 лет | 51,3±1,3 лет | 3,8±0,9 | 1,3±0,6 | 0,4±0,1 лет | 7,0± 0,3% | 4,0±0,4% | 40,6±2,8 лет |
Группа контроля (N=100) | 12,3±1,2 лет | 49,2±1,2 лет | 5,3±0.5 | 2,9±0,8 | 1,0±0,2 лет | 2,0± 0,4% | 12,0±1,4% | 36,2±1,8 лет |
р<0,05

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 |



