Тема – 4: Способность атомов образовывать молекулы. Ковалентная связь. Водородная связь. Металлическая связь. Ионная связь.
Студент должен:
Знать:
· Виды химической связи.
· Донорно-акцептарный механизм.
Уметь:
· Определять характер химической связи в различных соединениях и степень окисления элемента.
· Составлять структурные формулы молекулярных соединений.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
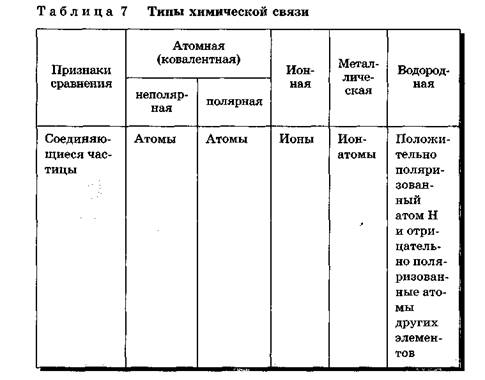
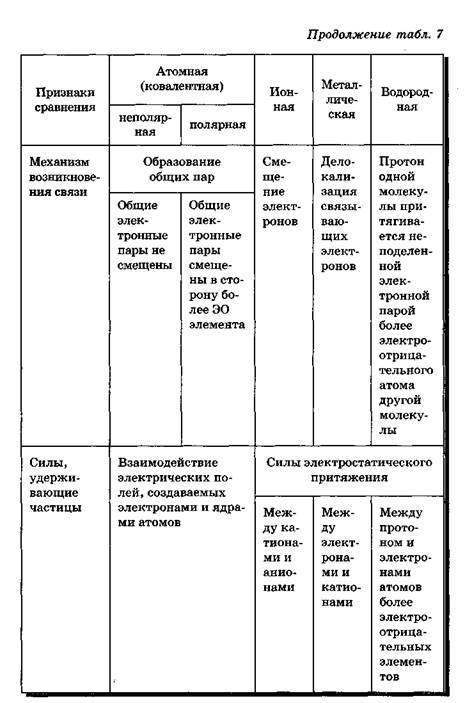
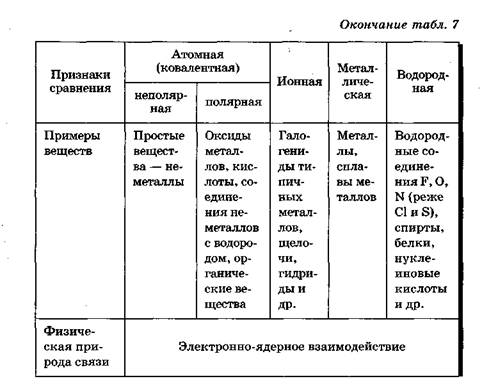
Различают четыре типа химических связей:
1. ионную
2. ковалентную
3. металлическую
4. водородную.
4.1. Металлическая связь
Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке, называют I металлической.
Такая связь ненаправленная, ненасыщенная, характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей, что характерно для атомов металлов.
Схема образования металлической связи (М — металл):
М° - пе ↔ Мп+
Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск. Вещества с металлической связью имеют металлическую кристаллическую решетку. В ее узлах находятся ионы или атомы металла, между которыми свободно (в пределах кристалла) перемещаются электроны («электронный газ»).
4.2. Водородная связь
Химическую связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары (F, О, N и реже С1 и S) другой молекулы (или ее части), называют водородной.
Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер. Примеры межмолекулярной водородной связи:
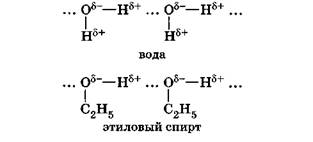
При наличии такой связи даже низкомолекулярные вещества могут быть при обычных условиях жидкостями (спирт, вода) или легко сжижающимися газами (аммиак, фтороводород).
В биополимерах — белках (вторичная структура) имеется внутримолекулярная водородная связь между карбонильным кислородом и водородом аминогруппы:
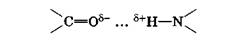
Молекулы полинуклеотидов — ДНК (дезоксирибонуклеиновая кислота) представляют собой двойные спирали, в которых две цепи нуклеотидов связаны друг с другом водородными связями. При этом действует принцип комплементарноети, то есть эти связи образуются между определенными парами, состоящими из пуринового и пиримидинового оснований: против аденинового нуклеотида (А) располагается тиминовый (Т), а против гуанинового (Г) — цитозиновый (Ц).
Вещества с водородной связью имеют молекулярные кристаллические решетки.
3.5. Единая природа химической связи
Деление химических связей на типы носит условный характер, так как все они характеризуются определенным единством.
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи.
Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
В веществах часто отсутствуют предельные случаи химической связи (или «чистые» химические связи).
Например, фторид лития LiF относят к ионным соединениям. Фактически же в нем связь на 80% ионная и на 20% ковалентная. Правильнее поэтому, очевидно, говорить о степени полярности (ионности) химической связи.
В ряду галогеноводородов HF — НС1 — HBr — HI — HAt степень полярности связи уменьшается, ибо уменьшается разность в значениях электроотрицательности атомов галогена и водорода, и в астатоводороде связь становится почти неполярной (ЭО(Н) = 2,1; 30(At) = 2,2).
Различные типы связей могут содержаться в одних и тех же веществах, например:
1) в основаниях — между атомами кислорода и водорода в гидроксогруппах связь ковалентная полярная, а между металлом и гидроксогруппой — ионная;
2) в солях кислородсодержащих кислот — между атомами неметалла и кислородом кислотного остатка — ковалентная полярная, а между металлом и кислотным остатком — ионная;
3) в солях аммония, метиламмония и т. д. — между атомами азота и водорода — ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком — ионная;
4) в пероксидах металлов (например, Na202) — связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом — ионная и т. д.
Различные типы связей могут переходить одна в другую:
• при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь переходит в ионную;
• при испарении металлов металлическая связь превращается в ковалентную неполярную и т. д.
Причиной единства всех типов и видов химических связей служит их одинаковая физическая природа — электронно-ядерное взаимодействие. Образование химической связи в любом случае представляет собой результат электронно-ядерного взаимодействия атомов, сопровождающегося выделением энергии (табл. 7).
Вопросы для самостоятельной подготовки:
1. Определить тип химической связи и рассмотрите схемы ее образования в веществах, имеющих формулы: Ca, CaF2, F2, OF2.
2. Напишите структурные формулы веществ: CO, CaC2, CS2, FeS2. Определите степени окисления элементов и их валентности в этих веществах.