У всех (n=134) больных РПЖ проведено изучение изменения качества жизни при различных методах лечения. Качество жизни оценивалось по стандартному вопроснику EORTC QLQ-C 30. Вопросник состоит из 30 вопросов. Первые 28 вопросов касаются различных аспектов жизни больного. Это вопросы, касающиеся повседневной физической активности больных, их социальной и трудовой адаптации, вопросы, связанные с психическим здоровьем больного, отдельными часто встречающимися жалобами и другие. Ответ оценивается по 4-балльной системе (1– нет, 4 – очень сильно). В последних двух вопросах больной оценивает свое качество жизни в целом (1 – очень плохое качество жизни и здоровья, 7 – отличное).
Производилась оценка качества мочеиспускания по Международной системе суммарной оценки заболеваний простаты в баллах (IPSS). В данной системе больному предлагается ответить на 7 вопросов, касающихся различных нарушений мочеиспускания. Ответы оцениваются по 5-балльной системе (0 – нет, 5 – почти всегда). В последнем 8 вопросе больному предлагается оценить свое качество мочеиспускания в целом (0 – очень хорошее, 6 – очень плохое). Вследствие этого ответ по данному вопроснику выглядит как сумма двух чисел.
Отдельно выделена группа с радикальной простатэктомией (23 случая). В этой группе проводилась комплексная морфологическая диагностика. Всем больным перед простатэктомией выполнялась мультифокальная биопсия предстательной железы под УЗИ контролем. 18 больным биопсия бралась из 12 точек, 3 больным – из 8 точек, 2 больным из 18 точек.
Изучение выполнено по схеме, которая включала макроскопический анализ, вырезку материала, гистологическое изучение. Для гистологического исследования из операционного материала вырезали кусочки, которые маркировали и затем фиксировали в 10%-ном растворе формалина, забуфференном по Лилли при рН-7,4, затем заливали в парафин по обычной методике. Серийные срезы толщиной 3-5 мкм депарафинировали по стандартной схеме, затем окрашивали гематоксилином и эозином. Образцы просматривали и фотографировали в световом микроскопе «TOPIC-T» CETI (Нидерданды).
Для иммуногистохимических исследований материал фиксировали в 10%-ном забуференном формалине, заливали в парафин, готовили серийные срезы толщиной 4-5 мкм. Срезы депарафинировали по стандартной схеме. Иммуногистохимическое исследование проведено с применением антител фирмы «Дако» (Дания). Использованы следующие маркеры: антитела моноклональные кроличьи к человеческим AMACR (Р504S), клон 13Н4, FLEXRTU, антитела мноклональные мышиные к человеческим, цитокератин, клон 34ßЕ12, FLEXRTU, антитела поликлональные кроличьи к человеческим, простат-специфический антиген. FLEX RTU, антитела моноклональные мышиные к человеческим р63, протеин, клон 4А4, антитела моноклональные мышиные к человеческим Ki67 антиген, клон MIB-1, FLEXRTU.
Для сканирующей электронной микроскопии изучаемые кусочки помещали в фиксирующую смесь (37оС) из 2% глутаральдегида на 0,15 М фосфатном буфере с pH 7,2–7,4. В фиксирующей смеси пробы держали в холодильнике (от 2 суток до 1 месяца). Затем пробы просматривали под растровым микроскопом FE1 Quanta 200 3D (Нидерланды-Чехия). Определяли следующие макро - и микроэлементы; углерод, кислород, калий, кальций, натрий, магний, фосфор, серу, железо, азот. Нами было изучено распределение микроэлементов на поверхности образца, полученного путем операционной биопсии при удалении опухолевого узла.
Данный метод позволяет получить график пространственного распределения химических элементов по поверхности образца, а также отобрать диагностически важные микроэлементы. При этом с образца, предварительно фиксированного раствором глутаральдегида, в криостате были сделаны срезы 4-5 мм толщиной. Полученные срезы помещали в камеру растрового электронного микроскопа. По умолчанию исследования образцов проводились в режиме HichVac. В случаях, когда это не удавалось (образец быстро заряжался под действием электронного пучка), исследования проводились в режиме LowVac, а затем осуществлялся перерасчет результатов количественного элементного анализа. Суть метода заключается в том, что на поверхность выбранной зоны исследования наносилась координатная сетка, а затем проводился элементный анализ в заранее заданных точках. Таким образом, выявлено достаточно информации об элементном составе образцов для того, чтобы построить графики пространственного распределения микроэлементов.
Для зондовой сканирующей микроскопии после предварительного просмотра срезов в световой микроскоп выбирали необходимые парафиновые блоки. После целевого просмотра проводили съемку и морфометрический анализ. Зондовая сканирующая микроскопия проведена на сканирующем зондовом микроскопе «Ntegra-Aura». Исследования проводили в режимах постоянного или прерывистого контакта на приборе «Ntegra-Aura» (Компания НТ-МДТ, г. Зеленоград, Россия) с использованием коммерческих Si или SiN кантилеверов (NSG01, NT-MDT, Россия) в условиях атмосферы и низкого вакуума. В качестве подложек использовали слюду (мусковит) или высокоориентированный пиролитический графит (пирографит) для исследования поверхности свежего скола. Обработку и построение АСМ-изображений проводили при помощи программного обеспечения «NOVA» (НТ-МДТ, Россия) и «ImageAnalysis» (НТ-МДТ, Россия). Использовалась программа построения линий уровня OriginPro 6.1.
Полученные данные обрабатывали методом вариационной статистики с использованием величины критерия t по Стьюденту, а также непараметрическим методом Вилконсон – Мани-Уитни. Статистически значимым считались различия при p<0,05.
Результаты исследования
Проведенный анализ показал, что заболеваемость в Белгородской области за последние 10 лет прогрессивно увеличивается, составляя при этом в 1999 г. 14,3 на 100 тысяч населения, а в 2010 – 43,2. Смертность также имеет тенденцию к росту (с 6,3 до 15,8 на 100 тысяч населения). Пятилетняя выживаемость возросла с 20,7 до 23,9 на 100 тысяч населения. Индекс накопления возрос с 2,0 до 3,2. Следовательно, происходит непрерывный рост заболеваемости РПЖ.
В нашем исследовании гормонотерапия и лучевая терапия, трансуретральная резекция были проведены больным с II–IV стадиями. Радикальная простатэктомия выполнена соответственно: в I стадии – 2 больным, во II стадии – 13 больным, в III стадии – 6 больным, в IV стадии – 2 больным.
Показано, что в группе «гормональная терапия» было наибольшее число больных с III и IV стадиями болезни, в группе «радикальная простатэктомия» преобладали больные с I и II стадиями болезни. Выявлено, что наибольшее число больных было с умеренно дифференцированной аденокарциномой (табл. 2).
Таблица 2
Распределение больных в группах по методам терапии в зависимости от стадии болезни (n/%)
Стадия болезни Метод лечения | Гормонотерапия | Гормонотерпия+лучевая терапия | Гормонотерапия+лучевая терапия+ТУР | Радикальная простатэктомия | Всего |
I | 2/9% | 2/1% | |||
II | 4/9% | 9/26% | 11/35% | 13/56% | 37/28% |
III | 28/62% | 13/37% | 15/49% | 6/26% | 62/46% |
IV | 13/29% | 13/37% | 5/16% | 2/9% | 33/25% |
Итого | 45/100% | 35/100% | 31/100% | 23/100% | 134/100% |
Поскольку изучение морфологических критериев диагностики весьма актуально, мы исследовали прогностические факторы при РПЖ. Показано, что для него характерна прогрессирующая дифференцировка ткани с образованием рудиментарных желез или плотных тяжей, состоящих из опухолевых клеток, появление ацинусов, варьирующих по конфигурации и размерам, наличие папиллярных и фиброзных структур (рис. 1, 2). При изучении клеточного атипизма с применением мультифокальной биопсии мы выявили изменения, характеризующие архитектонику опухолевых ацинусов: наличием в фиброзно-мышечной строме желез с измененной формой, присутствие инвазивного роста и базального слоя в малигнизированных ацинусах, полиморфизм клеток, как по форме, так и по величине, укрупнение ядер и их полиморфизм, имеющих часто изрезанные контуры, увеличение ядерно-цитоплазматических взаимоотношений в пользу ядра, появление крупных ядрышек. Помимо этого, наблюдались многоядерные структуры. Содержимое просветов ацинусов изменялось. В наших исследованиях при аденокарциноме простаты сумма баллов по Глисону составила 7 ±2.
В группу «простатэктомия» вошли 23 человека. Все больные T3N0M0 получали адъювантную лучевую терапию на ложе простаты. В группе T2N0M0 адъювантное лечение не проводилось, осуществлялось в случае прогрессирования болезни у 4-х сроках от 6 до 12 месяцев. В группе T2N1M0 назначали адъювантную гормональную терапию (Золадекс, Касодекс). Прогрессирование болезни при 2-х летнем сроке наблюдения выявлено у 4 человек, все больные живы. В данной группе безрецидивная выживаемость составила 81%, общая и опухоль-специфическая выживаемость 100%. Из больных с прогрессированием болезни 2 имели II стадию болезни, 1 – III стадию, 1– IV стадию. Прогрессирование болезни устанавливалось на основании повышения уровня ПСА (3 больных), появления метастазов в тазовых костях (1больной). После прогрессирования 2 больным была назначена лучевая терапия на ложе простаты, 2 - гормональная терапия. Ниже приведена сводная таблица по прогрессированию РПЖ после радикальной простатэктомии (табл. 3).
Таблица 3
Прогрессирование болезни после радикальной простатэктомии
Стадия болезни по ТNM | Число больных общее | Число больных с прогрессией болезни | Число больных без прогрессии болезни |
T2 N0M0 | 15 | 2 | 13 |
T2N1M0 | 2 | 1 | 1 |
T3N0M0 | 6 | 1 | 5 |
При изучении РПЖ при помощи сканирующей микроскопии наблюдали во всех случаях деформированные железы с ветвистыми структурами, от которых отходили образования в виде сосочков, сформированные атипичными полиморфными клетками со слабыми связями между ними. Хорошо видна слабая связь между клетками, что не определяется на уровне световой микроскопии, что свидетельствует о возможности метастазирования (рис. 1).
Показано, что при прогрессии болезни чаще встречаются контакты между клетками величиной 0,5 µm, которые могут доходить до 3–4 µm, превышая при этом размеры клеток. Помимо этого, увеличивается число клонов опухолевых клеток на эндотелии сосудов.
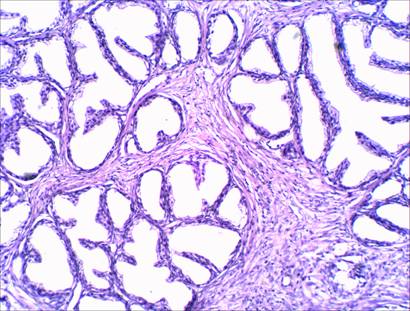
Рис. 1. Ткань предстательной железы с наличием в фиброзно-мышечной строме желез с измененной формой. Отмечается пролиферация эпителиоцитов с формированием папиллярных структур, которые выступают в просвет фолликула.
Окраска гематоксилином и эозином. Ув. х 200.
Это подтверждает постулат автономности опухолевого роста с утратой контактного торможения при опухолевой прогрессии. Поверхность опухолевых клеток при РПЖ отличается увеличенной складчатостью, появлением микровыростов и микроворсинок (рис. 1, 2). Выявлена неплотная связь между опухолевыми клетками, которые способствуют образованию опухолевого эмбола. Показано, чем меньше размер клеток, тем теснее они были связаны между собой за счет клеточных контактов. Четко прослеживалось прорастание капсулы органа.
Б А


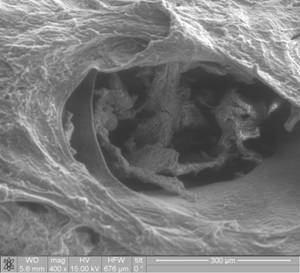

Рис. 2. Ткань предстательной железы с наличием в фиброзно-мышечной строме желез с измененной формой. А. Отмечается пролиферация эпителиоцитов с формированием папиллярных структур (указано стрелкой). Б. На поверхности опухолевой клетки – микроворсинки (указано стрелкой). РЭМ. Рис. А. Ув. х400. Рис. Б. Ув. х16000.

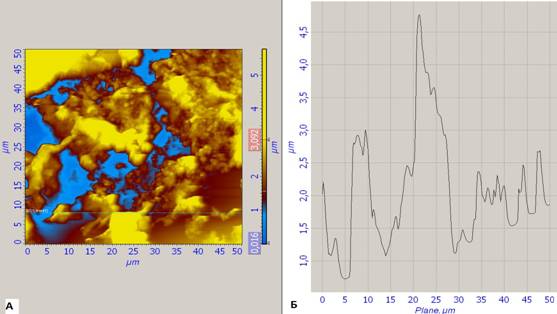
Рис. 3. Ткань предстательной железы с наличием желез с измененной формой. Отмечается пролиферация эпителиоцитов с формированием папиллярных структур (указано стрелкой). Клетки рыхло соединены между собой.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 |




