Бактериальный гнойный менингит с ациклическим течением – тяжелые, осложненные, включающие летальный исход, формы заболевания, которые характеризуются длительным и/или волнообразным затяжным течением, с развитием ранних и поздних церебральных и экстрацеребральных осложнений. При ациклическом течении заболевания разрешение его основных синдромов, в том числе восстановление сознания, основных витальных функций, разрешение неврологического дефицита, наступают значительно позднее, ликвор санируется медленно и/или волнообразно, с рецидивами нейтрофильного плеоцитоза. Длительность стационарного лечения больных этой категории, как правило, превышает 1,5 месяца. Состояние выживших больных длительное время характеризуется различной степени выраженности остаточными неврологическими нарушениями, нередко стойкими, проявлениями астено-вегетативных нарушений, угнетением психо-эмоциональной сферы, что зачастую не позволяет вернуться к исполнению обычных профессиональных обязанностей, прежде всего предусматривающих операторскую и/или аналитическую деятельность в течение нескольких месяцев и даже лет.
Именно ациклическое течение бактериальных гнойных менингитов у детей в возрасте 5 лет и младше, а также у пожилых пациентов в возрасте старше 55 лет может в 1/3 случаев заканчиваться необратимыми психо-неврологическими последствиями и инвалидностью.

Окончательный диагноз формулировали на основании клинико-лабораторных проявлений ведущих синдромов бактериального гнойного менингита – общеинфекционной интоксикации, инфекционно-токсической энцефалопатии, менингеального синдрома, реже – синдрома энцефалита, а также воспалительных изменений ликвора, в том числе осложнений основного заболевания, фоновых и сопутствующих заболеваний. Алгоритм физикального, а также инструментального, лабораторного общеклинического, биохимического и этиологического обследования больных, виды и объем исследований как при подозрении, так и при подтвержденном диагнозе «Менингит» соответствовали действующим нормативным актам, в том числе Приказу МЗ РФ № 000 от 01.01.2001 г. «О мерах по усилению эпидемиологического надзора и профилактики менингококковой инфекции и гнойных бактериальных менингитов», распоряжениям Комитета по здравоохранению Правительства Санкт-Петербурга, а также внутренним стандартам больницы и соответствовали имеющимся у стационара лицензиям. Все больные получали комплексное лечение в видах и объеме, предусмотренных перечисленными нормативными актами до определившегося исхода заболевания.
При выполнении исследования были использованы специальные, в том числе разработанные авторские лабораторные методы и методики обследования больных и патоморфологических исследований:
1. Методика определения и количественной оценки десквамированных эндотелиоцитов (ДЭ) в ликворе больных бактериальными гнойными менингитами.
С помощью этой методики, впервые примененной в клинической практике, прижизненно, в динамике бактериальных гнойных менингитов различной этиологии было определено количество десквамированных эндотелиоцитов в 100 мкл ликвора больных. За основу была взята авторская [Hladovec J. et al., 1978 г.] методика определения десквамированных эндотелиоцитов в крови, в модификации [ и соавт., 2001 г.], ранее адаптированная нами для исследования ликвора больных менингитами различной этиологии. При выполнении клинической части исследования использовался метод окраски мазка ликвора гематоксилином. Количество ДЭ делилось на коэффициент пересчета К=1,2, рассчитанный ранее с учетом опубликованных результатов сравнения количества искомых клеток в мазках ликвора, окрашенных с использованием иммуногистохимического метода ИГХ-окрашенных мазках с количеством ДЭ в мазках тех же проб ликвора, окрашенных гематоксилином.
2. Метод расчета коэффициента снижения количества десквамированных эндотелиоцитов в ликворе больных бактериальными гнойными менингитами.
Определение количества десквамированных эндотелиоцитов в ликворе осуществлялось по изложенной выше методике. Оценивалось количество искомых клеток в ликворе, полученном при диагностической люмбальной пункции (ДЭ1), а также при контрольной люмбальной пункции на 7-10 сутки стационарного лечения (ДЭ2). Величина коэффициента рассчитывалась арифметически по формуле: коэффициент снижения = ДЭ1/ДЭ2., рассчитывалась в абсолютном значении и в %.
3. Метод и методика определения морфологического индекса церебральных микроваскулярных нарушений (МИ ЦМВН).
Для решения задач настоящего исследования впервые была разработана и использована методика определения морфологического индекса церебральных микроваскулярных нарушений, позволяющая полуколичественно (в баллах) оценить выраженность церебральных микрососудистых нарушений в ткани коры головного мозга умерших больных бактериальными гнойными менингитами различной этиологии.
Образцы ткани коры головного мозга предварительно фиксировались в 10% растворе формалина, проводились через восходящие спирты по стандартной методике и заливались парафином с последующим изготовлением гистологических срезов толщиной 4–5 мкм. Использовались методы окраски: гематоксилином и эозином, пикрофуксином по Ван-Гизону с докраской на эластические волокна. Оценивалось состояние терминальных артериол в I-V слоях коры больших полушарий. В подсчет вовлекались не менее 10 пересеченных сосудов и не менее чем в 3-х микропрепаратах. Гистологические препараты исследовались с использованием светового микроскопа «Leica» при увеличении х400 (окуляр х10, объектив х40). С использованием бальной шкалы (от 0 до 3 баллов) оценивались наличие и выраженность (частота выявления) пяти морфологических критериев (признаков):
1 – спазма или пареза сосудов;
2 – десквамации эндотелия сосуда;
3 – периваскулярных кровоизлияний;
4 – тромбоза микрососудов;
5 – периваскулярной нейтрофильной инфильтрации.
Алгоритм и методика оценки перечисленных критериев состояла в следующем:
Признаками пареза сосуда являлись значительное увеличение диаметра сосуда, заполненного эритроцитами и другими форменными элементами крови с истончением его стенки, а также «разрежением» эндотелиальной выстилки. Спазм сосуда констатировался при уменьшении диаметра сосуда, неровности внутренней его поверхности, наличия «частокола» эндотелиоцитов, увеличения извитости внутренней эластической мембраны, а также при некотором утолщении слоя гладкомышечных клеток. Выраженность десквамации эндотелия определялась по факту отсутствия эндотелиальной выстилки сосудов. Периваскулярные кровоизлияния оценивались по факту обнаружения эктравазально расположенных скоплений эритроцитов. Тромбоз микрососудов оценивался по факту обнаружения тромботических масс в их просвете. Периваскулярная нейтрофильная инфильтрация оценивалась по факту наличия более 3 сегментоядерных нейтрофилов, расположенных паравазально.
Отсутствие признаков анализируемого критерия оценивалось в 0 баллов, при наличии признаков в 30% микрососудов – в 1 балл, в 60% микрососудов – в 2 балла, а более чем в 60% сосудов – в 3 балла.
Величина МИ ЦМВН определялась суммированием полученных баллов. Результаты определения суммарной величины МИ ЦМВН в ткани коры головного мозга умерших больных бактериальными гнойными менингитами и группы контроля внесены в матрицу общей базы данных для последующей математико-статистической обработки.
4. Метод и методика иммуногистохимического исследования ткани коры головного мозга умерших больных бактериальными гнойными менингитами различной этиологии для выявления клеток, экспрессирующих антигены вирусов простого герпеса HSV-I/II и определения их количества.
Впервые было выполнено определение количества клеток коры головного мозга, экспрессирующих антигены вирусов герпеса HSV-I/II у умерших больных бактериальными гнойными менингитами менингококковой и пневмококковой этиологии, а также бактериальными гнойными менингитами с неустановленной этиологией с различной длительностью заболевания. Суть метода заключалась в выполнении иммуногистохимического исследования ткани головного мозга с использованием экспертной (референс) тест-системы, содержащей готовые к использованию (RTU) кроличьи поликлональные антитела к вирусу простого герпеса I и II типов (HSV-I/II) производства BioSistems, USA, и универсальной иммуногистохимической системы визуализации EnVision+DAB, производства DAKO, USA. Для учета результатов использовались зоны иммуногистохимического препарата, в которых экспрессия антигенов HSV-I/II была наиболее выражена.
Определено процентное содержание HSV-I/II – позитивных клеток в срезе ткани головного мозга в I-V слоях коры больших полушарий не менее чем в 3 полях зрения, с условием содержания в полях зрения не менее 100 клеток. Отдельно вычислялось процентное содержание HSV-I/II-позитивных нейроцитов, процентное содержанием HSV-I/II-позитивных клеток глии и эндотелоцитов, а также процентное общее содержание HSV-I/II-позитивных клеток в поле зрения.
Результат подсчета HSV-I/II-позитивных клеток осуществлен исходя из отношения фактического количества HSV-I/II-позитивных клеток к 100 визуализированным клеткам и отражен в %. Данные внесены в матрицу общей базы данных для последующей математико-статистической обработки.
При выполнении клинической части исследования весь объем данных на каждого больного бактериальным гнойным менингитом объединялись в формализованную матрицу, включившую 84 признака, в числе которых было 48 количественных и 36 качественных и ранговых признаков, составивших общую базу данных. Виды и общее количество выполненных исследований представлены в табл. 2.
Таблица 2
Количество и характеристика исследованных показателей у больных бактериальными гнойными менингитами, n=150
Параметры | Количество исследуемых показателей у 1 больного | Число исследований |
Качественные и ранговые анамнестические и клинические критерии | 36 | 11232 |
Количественные клинические и лабораторные критерии, в т. ч.: - стандартные исследования ликвора - стандартные исследования гемограммы - определение количества ДЭ в ликворе - расчет МИ ЦМВН в ткани коры ГМ - определение количества HSV-I/II позитивных клеток в коре ГМ | 45 5 3 1 1 1 | 4430 3120 818 389 53 53 |
ВСЕГО | 84 | 15662 |
5. Экспериментальное моделирование пневмококкового менингита с естественным течением заболевания, использованные методики.
При планировании эксперимента учтены известные данные о наибольшей тяжести поражений центральной нервной системы именно при пневмококковых менингитах [ и соавт., 2003; и соавт., 2003; и соавт., 2005; и соавт., 2007; Hussein A. S. et al., 2000; Weisfelt M. et al., 2006].
Для зучения выраженности процессов свободно-радикального окисления и антиоксидантной защиты в ткани головного мозга в периоде разгара бактериального гнойного менингита (первые 48-72 часа заболевания), а также оценки выраженности церебральных микроваскулярных нарушений в коре головного мозга было выполнено экспериментальное моделирование пневмококкового менингита на 108 белых беспородных мышах, самцах, весом 10-14 г, из которых на 24 мышах были выполнены предварительные исследования по отработке дозы заражающей микробной взвеси Str. pneumoniae и путей ее введения, 68 мышей составили 3 основных экспериментальных группы с длительностью заболевания 24 часа, 48 часов и 64-72 часа и 16 мышей - контрольную группу.
За основу эксперимента были взяты методики экспериментального моделирования пневмококкового менингита, выполненного ранее , 1993.
В качестве заражающего агента использовалась культура Str. рneumoniae I серовара, полученная из ликвора 13-летней девочки, больной пневмококковым менингитом с летальным исходом заболевания, находившейся на лечении в клинике нейроинфекций ФГУ «НИИДИ ФМБА России», Санкт-Петербург. Использованный штамм обладал выраженными инвазивными свойствами, что было подтверждено высоким титром антигиалуронидазной активности – 1/32 у. е., определенной по методу МакКлина в модификации , 1993, наличием у возбудителя выраженных капсульных свойств, подтвержденных методом ИФА и в реакции непрямой иммунофлюоресценции (РНИФ) с использованием Omni-сыворотки производства НИИ вакцин и сывороток им. (Москва), а также высокой гемолитической активностью – титр пневмолизина составил 1/64.
Оценка выраженности процессов свободно-радикального окисления осуществлена с определением изменения тканевой концентрации малонового диальдегида, а активности системы антиоксидантной защиты – тканевой концентрации восстановленного глутатиона и активности фермента глюкоза-6-фосфат-дегидрогеназы [ и соавт, 1997; , 1997; и соавт., 1999; и соавт., 2008]. Были использованы следующие биохимические методики:
5.1. Определение концентрации восстановленного глутатиона в гомогенате ткани головного мозга по методике G. L.Ellman et al., 1959 в модификации и соавт., 1997. Концентрацию восстановленного глутатиона выражали в мкмоль/г ткани.
5.2. Определения активности глюкозо-6-фосфатдегидрогеназы в гомогенате ткани головного мозга по методике G. L.Ellman et al., 1959, в модификации и соавт., 1997. Активность Г-6ф-ДГ выражали в мкмоль/(мин·г ткани).
5.3. Методика определения концентрации малонового диальдегида в гомогенате ткани головного мозга по методике Uchiyama M. еt al., 1978 в модификации и соавт., 1990 г. Концентрацию малонового диальдегида выражали в нмоль/г ткани.
Кроме перечисленных 3 биохимических показателей были изучены масса головного мозга экспериментальных животных (в мкг) и величина МИ ЦМВН (в баллах). Всего при выполнении экспериментальной части исследования были изучены 5 показателей с общим числом исследований 420.
Статистическая обработка данных проводилась в соответствии с рекомендациями по обработке результатов медико-биологических исследований [, 1988; и соавт., 1998; , 2003; и соавт., 2005]. В исследовании использовались пакеты прикладных программ: SPSS 18, OpenEpi 2.2.1, Statistica for Windows 8.0 - для статистического анализа, Microsoft Office 2003 – для организации и формирования матрицы данных, подготовки графиков и диаграмм. Описание количественных показателей выполнено с помощью среднего арифметического значения и стандартного отклонения (![]() ), а для показателей, эмпирический закон распределения которых достоверно отличался от закона нормального распределения, использована медиана и интерквартильный размах Me[Q25%;Q75%].
), а для показателей, эмпирический закон распределения которых достоверно отличался от закона нормального распределения, использована медиана и интерквартильный размах Me[Q25%;Q75%].
В ходе исследования применялись следующие процедуры и методы математико-статистической обработки: определение числовых характеристик переменных; оценка соответствия эмпирического закона распределения количественных переменных теоретическому закону нормального распределения по критерию Шапиро-Уилка; оценка значимости различий средних значений количественных показателей в независимых выборках по T-тесту Стьюдента; для переменных, распределение которых достоверно отличалось от закона нормального распределения, использовался U‑критерий Манна-Уитни (Mann-Whitney U Test); построение таблиц сопряжённости наблюдаемых и ожидаемых частот; критерий Хи-квадрат Пирсона (Pearson Chi-square), а при его неустойчивости использовался двусторонний точный тест Фишера (Fisher exact test); метод множественных сравнений в рамках дисперсионного анализа с использованием LSD Test; дисперсионный ранговый метод ANOVA Kruskal-Wallis H-test; коэффициента корреляции Пирсона R; коэффициент корреляции ρ Спирмена (Spearman R); метод построения таблиц сопряженности признаков с последующим расчетом абсолютного риска, отношения шансов (ОШ) и 95% доверительного интервала ОШ; ROC-анализ путем построения характеристических кривых и площади под ними.
Для создания уравнения математической модели раннего прогнозирования циклического и ациклического вариантов течения бактериальных гнойных менингитов был использован метод логистического регрессионного анализа, а для удобства практического использования модели был создан вероятностный калькулятор расчета на базе табличного редактора MS Excel в составе пакета программ MS Office 2003.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Особенности многолетней ( гг.) динамики регистрации бактериальных гнойных менингитов у взрослого населения Санкт-Петербурга, их этиологической структуры и летальности.
Объединенные данные по числу зарегистрированных случаев бактериальных гнойных менингитов и их этиологическая структура за период с 1979 по 2008 гг. представлены в табл. 3.
Таблица 3
Количество случаев и этиологическая структура бактериальных гнойных менингитов взрослого населения Санкт-Петербурга за период гг.
(по материалам ГКИБ №30 им. )
Периоды, годы | Всего случаев | Заболевания с установленной этиологией | БГМ Н/У**** (абс./ %) | |||
Всего (абс./ %) | *МкМ (абс./ %) | **ПкМ (абс./ %) | ***Прочие (абс./ %) | |||
1179 | 615 / 52 | 461 /75 | 116/ 19 | 38 / 6 | 564 / 48 | |
972 | 566/ 58 | 435 / 77 | 113 / 20 | 18 / 3 | 416 / 42 | |
557 | 340/ 61 | 255/ 75 | 61/ 21 | 14/ 4 | 217 / 39 | |
ВСЕГО | 2708 | 1521/ 56 | 1151/ 76 | 290 / 20 | 70/ 4 | 1197/ 44 |
*- все случаи генерализованных форм менингококковой инфекции (менингит +/- менингококкемия), в том числе менингококковый менингит (МкМ); **- % от числа заболеваний с установленной этиологией, в том числе пневмококковых менингитов (ПкМ); ***- преимущественно St. aureus и L. monocytogenes; ****- бактериальные гнойные менингиты с неустановленной этиологией (БГМ Н/У) |
Этиологию заболеваний устанавливали на основании выделения культуры возбудителя из посевов ликвора и, в единичных случаях – венозной крови больных, на питательные среды. При менингококковой природе менингитов в ряде случаев диагноз выставлялся на основании сочетания клинико-лабораторных признаков менингита и типичных патогномоничных проявлений менингококкемии, что предусмотрено Приказом МЗ РФ № 000 от 01.01.2001 г. «О мерах по усилению эпидемиологического надзора и профилактики менингококковой инфекции и гнойных бактериальных менингитов».
Многолетняя динамика регистрации спорадических случаев бактериальных гнойных менингитов различной этиологии у взрослых в Санкт-Петербурге отображена на рис. 1.
|
|
|
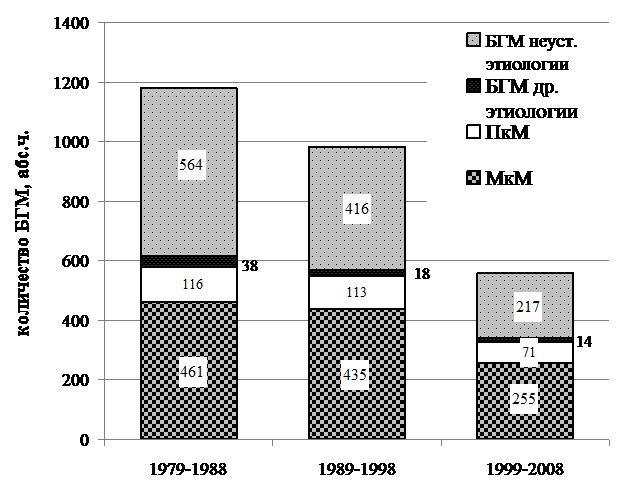
Рис. 1. Динамика регистрации спорадических бактериальных гнойных менингитов (БГМ) различной этиологии в Санкт-Петербурге в гг. (по материалам СПБ ГУЗ «Городская клиническая инфекционная больница №30 им. »).
При сравнении показателей трех 10-летних периодов 1979–2008 гг., отмечена устойчивая динамика снижения количества регистрируемых случаев генерализованных форм менингококковой инфекции, в том числе менингитов в 1,8 раза, пневмококковых менингитов – в 1,6 раза, а также бактериальных гнойных менингитов с неустановленной этиологией в 2,6 раза, при этом общее количество ежегодно регистрируемых случаев бактериальных гнойных менингитов снизилось более чем в 2 раза.
В прошлые 10-летние периоды и в период гг. продолжает оставаться значительной доля бактериальных гнойных менингитов с неустановленной этиологией заболевания, хотя и отмечено ее уменьшение с 48% в периоде гг. до 39% в периоде гг.
Анализ летальности при менингококковых и пневмококковых менингитах, бактериальных гнойных менингитах с неустановленной этиологией и в общей структуре всех больных бактериальными гнойными менингитами осуществлен с учетом 2 значимых факторов:
– значительными различиями реестров антибактериальных препаратов, используемых в СПБ ГУЗ «Городская клиническая инфекционная больница №30 им. » для этиотропной терапии этих заболеваний, в периоды гг. и гг.;
– значительными различиями в оснащенности отделения реанимации и интенсивной терапии СПБ ГУЗ «Городская клиническая инфекционная больница №30 им. » современной аппаратурой для искусственной вентиляции легких, мониторинга функций больных и возможностями респираторной поддержки в частности и интенсивного лечения – в целом, в периоды гг. и гг.
С учетом этих факторов были проанализированы показатели регистрации случаев бактериальных гнойных менингитов различной этиологии и летальность в группах больных двух 10-летних периодов – гг. и гг. (табл. 4).
Таблица 4
Летальность при бактериальных гнойных менингитах (БГМ) различной этиологии в гг. и гг.
Летальность | 1гг. | 1999 – 2008 гг. |
Летальность при всех БГМ | Из 1179 погибли %) | Из 557 погибли%) |
Летальность при БГМ с неустановленной этиологией | Из 564 погибли %) | Из 217 погибли 26 (12%) |
Летальность при МкМ +/– МКЕ* | Из 461 погибли 79 (17%) | Из 268 погибли%) |
Летальность при ПкМ** | Из 116 погибли 25 (22%) | Из 61 погибли 4 (7%) |
*– при смешанных генерализованных формах менингококковой инфекции «менингококковый менингит (МкМ) +/– менингококкемия (МКЕ)», % от числа больных с установленной этиологией заболевания; **– при пневмококковых менингитах (ПкМ), % от числа больных с установленной этиологией заболевания |
При сравнении указанных периодов отмечено снижение летальности в общей группе больных бактериальными гнойными менингитами в 1,5 раза, что было обусловлено, прежде всего, значительным, более чем в 3 раза, снижением летальности при пневмококковых менингитах и в 2 раза - при бактериальных гнойных менингитах с неустановленной этиологией. В то же время отмечено увеличение летальности, до 20%, при смешанных генерализованных формах менингококковой инфекции (менингококковый менингит +/– менингококкемия) на фоне устойчивого снижения общего количества регистрируемых случаев генерализованных форм этого антропоноза. Это было обусловлено значительным увеличением числа больных с фулминантными формами менингококкемии, что, как известно, определяет тяжесть течения и неблагоприятный исход заболевания [ и соавт., 1976; , 1982; и соавт., 2003; и соавт., 2007; Brandtzaeg P. et al., 2005]. Так, в 2006 г. 14 случаев из 26, в 2007 г. – 12 из 19, а в 2008 году - 8 случаев из 10 составили больные с клиническими и лабораторными признаками менингококкового менингита с фулминантной менингококкемией, что и обусловило соответствующие показатели летальности в эти годы – 27%, 37% и 40% соответственно.
Также установлено, что другими факторами, обусловившими высокий риск летального исхода бактериального гнойного менингита, вне зависимости от его этиологии, явились поздняя госпитализация больных и возраст старше 55 лет.
Клинико-лабораторная характеристика бактериальных гнойных менингитов различной этиологии и критерии раннего прогноза циклического и ациклического течения заболеваний.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 |




