Изучение показателей ОВ в зависимости от эффекта лечения дало интересные результаты. Так, для больных с ПЭ (n=28) средняя ОВ составила 86,9±11,3 мес. (ДИ 95%, 64,9-108,9 мес.), медиана не достигнута, для больных с ЧЭ (n=57) – 89,4 ±9,6 мес. (ДИ 95%, 70,5-108,1 мес.) с медианой 71±15,5 мес., для больных со стабилизацией (n=84) – 76,5±8,9 мес. (ДИ 95%, 59,1-94,0 мес.) с медианой 47±11,5 мес., для больных с прогрессированием (n=95) – 35,2±3,2 мес. (ДИ 95%, 28,9-41,6 мес.) с медианой 24±2,3 мес. (р=0,0001) (рис. 8).


Рис. 8. Общая выживаемость больных ОИФ РМЖ в зависимости от эффекта лечения.
Рисунок 8 является наглядной демонстрацией того, что все три клинических эффекта от лечения, а именно полный, частичный эффект или стабилизация сопровождаются статистически значимо лучшей ОВ по сравнению с прогрессированием основного заболевания, что позволяет отнести данный признак к группе прогностически значимых.
Наиболее эффективными являются режимы химиотерапии с антрациклинами, однако малочисленность остальных групп не позволяет делать окончательные выводы. Возможно комбинированные режимы химиотерапии с добавлением к антрациклинам таксанов покажут не менее интересные результаты.
Многофакторный анализ ОВ показывал, что из ряда признаков, включающих в себя менструальный статус, стадию и форму заболевания, эффект от лечения, PEV статус, гистологическое строение опухоли, только у больных с ИПР по сравнению с ИДР и редкими формами, а также у больных с ПЭ, ЧЭ, стабилизацией по сравнению с прогрессированием опухолевого процесса выявлены статистически значимые различия. Влияние стадии заболевания (T4N0-3M0 и T4N0-3M1) было близко к статистически значимому, возможно, ограниченное число пациентов не позволило достичь статистической значимости (р=0,052).
До настоящего времени остается открытым вопрос о наиболее эффективных комбинациях лечебных методик. Для решения данной задачи проведен однофакторный анализ показателей ОВ и обнаружено, что при применении однокомпонентного лечения в виде системной терапии (химиотерапии или гормонотерапии) (n=60) средняя ОВ составила 41,8±5,5 мес. (ДИ 95%, 31,1-52,6 мес.) с медианой 24±6,3 мес., при применении двухкомпонентного лечения в виде химиотерапии / гормонотерапии и операции или лучевой терапии (n=82) средняя ОВ составила 55,1±6,5 мес. (ДИ 95%, 42,4-67,9 мес.) с медианой 31±7,5 мес., а при применении комплексного трехкомпонентного лечения в виде химиотерапии / гормонотерапии и операции и лучевой терапии (n=122) средняя ОВ составила 91,8±7,7 мес. (ДИ 95%, 76,7-106,8 мес.) с медианой 60±12,4 мес. (р<0,0001) (рис. 9).
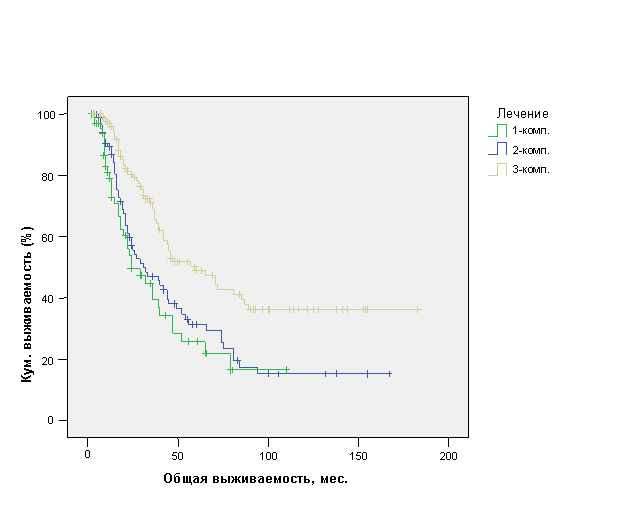

Рис. 9. Общая выживаемость больных ОИФ РМЖ в зависимости от компонентности лечения.
Таким образом, только применение комплексного лечения позволяет добиться достоверно лучшей ОВ у больных ОИФ РМЖ. Следует уточнить, что здесь, как и в случае с БРВ, компонентность лечения (одно-, двух - или трехкомпонентное) определялась не изначально, а в результате оценки эффекта от лечения в каждом конкретном случае.
Местные рецидивы заболевания отмечены у 25 (9,5%) пациенток. Их появление сопровождалось снижением ОВ, составившей 35,7±7,4 мес. (ДИ 95%, 21,2-50,3 мес.) с медианой 22±2,1 мес. по сравнению с 73,2±5,1 мес. (ДИ 95%, 63,2-83,1 мес.) с медианой 44±2,8 мес. у больных без местных рецидивов, причем различия едва не достигали статистически значимых, вероятно, ввиду малого числа больных (р=0,062).
Гораздо чаще в нашем исследовании отмечалось появление новых отдаленных метастазов - у ,4%) больных. Эти больные имеют статистически значимо худшую ОВ, которая составила 47,7±3,7мес. (ДИ 95%, 40,5-54,9 мес.) с медианой 37±3,2 мес., а для больных без появления отдаленных метастазов - 108,0±8,5 мес. (ДИ 95%, 91,3-124,7 мес.), медиана не достигнута (р=0,0001) (рис. 10).
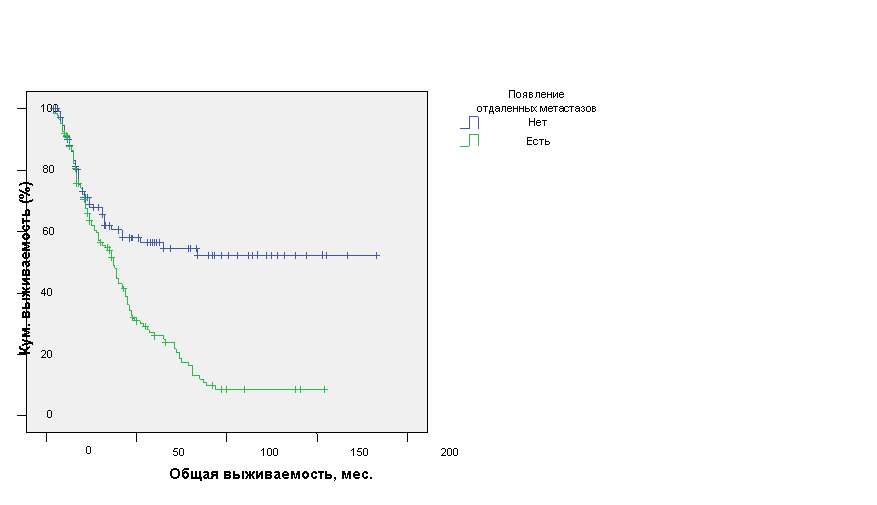

Рис. 10. Общая выживаемость больных ОИФ РМЖ в зависимости от появления отдаленных метастазов.
Как свидетельствуют представленные данные именно появление отдаленных метастазов, а не местных рецидивов заболевания, приводит к снижению ОВ больных ОИФ РМЖ.
При включении фактора появления отдаленных метастазов в многофакторный анализ ОВ с репродуктивным статусом, стадией заболевания, эффектом от лечения, гистологическим строением опухоли, схемой химиотерапии установлена его прогностическая значимость наряду с такими факторами как эффект от лечения и гистологическое строение опухоли.
В проведенном исследовании оценена 3-, 5- и 10-летняя ОВ пациенток ОИФ РМЖ, которая составила 52,8%, 31,0% и 8,3%.
Современные методы визуализации и диагностики ОИФ РМЖ на основе позитронной эмиссионной томографии (ПЭТ)
ПЭТ с 18F-FDG (2-фтор-2-дезокси-D-глюкоза, меченная 18F) является принципиально новым методом лучевой визуализации, который позволяет не только определить наличие злокачественного образования, но и оценить его форму, размер, структуру, а также оценить распространенность опухолевого процесса. Особенностью данного метода является возможность вычисления коэффициента дифференциального накопления (КДН) для анализа накопления радиофармпрепарата в опухоли по сравнению с неизмененными тканями.
Впервые нами проведен анализ ПЭТ с 18F-FDG у 36 больных ОИФ РМЖ, результаты которого представлены ниже. Проанализировано 146 очагов патологической гиперметаболической активности с КДН более 2,0. Из них 39 находились в первичных опухолях, 79 – в лимфатических узлах, 8 – в печени, 5 – в головном мозге, 3 – в легких, 12 – в костях скелета. Следует отметить, что только в трех случаях результаты ПЭТ были ложноотрицательными.
В 18 очагах, диагносцированных при других исследованиях как метастатическое поражение, результаты ПЭТ не выявили патологического накопления препарата с КДН более 2,0. В 9 случаях они были истинноотрицательными, в остальных 9 случаях – ложноотрицательными. Ложноотрицательные результаты были, как правило, обусловлены малым размером опухолевого узла, что затрудняло правильную трактовку полученных результатов.
Было выявлено новых 29 метастатических очагов, не обнаруженных до ПЭТ другими методами исследования (14 – в лимфатических узлах, 4 – в печени и 11 – в костях скелета), что указывает на высокую диагностическую ценность данного метода по сравнению со стандартными результатами обследования в выявлении истинной распространенности опухолевого процесса.
В 4 случаях была диагносцирована генерализованная форма заболевания, что привело к изменению плана лечения и замене радикальной мастэктомии на паллиативную химиолучевую терапию. Еще в 4 случаях на основании находок ПЭТ была назначена более пролонгированная химиотерапия.
Впервые определена эффективность ПЭТ в диагностике ОИФ РМЖ: точность ПЭТ в режиме «Whole body» с 18F-FDG составила 93%, чувствительность – 94%, специфичность – 75%.
Точность ПЭТ с 18F-FDG существенно зависит от размеров патологического очага. Опухоли диаметром менее 1 см нередко приводят к ложноотрицательным результатам, т. к. их выявление ограничено пространственным разрешением современных сканеров.
В проведенном нами исследовании впервые при ОИФ РМЖ с помощью ПЭТ было проанализировано 85 очагов, подозрительных на специфическое поражение лимфатических узлов различных групп: подмышечных, над - и подключичных, шейных, внутригрудных. Именно в лимфатических узлах нами было получено наибольшее количество ложных результатов (6 ложноотрицательных и 2 ложноположительных). Сложности в интерпретации были связаны с низким накоплением 18F-FDG в этих очагах, их небольшими размерами, повышенным накоплением препарата в мышцах, а также воспалительными изменениями.
Таким образом, более широкое внедрение ПЭТ в алгоритм диагностики РМЖ позволит более точно стадировать данную патологию и, соответственно, правильно определять лечебную тактику ведения больных ОИФ РМЖ.
Микрометастазы в костный мозг и особенности костномозгового кроветворения у больных ОИФ РМЖ
В настоящее время отсутствует единая точка зрения относительно роли и места иммуноцитологического исследования в диагностике микрометастазов ОИФ РМЖ, а также их прогностическом влиянии на БРВ и ОВ данной категории больных.
Совместно с лабораторией иммунологии гемопоэза нами проведено проспективное исследование микрометастатического поражения костного мозга и костномозгового кроветворения у 19 больных ОИФ РМЖ, получавших лечение в хирургическом отделении опухолей женской репродуктивной системы РОНЦ им. РАМН с 2003 по 2005г (рис. 13). 
Рис. 13. Комплекс метастатических клеток в костном мозге. Цитоцентрифужный препарат. Окраска МКА КL-1. Ув. 400.
В исследуемую группу вошли женщины в возрасте от 29 до 73 лет. Средний возраст пациенток составил 52 года. Распределение по стадиям было следующим: T4N1M0 –,6%) больных, T4N2M0 – 4 (21,0%), T4N3M0 – 2 (10,5%), T4N2M,8%) больных. Первичная ОИФ РМЖ выявлена у 6 (31,6%) больных, вторичная ОИФ РМЖ – у,4%) больных.
Макрометастазы выявлены с помощью цитологического метода у 1 (5,3%) больной, а микрометастазы, установленные иммуноцитологически, с пороговым значением 2 и более опухолевых клеток – у 7 (36,8%) и с пороговым значением 10 и более опухолевых клеток – у 5 (26,3%) больных. Считается, что пороговая опухолевая нагрузка в 10 и более опухолевых клеток в костном мозге резко увеличивает вероятность возникновения отдаленных метастазов.
Нами исследован ряд клинико-морфологических признаков на предмет установления возможной связи с частотой развития микрометастазов.
При пороговом значении 2 и более метастатических клеток получены следующие результаты: микрометастазы выявлены у 7 (36,8%) больных и микрометастазы отсутствовали у,2%) больных ОИФ МЖ. При анализе частоты развития микрометастазов в зависимости от гистологического строения опухоли статистически достоверных различий не получено: из 12 больных без поражения костного мозга у 4 (33,3%) выявлен ИДР, у 8 (66,7%) – ИПР, аналогичная тенденция отмечается и у больных с микрометастатическим поражением костного мозга – 2 (28,6%) и 5 (71,4%) больных соответственно (р=0,8).
Анализ частоты развития микрометастазов в зависимости от рецепторного статуса опухоли также не выявил статистически достоверных различий. Так, из 12 больных без метастатического поражения у 6 (50,0%) были эстрогенпозитивные опухоли, а еще у 6 (50,0%) – эстрогеннегативные опухоли, а из 7 больных с метастатическим поражением эстрогенпозитивные опухоли отмечены 2 (28,6%), а эстрогеннегативные – у 5 (71,4%) больных (р=0,3).
Аналогичная тенденция обнаружена и по рецепторам прогестерона: из 12 пациенток без микрометастатического поражения костного мозга у 3 (25,0%) были прогестеронпозитивные опухоли, у 9 (75,0%) - прогестероннегативные, а в группе пациенток с метастатическим поражением костного мозга – 3 (42,9%) и 4 (57,1%) соответственно (р=0,4).
Анализ в зависимости от HER2/neu статуса опухоли показал интересные результаты. В группе пациенток без метастатического поражения распределение было следующим: HER2/neu 0 – 5 (41,7%) пациенток, HER2/neu 1+ ,3%), HER2/neu 2+ ,7%), HER2/neu 3+ - 1 (8,3%) пациентка, а в группе пациенток с микрометастазами – 2 (28,6%), 1 (14,3%), 0 и 4 (57,1%) соответственно (р=0,085), что указывает на определенную тенденцию между HER2/neu позитивным статусом и развитием микрометастазов ОИФ РМЖ в костный мозг.
Анализ выживаемости при пороговом значении более 2 метастатических клеток не выявил статистически достоверных различий в БРВ и ОВ больных ОИФ РМЖ в зависимости от наличия или отсутствия микрометастазов в костный мозг. Установлено, что средняя БРВ больных без микрометастазов составила 20,3±3,6 мес. (ДИ 95%, 13,3-27,2 мес.) с медианой 15±3,1 мес., а у больных с микрометастазами – 25,1±3,5 мес. (ДИ 95%, 18,3-31,9 мес.) с медианой 24±2,1 мес. (р=0,7).
Средняя ОВ больных без микрометастазов составила 23,7±3,5 мес. (ДИ 95%, 16,8-30,5 мес.), медиана не достигнута, а у больных с микрометастазами – 24,4±3,8 мес. (ДИ 95%, 16,9-31,9 мес.) с медианой 24±2,2 мес. (р=0,8).
Нами было изучено состояние кроветворения у всех 19 больных ОИФ РМЖ, включенных в исследование (табл. 8).
Таблица 8
Состояние кроветворения у больных ОИФ РМЖ с или без микрометастазов в костный мозг
Показатели | Микрометастазы | Количество | Среднее значение (М±м) | р |
Бласты | Нет Да | 12 7 | 1,4±0,3 1,3±0,3 | 0,7 |
Миелокариоциты | Нет Да | 10 3 | 58,4±15,6 44,3±14,8 | 0,5 |
Мегакариоциты | Нет Да | 5 3 | 30,0±12,2 41,7±30,1 | 0,7 |
Промиелоциты | Нет Да | 12 7 | 0,3±0,1 0,4±0,1 | 0,8 |
Миелоциты | Нет Да | 12 7 | 8,7±1,4 9,6±1,6 | 0,7 |
Метамиелоциты | Нет Да | 12 7 | 7,5±1,1 7,4±1,3 | 0,9 |
Палочкоядерные | Нет Да | 12 7 | 20,9±1,5 22,5±1,9 | 0,5 |
Сегментоядерные | Нет Да | 12 7 | 26,4±3,1 26,4±4,1 | 0,9 |
Сумма гранулоцитов | Нет Да | 12 7 | 66,8±1,6 68,4±2,8 | 0,6 |
Индекс созревания гранулоцитов | Нет Да | 12 7 | 0,4±0,1 0,4±0,1 | 0,9 |
Моноциты | Нет Да | 12 7 | 3,1±0,4 2,8±0,5 | 0,5 |
Лимфоциты | Нет Да | 12 7 | 16,2±2,5 15,5±0,9 | 0,7 |
Плазмобласты | Нет Да | 12 7 | 0,7±0,1 0,8±0,3 | 0,9 |
Нормобласты базофильные | Нет Да | 12 7 | 1,4±0,8 0,6±0,2 | 0,4 |
Нормобласты полихроматофильные | Нет Да | 12 7 | 5,4±1,4 4,0±0,7 | 0,4 |
Нормобласты оксифильные | Нет Да | 12 7 | 5,7±1,4 6,7±1,3 | 0,6 |
Сумма клеток эритроидного ряда | Нет Да | 12 7 | 11,6±2,8 11,3±2,1 | 0,9 |
Индекс созревания эритроидных клеток | Нет Да | 12 7 | 0,9±0,2 0,9±0,1 | 0,9 |
Лейко-эритробластное соотношение | Нет Да | 12 7 | 21,7±8,3 8,4±1,9 | 0,2 |
Установлен ряд особенностей, характерных для ОИФ РМЖ: во-первых, это расширение гранулоцитарного ростка, в основном за счет увеличения числа зрелых нейтрофилов, отмеченное у,7%) больных и, во-вторых, это сужение эритроидного ростка, отмеченное у,9%) больных. Ни по одному из анализируемых признаков состояния кроветворения у больных ОИФ РМЖ с или без микрометастазов в костный мозг нами не выявлено статистически достоверных различий, что позволило нам прийти заключению об отсутствии влияния микрометастазов на гемопоэз больных ОИФ РМЖ.
Иммунофенотипические особенности ОИФ РМЖ
В настоящее время выделяют целый ряд опухолевых маркеров, коррелирующих с основными биологическими и прогностическими характеристиками РМЖ.
Целью проведенного исследования было выявление иммунофенотипических особенностей ОИФ РМЖ, имеющих прямую связь с опухолевой прогрессией и противоопухолевым иммунитетом, а также уровней и субпопуляций иммунокомпетентных клеток, инфильтрирующих РМЖ.
Исследование иммунофенотипа опухолевых клеток при ОИФ РМЖ проведено у 31 пациентки (табл. 11). Опухолевые клетки ОИФ РМЖ в 100% случаев экспрессировали панцитокератины и общеэпителиальный антиген EpCAM-1 (МКА НЕА-125), а в большинстве случаев (96,8%) – MUC-1. С различной частотой отмечалась экспрессия молекул гистосовместимости I и II классов, а также трансферринового рецептора CD71. Среди интратуморальных лимфоцитов преобладали Т-киллеры (CD45+, CD7+, CD8+), а инфильтрация опухоли макрофагами, В-лимфоцитами и NK-клетками была незначительной.
Таблица 11
Частота экспрессии маркеров опухолевых клеток при ОИФ РМЖ
Маркер | Характер экспрессии | Количество обследованных | Число случаев с данным типом экспрессии | Частота реакции (%) |
Опухолевые маркеры | ||||
HLA-I | Мономорфный | 31 | 13 | 41,9 |
Мозаичный | 31 | 8 | 25,8 | |
Отрицательный | 31 | 10 | 32,3 | |
HLA-DR | Мономорфный | 31 | 4 | 12,9 |
Мозаичный | 31 | 6 | 19,4 | |
Отрицательный | 31 | 21 | 67,7 | |
MUC-1 | Мономорфный | 31 | 25 | 80,6 |
Мозаичный | 31 | 5 | 16,1 | |
Отрицательный | 31 | 1 | 3,2 | |
Панцитокератины (KL-1) | Мономорфный | 23 | 23 | 100 |
EpCAM (HEA-125) | Мономорфный | 24 | 24 | 100 |
Рецептор трансферрина (CD71) | Мономорфный | 31 | 20 | 64,5 |
Мозаичный | 31 | 8 | 25,8 | |
Отрицательный | 31 | 3 | 9,7 | |
Уровень инфильтрации макрофагами и субпопуляциями интратуморальных лимфоцитов | ||||
Макрофаги (CD163, D11) | Выраженная реакция | 22 | 3 | 13,7 |
Умеренная | 22 | 7 | 31,8 | |
Слабая | 22 | 12 | 54,5 | |
Все лейкоциты (CD45) | Выраженная реакция | 31 | 13 | 41,9 |
Умеренная | 31 | 8 | 25,8 | |
Слабая | 31 | 10 | 32,3 | |
Т - клетки (CD7) | Выраженная реакция | 31 | 6 | 19,5 |
Умеренная | 31 | 11 | 35,5 | |
Слабая | 31 | 14 | 45,2 | |
Т-хелперы (CD4) | Умеренная | 23 | 7 | 30,4 |
Слабая | 23 | 16 | 69,6 | |
Т-киллеры (CD8) | Выраженная реакция | 23 | 2 | 8,7 |
Умеренная | 23 | 5 | 21,7 | |
Слабая | 23 | 16 | 69,6 | |
NK-клетки (CD16) | Умеренная | 23 | 2 | 8,7 |
Слабая | 23 | 21 | 91,3 | |
В-клетки (CD20) | Умеренная | 7 | 10 | 70 |
Слабая | 3 | 10 | 30 |
Проведен анализ взаимосвязи экспрессии различных иммунологических маркеров опухолевых клеток. Интересно отметить, что наиболее хорошо известные и неоднократно подтвержденные закономерности в экспрессии иммунологических маркеров при ОИФ РМЖ не наблюдались. Так, экспрессия молекул гистосовместимости I и II классов не была взаимозависимой. При ОИФ РМЖ экспрессия молекул главного комплекса гистосовместимости I класса (мономорфная и мозаичная) наблюдалась с высокой частотой – 67,7%. Вместе с тем в 20% случаев при полном отсутствии молекул HLA-I на опухолевых клетках выявлялись молекулы HLA-DR (р = 0,48).
В нашей выборке частота экспрессии MUC-1 при ОИФ РМЖ составила 96,8%. В 16,1% случаев (5 больных) антиген выявлялся лишь на части клеток. Интересно отметить, что именно при полном или частичном отсутствии на клетках молекулы MUC-1 наблюдалась максимальная частота мономорфной экспрессии HLA-DR. Так, при мономорфных MUC-1 данный тип реакции HLA-DR отмечен в 4% случаев (1 из 25), при мозаичном – 40% (2 из 5), при отрицательном – 100% (1 наблюдение). Отрицательная корреляция между признаками носила статистически достоверный характер (р=0,011). Напомним, что в целом по группе мономорфный тип экспрессии HLA-DR отмечен всего лишь у 4 из 31 больной (12,9%).
Таким образом, особенности экспрессии иммунологических маркеров на клетках ОИФ РМЖ касаются в основном молекул HLA-DR. Эти молекулы могут появляться и при отсутствии HLA-I класса и находятся в обратной корреляционной связи с экспрессией MUC-1, то есть максимальная частота мономорфной экспрессии HLA-DR наблюдается при отсутствии MUC-1.
На следующем этапе проводилась оценка того, насколько уровни инфильтрации ОИФ РМЖ различными субпопуляциями лимфоцитов и макрофагами зависят от иммунофенотипических особенностей опухолевых клеток – экспрессии HLA-I и II классов, MUC-1 и трансферринового рецептора CD71.
Уровни инфильтрации опухоли иммунокомпетентными клетками не зависели от фенотипа РМЖ. Единственным исключением явился антиген MUC-1. Инфильтрация опухоли CD16-позитивными лимфоцитами находилась в обратной зависимости от экспрессии этого антигена. Максимальные уровни инфильтрации наблюдались при отсутствии или мозаичной экспрессии MUC-1 (р=0,04). Следует отметить, что в целом NK-клеточная (CD16) инфильтрация опухоли была слабой, и для окончательных выводов необходимо дальнейшее накопление материала.
Наиболее интересные данные получены при анализе взаимосвязи между различными субпопуляциями лимфоцитов, инфильтрирующих опухолевую ткань ОИФ РМЖ. Общий уровень лейкоцитарной инфильтрации (CD45) коррелировал со степенью инфильтрации опухоли CD7+ Т-клетками (р=0,014), CD8+ T-киллерами (р=0,0001), CD4+ Т-хелперами (р=0,0001), CD20+ B-клетками и CD16+ NK-клетками (р=0,052). Однако связи с макрофагальной инфильтрацией нами не установлено (р=0,26).
Аналогичные закономерности отмечены в отношении Т-киллерных клеток. Выраженная инфильтрация опухоли этими клетками наблюдалась только в случаях сильной общелейкоцитарной инфильтрации. Напротив, при отсутствии последней значительной Т-клеточной инфильтрации не наблюдали (р=0,001).
Общая лейкоцитарная инфильтрация коррелировала с уровнями интратуморальных Т-хелперных клеток (р=0,002), а взаимосвязь с В-лимфоцитами (р=0,08) и NK-клетками (р=0,08) была близка к достоверной.
Таким образом, выраженность общей инфильтрации опухолевой ткани лимфоидными клетками сопровождается достоверным нарастанием уровней инфильтрации субпопуляциями Т-клеток, включая Т-хелперы и Т-киллеры. Взаимосвязей с В-лимфоцитами, CD16-позитивными клетками и макрофагами мы не наблюдали.
Из числа изученных популяций лимфоцитов наиболее выраженные уровни инфильтрации были характерны для Т-клеток (CD7+). Причем, Т-клеточная инфильтрация отражалась как на количестве интратуморальных Т-киллеров, так и Т-хелперов. Значительно большая взаимосвязь отмечена с Т-киллерами (р=0,001), нежели с Т-хелперами (р=0,033). Интересно отметить, что общий уровень Т-клеток был взаимосвязан с макрофагальной инфильтрацией (р=0,036).
Субпопуляции интратуморальных Т-хелперов и Т-киллеров были взаимосвязаны (р=0,01). В свою очередь, уровни Т-киллеров коррелировали с макрофагами (р=0,036), а уровни Т-хелперов – с CD16-клетками (р=0,03).
ВЫВОДЫ
1. Сравнение основных клинико-морфологических и биологических признаков ОИФ РМЖ (средний возраст, менструальный статус, генеративная функция, распределение по стадиям, локализация поражения, гистологическое строение опухоли, степень дифференцировки опухоли, рецепторный и HER2/neu статус) не выявило статистически значимых различий между первичной и вторичной формой заболевания. Варианты лечения первичной и вторичной ОИФ РМЖ также не имеют статистически значимых различий.
2. 3-, 5- и 10-летняя БРВ больных первичной и вторичной ОИФ РМЖ не имела статистически значимых различий и составила 29,5% и 29,9% (р=0,7), 24,1% и 15,4% (р=0,1) и 12,2% и 4,1% (р=0,07) соответственно, также как и 3-, 5- и 10-летняя ОВ, составившая 52,3% и 52,9% (р=0,9), 40,5% и 28,2% (р=0,1) и 15,8% и 6,1% (р=0,07) соответственно.
3. Особенностями ОИФ РМЖ являются преимущественно рецепторнегативные (57,7%) и низкодифференцированные (71%) опухоли, инфильтративный протоковый рак (40,5%). На момент постановки диагноза более 90% больных имеют поражение региональных лимфатических узлов, а у 35% больных уже имеются отдаленные метастазы.
4. Факторами, влияющими на БРВ у больных ОИФ РМЖ являются гистологическое строение опухоли (р=0,013), эффект (р=0,0001) и комплексное лечение (р=0,0001). Трехлетняя БРВ в проведенном исследовании составила 29,8%, 5-летняя – 19,3% и 10-летняя БРВ – 6,5%, а средняя БРВ составила 63,3±5,4 мес. с медианой 24±1,7 мес. Разработанные решающие правила позволяют прогнозировать развитие или отсутствие рецидива заболевания с вероятностью 83,1% и 81,7% соответственно.
5. В проведенном исследовании 3-летняя ОВ составила 52,8%, 5- и 10-летняя - 31,0% и 8,3% соответственно, а средняя ОВ составила 71,6±4,9 мес. с медианой 42±2,9 мес. Факторами, влияющими на ОВ больных ОИФ РМЖ, являются: стадия заболевания (р=0,001), гистологическое строение опухоли (р=0,001), появление отдаленных метастазов (р=0,0001), эффект (р=0,0001) и комплексность лечения (р=0,0001). При многофакторном анализе прогностическое значение для ОВ имеют гистологическое строение опухоли, эффект от лечения и появление отдаленных метастазов в процессе лечения.
6. Особенности иммунофенотипа ОИФ РМЖ заключаются в обратной взаимозависимости в экспрессии молекул HLA-DR с MUC-1 и нарастании уровней NK-клеточной инфильтрации (CD16) в случаях утраты MUC-1. Опухолевые клетки ОИФ РМЖ в 100% случаев экспрессируют панцитокератины и общеэпителиальный антиген EpCAM-1 (МКА НЕА-125), а в 96,8% случаев – MUC-1. Среди интратуморальных лимфоцитов при ОИФ РМЖ преобладают Т-киллеры (CD45+ CD7+ CD8+), а инфильтрация опухоли макрофагами, В-лимфоцитами и NK-клетками незначительна. К иммунологическим особенностям ОИФ РМЖ можно отнести отсутствие взаимосвязи между общелейкоцитарной и макрофагальной инфильтрацией.
7. Применение иммуноцитологического исследования у больных ОИФ РМЖ позволяет значительно повысить эффективность диагностики метастазов в костный мозг до начала лечения по сравнению со стандартным цитологическим исследованием (36,8% vs 5,3%), что, в свою очередь, позволяет адекватно стадировать и индивидуализировать тактику лечения больных ОИФ РМЖ. Влияния микрометастазов в костный мозг на ОВ и БРВ больных ОИФ РМЖ не выявлено. Костномозговое кроветворение больных ОИФ РМЖ имеет ряд специфичных черт: это расширение гранулоцитарного ростка, в основном за счет увеличения числа зрелых нейтрофилов, отмеченное у 52,7% больных и сужение эритроидного ростка, отмеченное у 57,9% больных. Влияния микрометастазов в костный мозг на гемопоэз у больных ОИФ РМЖ не выявлено.
8. Высокой эффективностью в диагностике и оценке распространенности ОИФ РМЖ обладает ПЭТ: точность ПЭТ в режиме «Whole body» с 18F-FDG составила 93%, чувствительность – 94%, специфичность – 75%.
9. При схожести прогнозов БРВ и ОВ при первичной и вторичной ОИФ РМЖ, стратегию лечения следует строить не на форме заболевания, а на стадии, гистологическом строении опухоли и эффекте от лечения, а основой лечения больных данной патологией является комплексное лечение.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Правильное стадирование ОИФ РМЖ вместе с другими факторами прогноза является определяющим фактором в выборе тактики лечения. Исследование костного мозга на предмет метастатического поражения до настоящего времени зачастую оставалось за пределами стандартного онкологического обследования. Применение иммуноцитологического исследования позволяет значительно повысить эффективность диагностики метастазов в костный мозг по сравнению со стандартным цитологическим исследованием (36,8% vs 5,3%). Включение иммуноцитологического исследования в комплекс стандартного обследования при ОИФ РМЖ является актуальной задачей современного здравоохранения по внедрению высокотехнологических методов диагностики и лечения онкологических больных.
2. ПЭТ в режиме «Whole body» с 18F-FDG (2-фтор-2-дезокси-D-глюкоза, меченная 18F) показала высокую эффективность в диагностике и оценке распространенности ОИФ РМЖ (точность 93%, чувствительность 94%, специфичность 75%) и может быть рекомендована к стандартному применению у больных ОИФ РМЖ.
3. В рамках проведенного исследования и сравнения основных клинико-морфологических и биологических признаков ОИФ РМЖ, вариантов лечения, а также результатов БРВ и ОВ статистически достоверных различий у больных первичной и вторичной ОИФ РМЖ не выявлено, что указывает на отсутствие необходимости в их разделении и применении различных подходов к их лечению.
4. На основании сочетания наиболее информативных признаков (гистологического строения опухоли, эффекта от лечения и его комплексности) разработаны решающие правила, позволяющие в случае, если сумма коэффициентов решающего правила меньше нуля, прогнозировать риск возникновения рецидива или прогрессирования заболевания с вероятностью 83,1%, а при сумме коэффициентов большей нуля – прогнозировать благоприятный прогноз в отношении прогрессирования основного заболевания или развития рецидива с вероятностью 81,7%. Таким образом, использование результатов проведенного исследования позволит врачам-онкологам с указанной выше вероятностью индивидуализировать прогноз у больных ОИФ РМЖ, что, в свою очередь, позволит улучшить результаты лечения данной категории больных.
5. Лечение больных первичной и вторичной ОИФ РМЖ следует строить не на форме заболевания, а на стадии, гистологическом строении опухоли и эффекте от лечения. Лечение больных данной патологией должно быть комплексным и включать в себя по возможности весь арсенал современных методов лечения РМЖ: химиотерапию с включением антрациклинов и таксанов, операцию, лучевую терапию, а также гормонотерапию. Последовательность и сроки применению каждого метода зависят от эффекта от лечения.
Список работ, опубликованных по теме диссертации
1. Беришвили, применение позитронной эмиссионной томографии при раке молочной железы / , , // Вестник Российского онкологического научного центра им. РАМН, 2004, №1-2, с. 62-67
2. Беришвили, эмиссионная томография при раке молочной железы / , , // Анналы хирургии, 2005, №2, с. 38-43
3. Беришвили, -инфильтративная форма рака молочной железы / , // Маммология, 2006, №3, с. 19-26
4. Беришвили, -инфильтративная форма рака молочной железы и поражение костного мозга / , , // Материалы российской научно-практической конференции с международным участием, 4-5 июля, 2006г., Барнаул, с. 161
5. Беришвили, стратегия лечения отечно-инфильтративной формы рака молочной железы / , // Анналы хирургии, 2006, №4, с.13-18
6. Беришвили, в аксиллярных лимфатических узлах как первичное проявление рака молочной железы / , , // Материалы всероссийской научно-практической конференции с международным участием 3-4 июля 2007г, Барнаул, с. 148
7. Беришвили, рецепторного статуса опухоли и выявление микрометастазов в костный мозг у больных отечно-инфильтративной формы рака молочной железы / , , // Материалы всероссийской научно-практической конференции с международным участием 3-4 июля 2007г, Барнаул, с. 200
8. Беришвили, клиники и морфологии первично-множественного рака молочной железы / , , // Материалы всероссийской научно-практической конференции с международным участием 3-4 июля 2007г, Барнаул, с. 219
9. Беришвили, ли диагносцировать мультицентрическое поражение молочной железы при раке? / , , // Материалы всероссийской научно-практической конференции с международным участием 3-4 июля 2007г, Барнаул, с. 221
10. Беришвили, анализ прогноза при двухстороннем раке молочных желез / , , // Материалы всероссийской научно-практической конференции с международным участием 3-4 июля 2007г, Барнаул, с. 306
11. Беришвили, взгляд на стадирование мультицентрического рака молочной железы / , , // Материалы всероссийской научно-практической конференции с международным участием 3-4 июля 2007г, Барнаул, с. 307
12. Беришвили, клинических перспектив определения содержания фактора роста эндотелия сосудов в опухолях и сыворотке крови больных раком молочной железы / , , // V съезд онкологов и радиологов СНГ, 14-16 мая, 2008г., Ташкент, с. 227
13. Беришвили, прогноза микрометастатического поражения костного мозга у больных отечно-инфильтративной формой рака молочной железы / , , // V съезд онкологов и радиологов СНГ, 14-16 мая, 2008г., Ташкент, с. 228
14. Беришвили, особенности и частота поражения костного мозга при отечно-инфильтративной форме рака молочной железы / , , // V съезд онкологов и радиологов СНГ, 14-16 мая, 2008г., Ташкент, с. 228
15. Беришвили, характеристика отечно-инфильтративной формы рака молочной железы / , , // Опухоли женской репродуктивной системы, 2009, №3-4, с. 15-20
16. Беришвили, прогноза безрецидивной выживаемости у больных отечно-инфильтративной формой рака молочной железы / , // Анналы хирургии, 2009, №3, с.28-32
17. Беришвили, и вторичная отечно-инфильтративная форма рака молочной железы: сходство или различия? / , // Российский биотерапевтический журнал, 2009, №3, с. 75-81
18. Беришвили, течения первичной отечно-инфильтративной формы рака молочной железы / , // Вестник РОНЦ им. РАМН, 2009, т. 20, №3, с.32-36
19. Беришвили, отечно-инфильтративной формы рака молочной железы / , , // VI съезд онкологов и радиологов СНГ, 1-4 октября, 2010г., Душанбе, с. 52
20. Беришвили, выживаемость больных отечно-инфильтративной формой рака молочной железы / , , // VI съезд онкологов и радиологов СНГ, 1-4 октября, 2010г., Душанбе, с. 139
21. Беришвили, отечно-инфильтративная форма рака молочной железы / , , // VI съезд онкологов и радиологов СНГ, 1-4 октября, 2010г., Душанбе, с. 140
22. Беришвили, -морфологические особенности и выживаемость больных первичной и вторичной отечно-инфильтративной формой рака молочной железы / , , // VI съезд онкологов и радиологов СНГ, 1-4 октября, 2010г., Душанбе, с. 140
23. Беришвили, иммунофенотипа отечно-инфильтративной формы рака молочной железы / , , // Материалы всероссийской научно-практической конференции с международным участием 29-30 июля 2010г, Барнаул, с. 219
24. Беришвили, прогноза безрецидивной выживаемости у больных отечно-инфильтративной формой рака молочной железы / , , // Материалы всероссийской научно-практической конференции с международным участием 29-30 июля 2010г, Барнаул, с. 220
25. Беришвили, мы знаем о первичной отечно-инфильтративной форме рака молочной железы / , , // Материалы всероссийской научно-практической конференции с международным участием 29-30 июля 2010г, Барнаул, с. 220
26. Беришвили, и общая выживаемость больных первичной и вторичной отечно-инфильтративной формой рака молочной железы / , , // Материалы всероссийской научно-практической конференции с международным участием 29-30 июля 2010г, Барнаул, с. 221
27. Беришвили, -инфильтративная форма рака молочной железы: результаты безрецидивной выживаемости / , , // VII международная конференция "Проблемы диагностики и лечения рака молочной железы", 23-25 июля 2010, Санкт-Петербург, с. 16
28. Беришвили, клинического течения и результаты лечения первичной отечно-инфильтративной формы рака молочной железы / , , // VII международная конференция "Проблемы диагностики и лечения рака молочной железы", 23-25 июля 2010, Санкт-Петербург, с. 16
29. Беришвили, ли разделение первичной и вторичной отечно-инфильтративной формы рака молочной железы / , , // VII международная конференция "Проблемы диагностики и лечения рака молочной железы", 23-25 июля 2010, Санкт-Петербург, с. 17
30. Беришвили, характеристика отечно-инфильтративной формы рака молочной железы / , , // VII международная конференция "Проблемы диагностики и лечения рака молочной железы", 23-25 июля 2010, Санкт-Петербург, с. 17
31. Беришвили, в аксиллярных лимфатических узлах, как проявление скрытого рака молочной железы / , , // VII международная конференция "Проблемы диагностики и лечения рака молочной железы", 23-25 июля 2010, Санкт-Петербург, с. 37
32. Беришвили, течения и исходов двухстороннего рака молочной железы / , , // VII международная конференция "Проблемы диагностики и лечения рака молочной железы", 23-25 июля 2010, Санкт-Петербург, с. 37
33. Беришвили, эндохирургии в комплексном лечении рака молочной железы / , , // VII международная конференция "Проблемы диагностики и лечения рака молочной железы", 23-25 июля 2010, Санкт-Петербург, с. 38
34. Беришвили, особенности вторичной отечно-инфильтративной формы рака молочной железы (ОИФ РМЖ) / , , // Анналы хирургии, 2010, №6, с. 35-41
35. Беришвили, факторы прогноза общей выживаемости (ОВ) больных отечно-инфильтративной формой рака молочной железы (ОИФ РМЖ) / , , // Анналы хирургии, 2011, №1, с. 25-29

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 |




