Следует подчеркнуть, что сочетания вышеуказанных режимов встречались в,6%) и,4%) случаях соответственно.
Гормонотерапию получали%) больных первичной ОИФ РМЖ и%) больные вторичной ОИФ РМЖ. Предоперационная лучевая терапия на молочную железу и зону регионального метастазирования в дозе 50-70 Гр проводилась у%) и %) больных первичной и вторичной ОИФ РМЖ соответственно.
Адьювантную химиотерапию получали,8%) больных первичной и ,4 %) больных вторичной ОИФ РМЖ. Их распределение представлено в таблице 4.
Таблица 4
Варианты адьювантной химиотерапии больных первичной и вторичной ОИФ РМЖ
Химиотерапия | Первичная ОИФ РМЖ | Вторичная ОИФ РМЖ |
С включением антрациклинов | 8 (13,6%) | 59 (24,6%) |
С включением CMF | 11 (18,6%) | 22 (9,2%) |
С включением препаратов платины | 1 (1,7%) | 7 (2,9%) |
С включением таксанов | 4 (6,8%) | 13 (5,4%) |
Навельбин/Митоксантрон | 2 (3,4%) | 5 (2,1%) |
Высокодозная ХТ | 2 (3,4%) | 4 (1,7%) |
Другие режимы | 1 (3,7%) | 4 (1,7%) |
Примечание. CMF – циклофосфан / метотрексат / 5-фторурацил, высокодозная ХТ – циклофосфан / карбоплатин / Тио-Тэф с трансплантацией полученных ранее аутологичных клеток предшественников гемопоэза.
Сочетание различных режимов химиотерапии отмечено в 2 (3,4%) и 5 (2,1%) случаях соответственно.
Послеоперационная лучевая терапия на послеоперационный рубец и зоны регионального метастазирования проводилась 3 (5%) больным и%) больной первичной и вторичной ОИФ РМЖ соответственно.
Совместно с лабораторией иммунологии гемопоэза НИИ КО РОНЦ им. РАМН (рук. – проф. ) нами проведено проспективное исследование иммунофенотипа ОИФ РМЖ, куда вошла 31 пациентка, получавшая терапию в данном лечебном учреждении с 2006 по 2008 г. Исследование проведено с использованием панели отечественных и зарубежных моноклональных антител (МКА).
Срезы опухолей молочных желез фиксировали в ацетоне. Отмывали в среде минут. Затем наносили ФИТЦ - меченные антисыворотки или МКА и инкубировали 30 минут. Отмывали в среде минут. Клетки консервировали 50% глицерином на физиологическом растворе и учитывали специфическое свечение на люминисцентном микроскопе.
При иммунофенотипировании выделяли 3 типа взаимодействия антител с опухолевыми клетками:
Отрицательная реакция (-) - менее 10% антигенположительных опухолевых клеток.
Мозаичная реакция (+/-) - антиген присутствовал на части (от 10% до 80%) опухолевых клеток.
Мономорфная реакция (+) - антиген экспрессируется большинством (более 80%) опухолевых клеток.
При иммунофенотипировании иммунокомпетентных клеток в гистологических срезах опухоли выделяли 3 типа иммунных реакций:
Отрицательная реакция - антигенположительные клетки не определяются или определяются небольшое их количество в препарате.
Умеренная реакция - умеренное количество антигенположительных клеток, расположенных разрозненно или мелкими группами.
Выраженная реакция - множество антигенположительных клеток в срезе, могут встречаться крупные группы и инфильтраты из этих клеток.
Исследование костного мозга для выявления микрометастазов и изучения костномозгового кроветворения выполнено 19 больным ОИФ РМЖ. Для этого производилась пункция грудины или гребня подвздошной кости и аспирировалось 0,5-1 мл костного мозга для предотвращения его разбавления за счет периферической крови. Выделение клеток из костномозгового пунктата осуществлялось путем лизиса эритроцитов. Приготовление цитоцентрифужных препаратов осуществлялось на центрифуге. Перед постановкой реакции иммунофлюоресценции, клетки дополнительно фиксировали в 96* этаноле в течение 30 мин при температуре 4*С. Это производилось с целью повышения проницаемости мембраны клеток для моноклональных антител (МКА). При использовании FITC-меченых МКА ставили прямую реакцию иммунофлюоресценции. В качестве FITC-меченных антител использовали МКА САМ5.2 (Becton Dikinson, США). При использовании МКА к цитокератинам метастатические клетки легко обнаруживаются среди миелокариоцитов по наличию яркого специфического цитоплазматического флуоресцентного свечения.
Для оценки костномозгового кроветворения после подсчета костномозговых элементов двумя экспертами-гемоцитологами производился расчет миелограмм: индекс созревания эритрокариоцитов и нейтрофилов, лейкоэритробластическое соотношение.
Совместно с ПЭТ-центром НЦ ССХ им. для уточнения стадии опухолевого процесса проведено исследование в режиме «Whole body» 36 больных верифицированной ОИФ РМЖ с помощью ПЭТ с 18F-FDG (2-фтор-2-дезокси-D-глюкоза, меченная 18F). Исследование выполняли натощак при уровне глюкозы крови не более 6,6 ммоль / л. После внутривенного введения 18F-FDG активностью 350-370 МБк для снижения уровня фоновой активности проводили водную нагрузку (500-750 мл). Запись начинали после 60 мин после введения препарата. Исследование выполняли на позитронном эмиссионном томографе высокого разрешения «ECAT EXACT 47» фирмы Siemens. Запись изображения осуществляли по стандартному клиническому протоколу с продолжительностью эмиссионного скана 7 мин и трансмиссионного скана 3 мин. При необходимости проводили сканирование головного мозга через 30 мин после введения 18F-FDG активностью 150-200 МБк с 20-минутной записью эмиссионных данных.
Статистическая обработка данных выполнена с помощью электронных таблиц Microsoft Excel и пакета прикладных программ SPSS v.15.0. Анализ кривых выживаемости проводился методом Kaplan-Meier, сравнение кривых выживаемости проводилось методом log-rank. Для малых выборок и для типа распределения, отличного от нормального, достоверность различия средних оценивалась с помощью непараметрических критериев – медианного, Mann-Whitney U test. Сравнение больных, характеристик опухолей, распространенности заболевания и достоверность различий в изучаемых признаках оценивалась с помощью критерия χ², для малых выборок рассчитывался точный критерий Фишера. Меру линейной связи оценивали с помощью критерия корреляции Пирсона, коэффициента корреляции рангов Spearman. Статистическая независимость между прогностическими признаками оценивалась с помощью модели пропорциональных рисков Кокса. Достоверным считались различия с вероятностью не менее 95% (р<0,05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Клинико-морфологические и биологические особенности первичной и вторичной ОИФ РМЖ
Проведенный анализ среднего возраста больных в группах первичной и вторичной ОИФ РМЖ не выявил статистически достоверных различий (49,6±10,1 лет и 51,5±10,1 лет соответственно). В репродуктивном периоде находилась%) и%) пациенток, в менопаузе —%) и %) пациенток. Большинство больных имели беременности и рожали —%) и %) женщин, страдали бесплодием — 7 (12%) и%) женщин соответственно. Аборты в анамнезе имелись у%) и %) больных.
Распределение по стадиям также было сходным при первичной и вторичной ОИФ РМЖ и составило: T4N0M0 – 5 (8,5%) больных и 5 (2,1%) больных, T4N1-3M0 –,9%) больные и ,8%) больных, T4N1-3M1 –,6%) больная и,1%) больных соответственно.
Обращает на себя внимание тот факт, что более 90% больных уже имели изначально поражение региональных лимфатических узлов, а 35% больных в обеих группах на момент постановки диагноза уже имели отдаленные метастазы, что свидетельствует об агрессивном течении данного заболевания.
Наиболее часто отмечалось метастатическое поражение костей – в%) и%) случаях, реже - печени в 4 (7%) и%) и легких – в 5 (8%) и%) случаях у пациенток первичной и вторичной формой заболевания соответственно. Данные различия не носили принципиального характера в группах.
Частота поражения правой молочной железы составила 56% и 49%, а левой молочной железы – 44% и 51% соответственно в исследуемых группах и не отличалась статистически значимо.
На наш взгляд, интересные результаты получены при сравнительном анализе морфологических характеристик первичной и вторичной форм заболевания. По гистологическому строению в обеих группах преобладал ИПР (у%) и %) больных), реже встречался ИДР (у 4 (7%) и%) больной) и редкие формы рака (у 3 (5%) и 12 (5%) больных соответственно).
По степени дифференцировки опухоли в обеих группах чаще встречались низкодифференцированные новообразования, выявленные у%) и %) больных, реже встречались умеренно - (1 (4%) и%)) и высокодифференцированные новообразования (2 (8%) и%) больных).
И при первичной, и при вторичной форме ОИФ РМЖ чаще выявлялись рецепторнегативные по эстрогенам и прогестерону опухоли, обнаруженные у%) и %) больных, тогда как рецепторпозитивные опухоли по обоим видам рецепторов встречались всего у 4 (11%) и%), РЭ(+)РП(-) – у 3 (8%) и%), РЭ(-)РП(+) – у 6 (16%) и 16 (9%) больных соответственно.
Сравнительный анализ HER2/neu статуса больных первичной и вторичной ОИФ РМЖ затруднен ввиду малого количества больных в группах. Так, из 4 больных первичной ОИФ РМЖ 3 (75%) имели HER2/neu 3+, а 1 (25%) – 0, а из 34 больных вторичной ОИФ РМЖ%) имели 1+/2+, 9 (25%) – 3+, а%) больных – 0 баллов.
Таким образом, проведенный нами анализ основных клинико-морфологических и биологических признаков ОИФ РМЖ (средний возраст, менструальный статус, генеративная функция, распределение по стадиям, локализация и объем поражения, гистологическое строение опухоли, степень дифференцировки опухоли, рецепторный и HER2/neu статус) не выявил статистически достоверных различий между первичной и вторичной формой заболевания. Примечательно, что в обеих группах ОИФ РМЖ чаще встречаются ИПР, низкодифференцированные и рецепторнегативные опухоли, т. е. признаки, связанные с неблагоприятным прогнозом при других формах РМЖ.
Нами не выявлено статистически достоверных различий в вариантах лечения больных первичной и вторичной формой ОИФ РМЖ, включающих в себя трехкомпонентную (комплексную) терапию (ХТ или ГТ / Операция / ЛТ в различных очередностях) в 35% и 45% случаев, двухкомпонентную (комбинированную) терапию (ХТ или ГТ / Операция или ЛТ в различных очередностях) – в 33% и 32% случаев и, наконец, монотерапию (ХТ / ГТ или их сочетание) – в 32% и 23% случаев соответственно. Следует заметить, что сочетание системного (ХТ и/или ГТ) и локального (Операция и/или ЛТ) воздействия на опухоль отмечалось в 68% и 77%, а только системная терапия проводилась в 32% и 23% соответственно.
Анализируя проведенное лечение, а именно компонентность (комплексность) лечения, варианты хирургического лечения, схемы индукционной и адьювантной химиотерапии, лучевой и гормонотерапии, мы не выявили статистически достоверных различий между первичной и вторичной ОИФ РМЖ, что указывает на одинаковый подход к лечению данных групп больных.
Местные рецидивы заболевания отмечены у 28 (9,4%) больных, из них – у 6 (10%) больных первичной ОИФ и 22 (9%) больных вторичной ОИФ РМЖ (различия статистически не достоверны). Появление отдаленных метастазов отмечено у ,2%) больных, из которых,2%) больные имели первичную ОИФ РМЖ, а ,1%) – вторичную ОИФ РМЖ.
Одним из основных вопросов данного исследования явилось определение влияния формы заболевания на прогноз заболевания. Для этого была проанализирована БРВ и ОВ пациенток ОИФ РМЖ.
Средняя БРВ у пациенток с первичной ОИФ РМЖ (n=50) составила 57,0±9,8 мес. (ДИ 95%, 37,8-76,3 мес.) с медианой 22±4,4 мес. и 62,6±6,0 мес. (ДИ 95%, 50,8-73,4 мес.) с медианой 24±2,4 мес. у пациенток с вторичной ОИФ РМЖ (n=214) (р=0,12) (рис. 1).
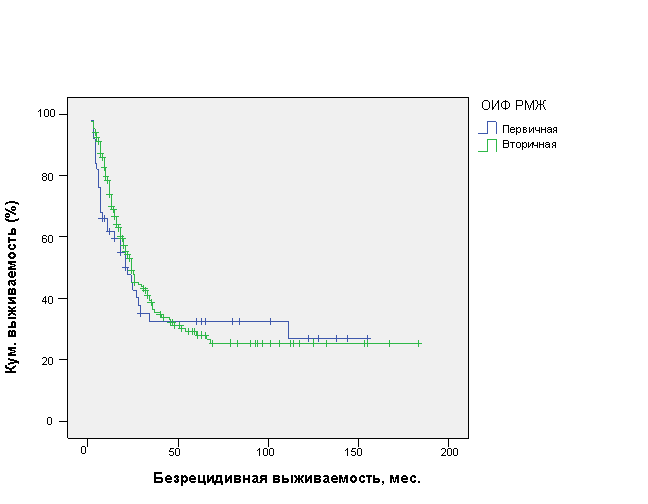

Рис. 1. Безрецидивная выживаемость больных первичной и вторичной ОИФ РМЖ.
Как наглядно видно из рис. 1, форма ОИФ РМЖ (первичная или вторичная) не влияла на БРВ данной категории больных. Результаты 3-, 5- и 10-летней БРВ больных ОИФ РМЖ представлены в таблице 5.
Таблица 5
БРВ больных ОИФ РМЖ в зависимости от формы заболевания
БРВ | Первичная ОИФ | Вторичная ОИФ | р |
3-летняя | 29,5% | 29,9% | 0,7 |
5-летняя | 24,1% | 15,4% | 0,1 |
10-летняя | 12,2% | 4,1% | 0,07 |
Аналогичная тенденция отмечена и для ОВ. Анализ ОВ больных первичной и вторичной ОИФ РМЖ показал, что форма заболевания не оказывает статистически достоверного влияния на ОВ данной категории больных, составив 64,3±8,7 мес. (ДИ 95%, 47,3-81,2 мес.) с медианой 47±22,1 мес. и 71,7±5,5 мес. (ДИ 95%, 60,9-82,5 мес.) с медианой 39±2,9 мес. соответственно (р=0,53) (рис. 2).
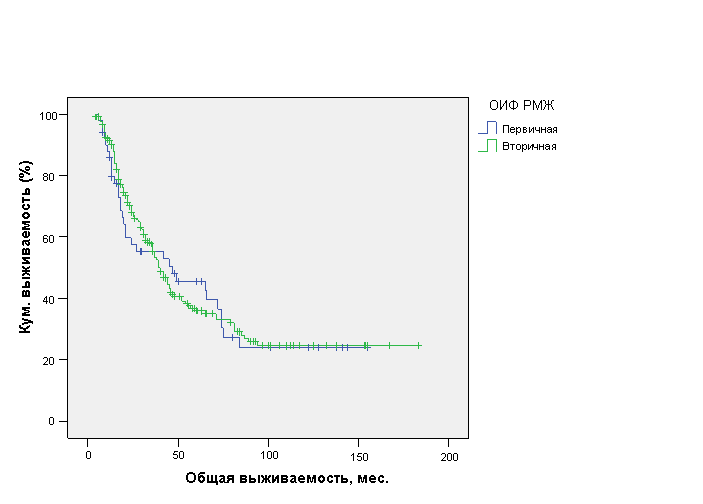

Рис. 2. Общая выживаемость больных первичной и вторичной ОИФ РМЖ
Детальный анализ результатов 3-, 5- и 10-летней ОВ больных ОИФ РМЖ показывает четкое снижение выживаемости в обеих группах с увеличением срока наблюдения.
Таблица 6
ОВ больных ОИФ РМЖ в зависимости от формы заболевания
ОВ | Первичная ОИФ | Вторичная ОИФ | Р |
3-летняя | 52,3% | 52,9% | 0,9 |
5-летняя | 40,5% | 28,2% | 0,1 |
10-летняя | 15,8% | 6,1% | 0,07 |
Подводя итог сказанному выше, следует отметить, что нами не выявлено достоверных различий в клинико-морфологических и биологических особенностях (возраст, менструальный статус, степень распространенности опухолевого процесса, гистологическое строения опухоли, степень дифференцировки опухоли, рецепторный статус опухоли, эффект и варианты лечения) первичной и вторичной ОИФ РМЖ. Более того, нами не получено различий в результатах безрецидивной и общей выживаемости данных групп больных, что позволило прийти к выводу о нецелесообразности разделения ОИФ РМЖ на подгруппы и необходимости проведения дальнейшего анализа прогностических признаков для ОИФ РМЖ в целом.
Безрецидивная выживаемость больных ОИФ РМЖ
Средняя БРВ в исследовании составила 63,3±5,4 мес. (ДИ 95%, 52,8-73,8 мес.) с медианой 24±1,7 мес.
Влияния статуса региональных лимфатических узлов на БРВ больных ОИФ РМЖ выявить не удалось. Проведенный анализ показал, что у больных с T4N0M0 (n=10) средняя БРВ составила 71,9±22 мес. (ДИ 95%, 28,7-115,1 мес.), медиана не достигнута, а у больных с T4N1-3M0 (n=158) средняя БРВ составила 69,8±6,8 мес. (ДИ 95%, 56,5-83,2 мес.) с медианой 24±3,5 мес. (р=0,12). Следует отметить, что окончательный анализ затруднен ввиду малого числа больных с T4N0M0 стадией заболевания.
Анализ таких признаков как менструальный или репродуктивный статус, наличие или отсутствие абортов, размер опухоли у больных вторичной ОИФ РМЖ, объем опухолевого поражения, отек кожи, PEV статус не выявил их прогностического влияния на БРВ больных ОИФ РМЖ.
Статистически значимые различия в кривых БРВ наблюдались в зависимости от гистологического строения опухоли. При ИПР (n=105) средняя БРВ составила 75,5±8,9 мес. (ДИ 95%, 58,1-92,9 мес.) с медианой 33±8,9 мес. и была достоверно лучше, чем при ИДР (n=,4±8,0 мес. (ДИ 95%, 31,7-63,2 мес.) с медианой 35±4,4 мес. и при редких формах рака и раке без указания формы (n=1,6±6,3 мес. (ДИ 95%, 33,3-57,8 мес.) с медианой 18±2,1 мес. (р=0,013) (рис. 3).
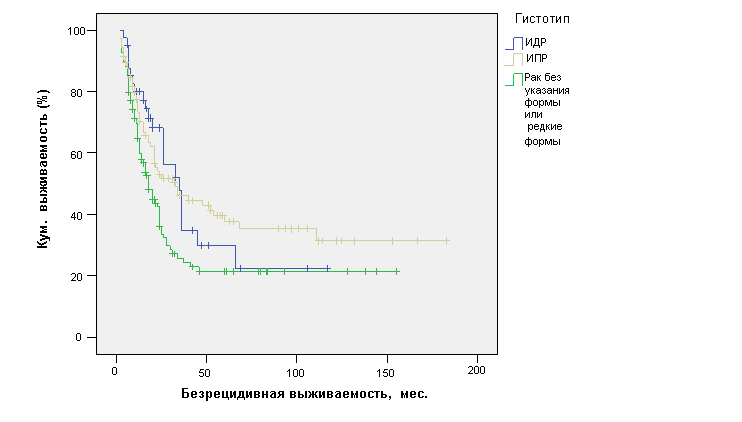

Рис. 3. Безрецидивная выживаемость больных ОИФ РМЖ в зависимости от гистологического строения опухоли.
Кривые БРВ в зависимости от степени дифференцировки опухоли статистически значимо не различались, хотя определенная тенденция роста средней БРВ от низко - к высокодифференцированным опухолям прослеживается.
Большой интерес в настоящее время прикован к рецепторному статусу опухоли, поскольку он является одним из проявлений биологических характеристик опухоли, однако он не оказывал прогностического влияния на БРВ больных ОИФ РМЖ (р=0,32).
Эффект от лечения является признанным фактором, определяющим прогноз РМЖ. Поэтому он также был включен в проведенный анализ. Установлено, что у больных с полным эффектом (ПЭ) (n=28) средняя БРВ составила 94,3±11,8 мес. (ДИ 95%, 71,3-117,3 мес.), медиана не достигнута, у больных с частичным эффектом (ЧЭ) (n=57) – 81,4±10,3 мес. (ДИ 95%, 61,1-101,6 мес.) с медианой 46±8,6 мес., у больных со стабилизацией (n=84) – 74,4±10,4 мес. (ДИ 95%, 54,1-94,7 мес.) с медианой 28±4,3 мес. по сравнению с 17,1±2,1 мес. (ДИ 95%, 13,0-21,2 мес.) с медианой 11±1,5 мес. у больных с прогрессированием (n=95) (р=0,0001) (рис. 4).
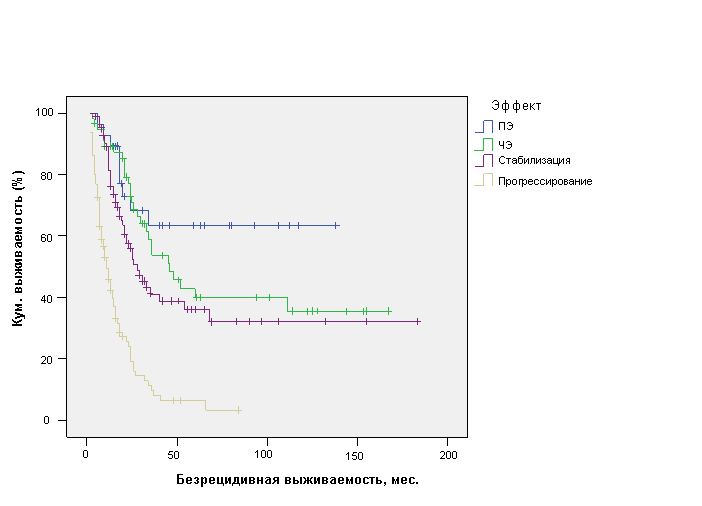

Рис 4. Безрецидивная выживаемость больных ОИФ РМЖ в зависимости от эффекта лечения.
Полученные при однофакторном анализе данные наглядно демонстрируют статистически значимые различия в БРВ пациенток с ПЭ, ЧЭ и стабилизацией по сравнению с прогрессированием основного заболевания, что указывает на эффект от лечения как еще один фактор прогноза БРВ больных ОИФ РМЖ.
Статистически значимого влияния различных режимов химиотерапии на длительность безрецидивного периода нами не установлено (р=0,99). Однако выявлена определенная тенденция к росту средней БРВ при включении в схему лечения антрациклинов, но для окончательных выводов необходим дополнительный набор больных в группы с другими режимами химиотерапии (таксанов, производных платины и т. д.).
При многофакторном анализе БРВ, включающем в себя менструальный статус, гистологическое строение опухоли, PEV статус, эффект от лечения, схемы химиотерапии выявлено наличие статистически значимого влияния только показателя эффекта от лечения (р=0,0001).
Важное значение комплексного подхода к лечению больных ОИФ РМЖ установлено при анализе различных вариантов лечения данной патологии. При применении однокомпонентного лечения в виде системной терапии (химиотерапии или гормонотерапии) (n=60) средняя БРВ составила 26,1±4,1мес. (ДИ 95%, 18,2-34,1 мес.) с медианой 13±4,1 мес., при применении двухкомпонентного лечения в виде химиотерапии / гормонотерапии и операции или лучевой терапии (n=82) средняя БРВ составила 44,4±7,2 мес. (ДИ 95%, 30,3-58,5 мес.) с медианой 18±3,1 мес., а при применении комплексного трехкомпонентного лечения в виде химиотерапии / гормонотерапии и операции и лучевой терапии (n=122) средняя БРВ составила 78,1±8,0 мес. (ДИ 95%, 62,4-93,8 мес.) с медианой 34±6,9 мес. (р=0,0001) (рис. 5).
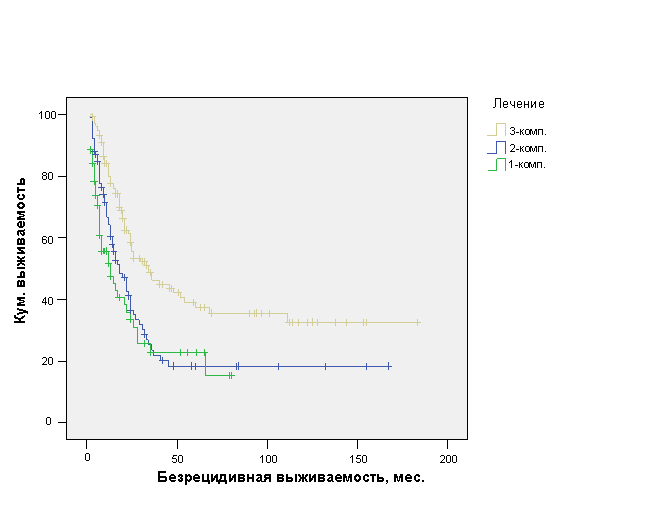

Рис. 5. Безрецидивная выживаемость больных ОИФ РМЖ в зависимости от компонентности (комплексности) лечения.
Таким образом, только применение трехкомпонентного лечения позволяет добиться статистически достоверно лучшей БРВ у пациенток ОИФ РМЖ по сравнению с одно - и двухкомпонентным лечением.
Следует уточнить, что компонентность лечения (одно-, двух - или трехкомпонентное) определялась не изначально, а в результате оценки эффекта от лечения. В частности, при отсутствии местного эффекта от химиотерапии проводилась лучевая терапия, при появлении отдаленных метастазов часто производилась смена режима химиотерапии, а при наличии эффекта от химиотерапии выполнялась операция, т. е. трехкомпонентное лечение проводилось у больных, ответивших на лечение, а у прогрессирующих больных лечение чаще включало химиотерапию или химиолучевую терапию.
Таким образом, проведенное исследование позволило выявить наиболее информативные признаки, однако ни один из них не может самостоятельно определить прогноз течения ОИФ РМЖ. Нами разработаны решающие правила, позволяющие индивидуализировать прогноз течения данного заболевания (табл. 7).
Таблица 7
Решающее правило для прогноза течения ОИФ РМЖ
Наименование признака | Градация | Коэффициент веса |
1.Гистотип | ИПР ИДР Редкие формы | 122 -86 -91 |
2.Эффект от лечения | Полный Частичный Стабилизация Прогрессирование | 140 119 89 -126 |
3.Вариант лечения | Трехкомпонентное Двухкомпонентное Однокомпонентное | 111 88 -94 |
Каждый признак имеет свой прогностический коэффициент. Для удобства в работе правило преобразовано к значению порога, равное нулю. Если сумма коэффициентов решающего правила меньше нуля, вероятность возникновения в дальнейшем рецидива или прогрессирования заболевания составляет 83,1%. Если же сумма коэффициентов больше нуля, то вероятность благоприятного прогноза в отношении прогрессирования основного заболевания или развития рецидива составляет 81,7%.
Трехлетняя БРВ в проведенном исследовании составила 29,8%, 5-летняя БРВ – 19,3% и 10-летняя БРВ – 6,5%.
Общая выживаемость больных ОИФ РМЖ
В проведенном исследовании средняя ОВ составила 71,6±4,9 мес. (ДИ 95%, 61,9-81,1 мес.) с медианой 42±2,9 мес.
Правильная постановка стадии заболевания имеет принципиальное значение для прогноза ОИФ РМЖ. В частности, ОВ у пациенток с T4N0-3M0 (n=168) составила 86,3±6,6 мес. (ДИ 95%, 73,4-99,1 мес.) с медианой 45±8,5 мес., тогда как у пациенток с T4N0-3M1 (n=96) - только 42,1±3,8 мес. (ДИ 95%, 34,6-49,5 мес.) с медианой 32±6,3 мес. (р=0,001) (рис. 6).
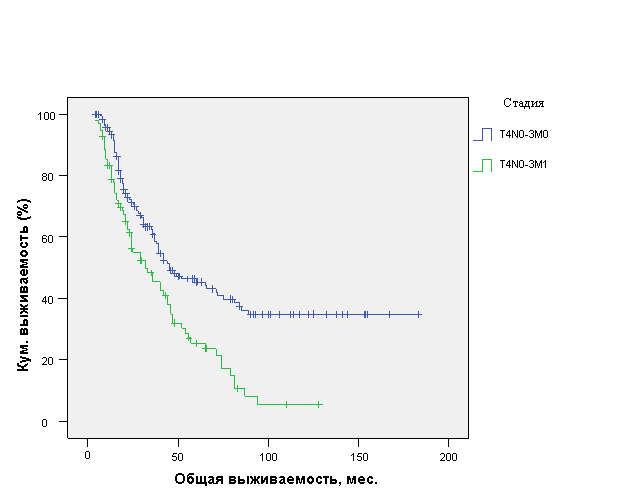

Рис. 6. Общая выживаемость больных ОИФ РМЖ в зависимости от стадии заболевания.
Как видно из рис. 6, пациентки с IIIВ стадией заболевания имели достоверно лучшие результаты ОВ по сравнению с пациентками с IV стадией. Это позволило определить стадию заболевания как важный фактор прогноза ОИФ РМЖ.
В современной литературе имеются указания о влиянии статуса региональных лимфатических узлов на ОВ больных РМЖ. С целью определения значения данного фактора нами изучена ОВ 10 больных с T4N0M0 и 158 больных с T4N1-3M0: средняя ОВ составила 82,4±21,5 мес. (ДИ 95%, 40,3-124,6 мес.), медиана не достигнута и 85,2±6,7 мес. (ДИ 95%, 72,1-98,4 мес.) с медианой 45±8,7 мес. (p=0,14). Полученные результаты не подтвердили прогностическое значение поражения региональных лимфатических узлов (различия статистически незначимы), но возможно большее количество больных в подгруппах позволит осветить этот вопрос более точно.
Такие клинические признаки как менструальный и репродуктивный статус, наличие или отсутствие абортов, объем опухолевого поражения, размер опухолевого узла у больных вторичной ОИФ РМЖ, наличие или отсутствие отека кожи, PEV статус не оказывали статистически значимого влияния на ОВ больных ОИФ РМЖ.
Гистологическое строение опухоли оказалось фактором, статистически значимо влияющим на ОВ больных ОИФ РМЖ. При ИПР (n=105) средняя ОВ составила 95,1±8,8 мес. (ДИ 95%, 77,8-112,3 мес.) с медианой 71±18,6 мес., при ИДР (n=41) – 59,4±8,1 мес. (ДИ 95%, 43,4-75,4 мес.) с медианой 42±6,6 мес., а для редких форм рака и рака без указания формы (n=109) – 50,1±5,3 мес. (ДИ 95%, 39,7-60,5 мес.) с медианой 29±4,2 мес. (р=0,001) (рис. 7).
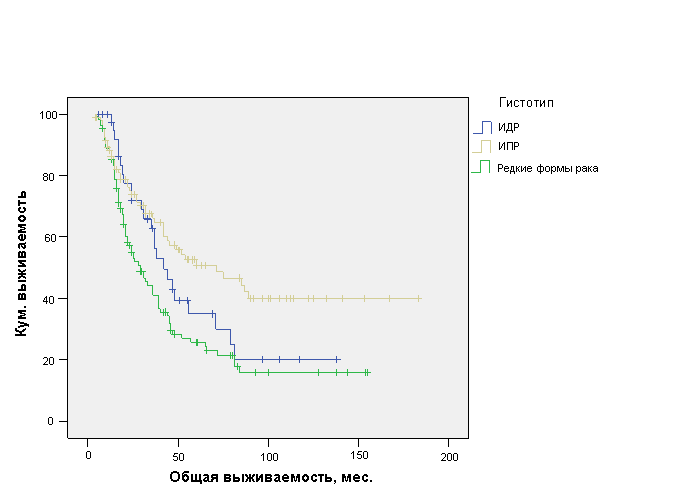

Рис. 7. Общая выживаемость больных ОИФ РМЖ в зависимости от гистологического строения опухоли.
Как видно из рис. 7, ИПР характеризуется достоверно лучшей ОВ по сравнению с ИДР и редкими формами рака, что позволяет отнести гистологическое строение опухоли к факторам прогноза ОВ больных ОИФ РМЖ.
В проведенном исследовании ОВ в зависимости от степени дифференцировки опухоли статистически значимо не отличались, хотя отмечается тенденция к росту ОВ с ростом степени дифференцировки опухоли.
Рецепторный статус, как и в случае с БРВ, не оказывал прогностического влияния на ОВ больных ОИФ РМЖ (р=0,49).

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 |




