При осуществлении ухода за лихорадящим пациентом важно корректное управление процессом радиации. Два основных элемента: укрывание и ограничение теплоотдачи, и раскрывание и усиление теплоотдачи, будут зависеть от стадии или клинического варианта лихорадки.
В первой стадии (повышение температуры) или при "бледной" лихорадке ребёнок ощущает холод (эквивалент у детей младшего возраста – беспокойство), что является результатом уменьшения кожного кровотока, с последующим охлаждением кожи под влиянием температуры окружающего воздуха. В данной ситуации физиологически обоснованным является согревание: на ребёнка надевают тёплую одежду, укрывают одеялом, дают теплое питье. Цвет и влажность кожи, а так же ощущения ребёнка рекомендуется оценивать каждые 10-20 минут. Как правило, через указанный интервал времени кожа становится розовой, влажной, теплой, исчезает феномен "мраморности".
Во второй стадии и/или при "розовой" лихорадке от эффективной площади теплоотдачи (оголенной кожи) будет зависеть температура тела ребёнка. Следовательно, рекомендуется использовать минимум одежды, а во время сна (по необходимости) использовать для укрывания только тонкую однослойную простыню.
Пожалуй, единственным из широко применяемых способов физического охлаждения, способным действовать на процессы внутреннего теплопереноса, является "охлаждение на протяжении". Прикладывание пузыря со льдом в проекции крупных сосудов способствует снижению температуры протекающей в них крови. Модификацией способа является введение холодной жидкости ректально в клизме. Способ может быть достаточно эффективным для снижения температуры тела, но субъективно плохо воспринимается ребёнком. Мы сомневаемся в его полезности для детей с лихорадкой и рекомендуем использовать исключительно при ГТ.
Модификацию способа с ректальным введением жидкости не рекомендуется использовать вовсе, если речь идет о гипоосмотической жидкости (вода "из крана") или применять его как способ резерва, при недоступности/неэффективности других способов (необходимо использовать физиологический раствор).
Самым эффективным способом физического охлаждения при повышении температуры тела у ребенка, вне зависимости от причины, ее вызвавшей, является общее охлаждение в ванной с постепенным понижением температуры воды. Он связан с контактной потерей тепла, что дает возможность за короткий период времени существенно снизить температуру тела. Как правило, процедура начинается при температуре воды в 37-37,5ºС, а заканчивается при температуре 33-34ºС. Модификацией способа является обёртывания влажной простыней. Особенно "варварской" данная методика становится, если в качестве жидкости предлагается уксус [65]. Мы не рекомендуем использовать данный способ ни в одном из вариантов – ни с холодной водой, ни, тем более с уксусом!
Фармакологический или медикаментозный метод снижения температуры тела у детей с лихорадкой заключается в назначении жаропонижающих препаратов и вспомогательных лекарственных средств.
Почти все "классические" антипиретики относятся к группе нестероидных противовоспалительных средств (НПВС). Исключение составляет только парацетамол. Считается, что данные препараты, как и способы физического охлаждения, не действуют на процессы теплопродукции, а способствуют усилению теплоотдачи. Механизм действия НПВС стал известен в 1971 году благодаря работам Дж. Вейна. В его основе лежит ингибирование фермента циклооксигеназы, и подавление синтеза простагландинов. Жаропонижающее действие НПВС связано с их влиянием на изофермент ЦОГ (ЦОГ-2), который синтезируется в условиях патологии (воспаления). Этим объясняется отсутствие жаропонижающего действия НПВС при нелихорадочном повышении температуры тела (например, при гипертермии, патологии эндокринной системы) [18, 75].
В нашей стране в качестве антипиретиков у детей в основном используются следующие препараты: ацетилсалициловая кислота, ибупрофен, метамизол натрия, нимесулид, парацетамол.
По способности ингибировать различные изоферменты ЦОГ (1 и 2) препараты разделяются на селективные и неселективные НПВС, спор о плюсах и минусах которых не утихает до настоящего времени. За редким исключением (нимесулид) антипиретики, рекомендованные детям, являются неселективными НПВС. Эксперты ВОЗ и многие отечественные рекомендации предлагают использовать в качестве препаратов выбора парацетамол и ибупрофен [1, 4, 5, 6, 10, 11, 15]. Большинство публикаций по антипиретической терапии посвящено спору о преимуществах и недостатках именно этих двух препаратов.
Аргументы в пользу парацетамола в противовес ибупрофену и наоборот носят преимущественно соревновательный конкурентный коммерческий характер, и оба препарата имеют достаточно высокий уровень безопасности и приемлемый уровень эффективности [77, 89, 107, 108, 109, 112].
Парацетамол – производное парааминофенола, активный метаболит фенацетина. Основным отличием парацетамола от препаратов группы НПВС является практически полное отсутствие у него противовоспалительной активности. Данное обстоятельство объясняется его низким сродством к ЦОГ в условиях высокой концентрации перекисей, наблюдаемой в очаге воспаления. Жаропонижающее и обезболивающее действие парацетамола объясняется ингибированием ЦОГ в головном мозге, где перекисей мало [18]. Парацетамол, в отличие от НПВС, не нарушает активацию нейтрофилов [18,75]. Он не влияет на дыхательную систему, не нарушает водно-электролитного и кислотно-щелочного равновесия, не вызывает раздражение слизистой оболочки ЖКТ, не влияет на свертываемость крови.
При приёме внутрь препарат быстро и почти полностью всасывается, максимальная концентрация в сыворотке крови достигается через 30-60 минут, Т½ составляет 1-4 часа [128, 129, 131]. У парацетамола, так же как у других препаратов, существует прямая зависимость выраженности и продолжительности жаропонижающего действия от величины применяемой дозы.
Парацетамол рекомендуется ВОЗ как жаропонижающее средство выбора у детей, и может применяться, начиная с 1-го месяца жизни [5, 128, 129, 131]. Парацетамол хорошо переносится и в рекомендованных дозах редко вызывает побочное действие, однако возможны тошнота, рвота, боль в эпигастрии, аллергические реакции (кожная сыпь, зуд, крапивница, отек Квинке); редко – анемия, тромбоцитопения, лейкопения [128, 129, 131]. Имеется значительный интервал между терапевтической и токсической дозой – более 10 раз. Между величиной данного интервала и возрастом ребенка имеется обратная зависимость, что связано с особенностями метаболизма парацетамола. У детей в возрасте до 9-12 лет преобладает сульфатирование парацетамола, а в более старшем возрасте – глюкуронирование. Сульфат парацетамола значительно менее токсичен, чем конъюгированный глюкуронид [5]. Токсическое действие препарата проявляется при приеме его в дозе около 150 мг/кг для взрослых и около 200 мг/кг для детей младше 9-12 лет [17, 76]. Однако в некоторых случаях применение парацетамола в терапевтической дозе (или несколько большей) сопровождается повышением содержания в крови аминотрансфераз [118, 123]. Парацетамол единственный антипиретик, имеющий специфический антидот (ацетилцистеин), который может быть использован при передозировке [17].
В последнее время все чаще публикуются результаты клинических исследований, выявивших повышенный риск формирования атопических заболеваний, в том числе бронхиальной астмы у детей раннего возраста, принимавших парацетамол. Нельзя исключить, что и препараты группы НПВС действуют аналогично. Вероятно, что подобные осложнения возникают в результате избирательного ингибирования обмена арахидоновой кислоты, с его переключением на липоксигеназный путь (образование большого количества лейкотриенов) [18, 78, 95, 98, 106, 113].
Ибупрофен – производное пропионовой кислоты, обратимый неселективный ингибитор ЦОГ. По силе своего противовоспалительного, обезболивающего и жаропонижающего действия сходен с аспирином, однако лучше переносится пациентами, чем аспирин. Учитывая, что ибупрофен, как и ацетилсалициловая кислота, оказывает периферическое и центральное действие на ЦОГ, то спектр побочных реакций у данных препаратов схожий. Профиль безопасности ибупрофена выше, чем у ацетилсалициловой кислоты, но несколько ниже, чем у парацетамола [18]. Поэтому ВОЗ рекомендует для детей ибупрофен в качестве антипиретика второго ряда [5].
Ибупрофен быстро всасывается при приеме внутрь, максимальная концентрация в сыворотке крови достигается через 45 минут, Т½ составляет 1-4 часа. Назначается только энтерально. До недавнего времени возможен был только прием через рот, но в настоящее время появились лекарственные формы для ректального введения. На момент выхода данной монографии доступны были лишь суппозитории с содержанием ибупрофена 60 мг в каждом, что не совсем удобно для детской практики. Возможно применение с возраста от 3 месяцев [128, 129, 131].
Ибупрофен может стать альтернативой в тех случаях, когда другие НПВС вызывают побочное действие со стороны ЖКТ. Интервал между терапевтической и токсической дозой у ибупрофена самый широкий. Так, если токсические эффекты ацетилсалициловой кислоты проявляются при ее концентрации в плазме крови равной 0,5 мкг/мл, парацетамола от 50 мкг/мл, то у ибупрофена от 300 мкг/мл. Важно так же, что при передозировке ибупрофена не развиваются необратимые изменения внутренних органов (в том числе и печени) [17, 18].
В настоящее время в нашей стране зарегистрирован как минимум один препарат, содержащий парацетамол и ибупрофен (Ибуклин) [131]. В нескольких исследованиях показана достоверно большая эффективность такого сочетания антипиретиков, в сравнении с монотерапией каждым препаратом в отдельности [84, 107, 116]. Отмечено так же, что комбинированное применение ибупрофена и парацетамола экономически более выгодно, чем монотерапия каждым препаратом в отдельности [90].
Комбинированное назначение ибупрофена и парацетамола не должно быть рутинной практикой, использование основных антипиретиков возможно не одномоментно, а последовательно, в случае необходимости (неэффективности монотерапии) [86, 119].
Ацетилсалициловая кислота (аспирин) – сложный эфир салициловой и уксусной кислоты. История применения данного препарата самая длительная среди всех НПВС. Его действующим началом является салициловая кислота, оказывающая выраженное противовоспалительное, обезболивающее и жаропонижающее действие. В отличие от остальных НПВС, ацетилсалициловая кислота ингибирует ЦОГ необратимо. При этом нарушается образование как ЦОГ-2, так и ЦОГ-1, что определяет многие побочные эффекты.
Ацетилсалициловая кислота быстро снижает температуру тела при лихорадке, но одновременно повышает потребление кислорода и усиливает обмен веществ. Данный эффект связан с тем, что салицилаты разобщают окисление и фосфорилирование и могут подавлять различные АТФ-зависимые реакции. В токсических дозах салицилаты подавляют аэробный метаболизм. Повышение потребности в кислороде и увеличение концентрации СО2 стимулируют дыхание. Данный эффект усиливается непосредственным стимулирующим влиянием салицилатов на дыхательный центр продолговатого мозга. В результате развивается гипервентиляция с увеличением глубины дыхания и особенно частоты дыхательных движений.
В терапевтических дозах салицилаты вызывают кислотно-щелочные и электролитные нарушения. В начале их действия развивается дыхательный алкалоз, вызывающий усиление выведения почками бикарбоната, ионов натрия, калия и воды. При лихорадке вода теряется так же из-за усиления потоотделения и тахипноэ. В итоге при использовании салицилатов у детей возможно развитие обезвоживания. Учитывая, что потери воды опережают потери натрия, развивается гипернатриемия. Последнее обстоятельство может определить парадоксальное повышение температуры тела при передозировке салицилатов.
Ацетилсалициловая кислота удлиняет время кровотечения, что связано с необратимым ацетилированием ЦОГ тромбоцитов и нарушением синтеза тромбаксана А2. Она также способна ингибировать синтез протромбина в печени, в результате чего увеличивается протромбиновое время [18]. Данные изменения сохраняются до образования новых тромбоцитов (около 7 дней) и могут стать причиной носовых кровотечении и развития петехиальных кровоизлияний в кожу и слизистые оболочки у детей [3, 5]. Однако в педиатрической практике основной, сдерживающей применение ацетилсалициловой кислоты причиной является возможность развития синдрома Рея [1, 3, 5, 9].
При приёме внутрь ацетилсалициловая кислота быстро всасывается: Cmax достигается через 30 минут, Т½ составляет 2-3 часа (для салицилата). Средние рекомендуемые для детей дозы составляют 50-75 мг/кг/сут, разделенные на 4-6 приемов [131].
В настоящее время ацетилсалициловая кислота противопоказана при острых респираторных вирусных заболеваниях и ветряной оспе у пациентов моложе 15 лет (решение президиума Фармакологического государственного комитета РФ от 01.01.2001 года).
Некоторые производители препаратов, содержащих ацетилсалициловую кислоту, в противопоказаниях указывают: "детский возраст до 15 лет в качестве жаропонижающего средства", т. е. без учёта заболевания, ставшего причиной лихорадки [128, 131].
Нимесулид относится к сульфонанилидам, селективным ингибиторам ЦОГ-2. Обратимо блокирует образование простагландинов как в очаге воспаления, так и в восходящих путях спинного мозга. Как и другие НПВС, изменяет свертываемость крови. Есть данные, свидетельствующие о наличии у нимесулида антигистаминной активности. Ингибирует образование ФНО-α, металлопротеаз и миелопероксидазы.
Целесообразность использования нимесулида для детей до сих пор активно обсуждается медицинским сообществом [14, 33, 46, 59, 61, 91, 95, 120]. Нимесулид был выпущен на фармацевтический рынок только в 1985 году и его изучение продолжается. Он не был разрешен к применению детям во многих странах Европы, а в США, вообще не был зарегистрирован FDA. Ситуация с разрешением на использование нимесулида для детей в нашей стране неоднозначная. На сайте ФГУ "Научный Центр Экспертизы средств медицинского применения" [128] в материалах, посвящённых суспензии нимесулида присутствует противопоказание – "детский возраст до 12 лет". В одном из фармацевтических справочников [129] приводится ограничение по возрасту – 7 лет, в другом – 2 года [131]. Мы считаем, что при назначении нимесулида следует руководствоваться регламентацией первого источника [128] и применять препарат только у детей старше 12 лет.
При приёме внутрь нимесулид хорошо всасывается. Назначается из расчета 3-5 мг/кг в сутки, разделенные на 2-3 приема. Cmax плазме крови достигается через 1,5-2,5 часа, Т½ около 1,5-4,5 часов [128, 131]. Из побочных явлений наиболее серьезным является токсический фульминантный гепатит.
Метамизол натрия (анальгин) – производное пиразолона, неселективный обратимый ингибитор ЦОГ, преимущественно периферического действия. МН, как и ацетилсалициловая кислота, имеют давнюю историю использования. На фармацевтическом рынке он представлен с 1921 года, и широко использовался, как безрецептурный препарат. Начиная с 60-х годов 20-го столетия, появляются сведения о серьёзных осложнениях приёма МН. В 1986 году были опубликованы результаты международного исследования, показавшего, что частота развития агранулоцитоза при приёме МН составляет 1:20 000. Важной особенностью развития агранулоцитоза при использовании МН является то, что возможность его развития не удается предусмотреть и предупредить, он может проявиться уже через несколько часов после приема препарата [67].
По данным шведского агентства по лекарственным средствам, частота агранулоцитоза, ассоциированного с МН, составляет 1:1 439 [5].
В большинстве стран, запретивших или существенно ограничивших применение препарата, учитывалось в первую очередь его миелотоксическое действие. Однако исследования, проведенные в Германии, показали, что частота развития такого осложнения, как сосудистый шок, встречается при использовании МН примерно в 10 раз чаще, чем агранулоцитоз [5, 67]. Смертность при развитии данного осложнения составляет 30-50%. Быстрота, выраженность и "необратимость" шока при использовании препарата объясняется его разрушающим действием на клетки эндотелия сосудов. По-видимому, тот же механизм лежит в основе выраженного и быстрого снижения температуры тела у детей, являющегося частью клинической картины коллапса. Как и другие производные пиразолона, МН может вызвать тяжёлые кожные осложнения – синдрома Лайелла (токсический эпидермальный некролиз) и Стивенса – Джонса (злокачественная экссудативная эритема).
В последние годы число стран, в которых запрещается или существенно ограничивается использование МН, постоянно расширяется. Единственным регионом мира, где препарат продолжает широко использоваться, является Восточная Европа, включая страны бывшего Советского Союза. По данным (2003), около 20 % участковых педиатров рекомендуют МН в качестве антипиретика [5].
Применение МН запрещено в Канаде, Великобритании, США, Дании, Ирландии, Швеции, Норвегии, Саудовской Аравии, ОАЭ, Мексике, Малайзии, Пакистане, Нидерландах, Чехии, Словакии, Шри-Ланке, Бахрейне, Венесуэле, Непале, Йемене и ряде других стран. В таких странах как Израиль, Германия, Италия, Бельгия, Австралия, Испания, Филиппины, Кувейт, Судан, Бангладеш, Египет, Греция, Таиланд, Армения, Колумбия, Марокко, Литва и ряде других, применение его существенно ограничено [5,67]. К сожалению, в нашей стране МН de facto является основным антипиретиком для оказания помощи детям с лихорадкой на догоспитальном этапе [53].
Способ дозирования МН приведен в Приложении 1. Как показало наше исследование, в условиях СМП препарат назначается исключительно из расчета по 0,1 мл 50% раствора на год жизни ребенка [49, 53]. Таким же образом рекомендуется производить расчет анальгина во многих руководствах [1, 3, 13, 23, 28, 30, 42, 43, 45, 56, 64]. Обращаем внимание коллег, что данный "эмпирический" способ абсолютно не приемлем в детской практике! Простой расчет, показывает, что он обеспечивает систематическую передозировку анальгина, увеличивающуюся с возрастом.
Например, в 4 года ребенок весит в среднем около 16 кг, а в 6 лет – 20 кг. Если при расчете руководствоваться максимально рекомендованной производителем дозой 0,02 мл на кг массы тела, то ребенок 4-х лет должен получить 0,32 мл, а 6-ти лет – 0,4 мл. Согласно "эмпирическим" расчетам в первом случае ребенок получит 0,4 мл, а во втором – 0,6 мл. Как видно, во втором случае превышение МАКСИМАЛЬНО рекомендованной дозы составит 50%! На наш взгляд, именно в этой передозировке "секрет силы" анальгина. Аналогичный дозозависимый антипиретический эффект характерен для всех НПВС. Так, например, двукратное увеличение максимально рекомендованной дозы парацетамола (с 15 до 30 мг на кг массы тела) приводит к быстрому, длительному и знáчимому снижению температуры тела [121].
Помощь ребенку с лихорадкой необоснованно принято относить к разряду неотложной. В связи с чем, в нашей стране она оказалась прерогативой сотрудников Скорой помощи. В силу сложившихся традиций, проведение неотложной помощи бригадами СМП, осуществляется преимущественно с применением инвазивных манипуляций (парентерального введения антипиретика). В большинстве случаев инъекция не оправданна. Она всегда причиняет страдание и боль ребенку, сохраняющуюся на протяжении нескольких дней.
Парентеральное введение почти всегда подразумевает участие медицинского работника, а следовательно, повышает затраты на здравоохранение. Кроме того, любая инъекция делает значимым пресловутый человеческий фактор, тая потенциальную угрозу развития ятрогенных осложнений [49].
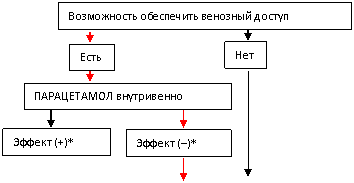
В настоящее время подобный подход определяет практически безальтернативный выбор антипиретика – МН. О возможности использования в данной ситуации парацетамола, как правило, забывают. Напомним, что в нашей стране зарегистрирован и разрешен к применению у детей старше 1 года препарат парацетамола для парентерального (внутривенного) введения – Перфалган [128, 129, 131]. Конечно, некоторые сложности: необходимость обеспечения венозного доступа и использование инфузионных систем, длительность введения (около 15 минут), не дают основания рекомендовать Перфалган для рутинного использования у всех пациентов с лихорадкой. Однако в случаях, когда жаропонижающая терапия сочетается с инфузионной, именно Перфалган (не МН!) является антипиретиком выбора.
К сожалению, в большинстве отечественных руководств по неотложной помощи детям на догоспитальном этапе имеется указание на необходимость парентерального введения метамизола натрия. Рекомендации по использованию парацетамола для парентерального введения нам не встречались. Подобный подход противоречит современным требованиям к оказанию помощи детям с лихорадкой, где во главу угла поставлено требование безопасности лекарственных средств и применяемых методик. В настоящее время только парацетамол и ибупрофен рекомендуется применять в качестве антипиретиков у детей [5].
Причиной, сдерживающей полное вытеснение МН как антипиретика и его замены ибупрофеном и парацетамолом, является мнение многих педиатров о недостаточной эффективности этих препаратов. Ошибочность данного мнения нам удалось показать в ходе исследования [49].
Как было сказано выше, в отечественной педиатрии принято выделять два клинических варианта лихорадки – "розовую" и "бледную". Такое деление в первую очередь обусловлено дифференцированным подходом к оказанию антипиретической помощи. Традиционно детям с "бледной" лихорадкой, кроме антипиретиков (НПВС), назначают "вазоактивные" препараты, возможно улучшающие периферический кровоток. Ретроспективный этап нашего исследования показал, что в качестве "вазоактивного" препарата в условиях СМП г. Екатеринбурга, используется исключительно дротаверина гидрохлорид (в том числе "Но-шпа").
Механизм "вазоактивного" действия дротаверина гидрохлорида связан с ингибированием фермента фосфодиэстеразы (ФДЭ). В результате в гладкомышечных клетках увеличивается содержание циклического 3´,5´-аденозинмонофосфата. Возможно, что он ингибирует активность киназы легких цепей миозина или усиливает поглощение Са2+ саркоплазматическим ретикулумом и понижает тонус гладких мышц (в том числе в сосудах).
К блокаторам ФДЭ относятся другие, часто рекомендуемые препараты – папаверина гидрохлорид и дибазол [1, 31, 42, 57, 69]. В некоторых публикациях для комбинированной антипиретической терапии рекомендуется использовать никотиновую кислоту [57]. Расширение сосудов при ее использовании происходит опосредованно, через активацию кининов, гистамина и простагландина D2 [18].
Гораздо реже встречаются рекомендации об использовании нейролептиков (аминазин, дроперидол) [3, 42, 56, 57, 66, 69]. Они не нашли широкого применения из-за своего "непредсказуемого" действия на сосудистый тонус и возможных побочных эффектов со стороны ЦНС.
В нашем исследовании показана целесообразность применения дротаверина гидрохлорида и никотиновой кислоты при "бледной" лихорадке у детей [49].
Расчет дозы препаратов, используемых у детей с лихорадкой, представлен в Приложении 1.
КРИТЕРИИ СТАРТОВОЙ АНТИПИРЕТИЧЕСКОЙ ТЕРАПИИ И
АЛГОРИТМ ОКАЗАНИЯ ПОМОЩИ ДЕТЯМ С ЛИХОРАДКОЙ
Раздел, посвященный лихорадке у ребёнка, присутствует в большинстве отечественных руководств по неотложной педиатрии, а изложение критериев стартовой антипиретической терапии традиционно занимает в них центральное место. В настоящее время предложены различные алгоритмы помощи ребёнку с повышением температуры тела. Основным критерием в них, как правило, выступает уровень пирексии [5, 20, 32, 45, 69]. Подобный подход отличает отечественную медицинскую литературу от "англоязычной", где основное значение придаётся дифференциально-диагностической ценности лихорадки в распознавании заболевания ставшего её причиной, а так же вопросам алгоритмизации обследования и лечения ребёнка с повышением температуры тела.
Мы затрудняемся определить, чем объясняется столь пристальное внимание к вопросам антипиретической терапии в нашей стране и почему её относят к разряду неотложной помощи, но, по-видимому, это определяется следующим фактом: снижение температуры тела в настоящее время является основным видом терапии у детей на догоспитальном этапе. Возможно, что особенности организации медицинской помощи детям в нашей стране, так же влияют на "значимость" догоспитальной антипиретической терапии.
В отличие от США и большинства стран Европы в России в состав бригад СМП входит врач. Во многих крупных городах, в том числе в Екатеринбурге, существуют специализированные педиатрические бригады. Основной причиной их вызовов к детям является повышение температуры тела. Возможности диагностического поиска на догоспитальном этапе очень ограничены и большинство детей, осмотренных педиатром СМП, госпитализируется (в среднем более 60%).
В сложившейся ситуации основным действием врача СМП ("по дороге в стационар") становится назначение антипиретической терапии. Ретроспективный анализ 1660 карт вызовов СМП показывает, что дети у которых повышение температуры тела составило 38,5ºС или более (36,8%) практически всегда получали антипиретики (36,3%). Каких значений пирексии пытались добиться в данных случаях сотрудники СМП и, главное, зачем остаётся неясным. Однако в некоторых источниках прямо указывается целевой уровень температуры тела, который должен быть достигнут при проведении антипиретической терапии – 37,5ºС. [32]. Не вызывает сомнения, что подобная практика в отношении абсолютного большинства детей с лихорадкой, является анахронизмом и категорически недопустима.
Повышение температуры до 41-42ºС только в условиях in vitro повреждает ферментные системы человека. На практике же такое повышение температуры тела с одной стороны встречается чрезвычайно редко, а с другой, не является фатальным. Тем не менее, предположим, что пирексия на уровне 40-41ºС у ребёнка является ургентным состоянием.
Проанализировав карты вызовов 1660 пациентов педиатрического отделения МУ ССМП г. Екатеринбурга мы установили, что температура тела превышающая 40ºС была зарегистрирована лишь у 1,4% детей с лихорадкой. Максимальное значение пирексии составило 40,4ºС, при этом только у 0,5% (n = 3) пациентов состояние расценивалось как тяжёлое. Ни у одного пациента не регистрировались ФС, никому не проводилась инфузионная или иная интенсивная терапия [49, 53]. Как видно из ретроспективных данных условно ургентная пирексия – состояние редкое!
Предлагая алгоритм антипиретической терапии, мы выделили два основных критерия для её начала: самочувствие ребёнка и наличие (или возможность развития) декомпенсации дыхательной, сердечнососудистой и нервной систем (рис. 1).
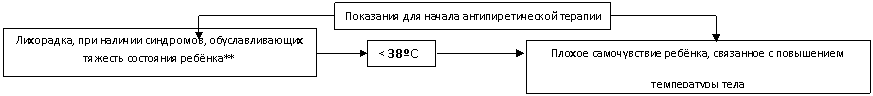 |
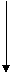
![]()
|
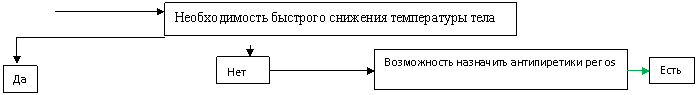
![]()
![]()
![]()
 |
 |
|
|
|

![]()
![]()
![]()
![]()
![]()
|
Рис. 1. Алгоритм оказания антипиретической помощи детям с лихорадкой.
Примечание к рис.1:
![]()
![]()
![]()
![]() – направление пошагового алгоритма;
– направление пошагового алгоритма;
*Эффект (+), (–) – положительный/отрицательный эффект проводимой терапии; т. е. достижение/не достижение состояния, приемлемого для данного пациента;
**клинические синдромы, характеризующие декомпенсацию дыхательной, сердечнососудистой и нервной систем (объяснение в тексте);
***охлаждение в ванной с постепенным снижением температуры воды.
Для правильной интерпретации предложенных критериев мы хотим привести их более точное описание. Как правило, нарушение самочувствия у ребёнка с лихорадкой обусловлено сопутствующей болью. Это может быть головная, мышечная или неопределённая боль ("ломота во всем теле"), хорошо объяснимая с точки зрения патофизиологии лихорадки. В основе обоих явлений лежит действие ИЛ 1 и простагландинов. Однако у большинства пациентов болевой компонент выражен незначительно и удовлетворительное самочувствие характерно для большинства детей с лихорадкой. Другим, характерным для ИЛ 1, действием на ЦНС являются такие симптомы как вялость, слабость, сонливость. Они, как правило, возникают при повышении температуры до 39-39,5ºС, ограничивают выход "мышечного тепла" и не являются проявлением интоксикации. В случаях, когда ребёнок не в состоянии оценить своё самочувствие и/или сказать о своих ощущениях, определяющим фактором становится его поведение: выраженное беспокойство или напротив заторможенность.
Ориентация на поведение ребёнка, как на критерий для стартовой антипиретической терапии, больше подходит для стационарного этапа и домашних условий (долговременное наблюдение), чем для догоспитального этапа. Важным аргументом в пользу подобного утверждения является то, что уровень пирексии, "её ответ" на жаропонижающие препараты и характер последующего течения – это важные признаки для диагностики заболевания ставшего причиной лихорадки на госпитальном этапе оказания помощи.
Если для госпитализации нет показаний или от неё отказываются родители, то врачу СМП или участковому педиатру можно ограничиться только рекомендациями по уходу и применению антипиретиков.
При прочих равных обстоятельствах мы не рекомендуем назначать антипиретики в следующих случаях:
При "розовой" лихорадке с уровнем пирексии менее 39ºС у детей до 5 лет и менее 39,5ºС у детей старше 5 лет;
При "бледной" лихорадке при повышении температуры менее 38,5ºС (возможно изолированное применение "вазоактивных" препаратов при уровне пирексии менее 38,5ºС).
В практической деятельности врача СМП возможны случаи сочетания у ребёнка лихорадки и синдромов, определяемых поражением дыхательной, сердечнососудистой и нервной систем. В подобных ситуациях значимость лихорадки увеличивается, так как активизация энергообмена, обеспечивающего повышение температуры тела, возможна только при усилении деятельности обозначенных систем жизнеобеспечения, которая может стать дополнительным фактором декомпенсации дыхания, кровообращения или нервно-психической деятельности. Значимость антипиретической терапии в таких условиях сложно переоценить. Мы не будем останавливаться на описании синдромов, обуславливающих тяжесть состояния ребёнка с лихорадкой. Они достаточно подробно рассмотрены в разделах неотложных состояний в пульмонологии, кардиологии, неврологии многих руководств [23, 28, 30, 57, 66, 69].
Таким образом, основным, и возможно, единственным критерием для оказания антипиретической помощи на этапе СМП является сочетание лихорадки с синдромами, обуславливающими тяжесть состояния ребёнка.
Внимание врача СМП должно быть обращено на выявление причины повышения температуры тела. Определение основного заболевания, тяжести состояния и, главное, ПОКАЗАНИЙ К ГОСПИТАЛИЗАЦИИ – основные задачи врача СМП!
Снижение температуры тела и поддержание её в оптимальных пределах – это элемент ухода за лихорадящим ребёнком. Естественно, что такой уход должен осуществляться не медицинскими работниками, а родителями, или иными лицами, находящимися с ребёнком и не только в домашних условиях, но и в условиях стационара. Основным источником информации об организации правильного ухода за ребёнком с лихорадкой, о возможности и условиях применения антипиретиков, является лечащий врач. К сожалению, в результате опроса, проведённого в рамках нашего исследования, были выявлены грубые нарушения основных правил ухода за ребёнком с лихорадкой в домашних условиях. Важно, что для большинства респондентов источником информации были медицинские работники. Подобная ситуация не уникальна для нашей страны [80]. При правильном уходе и лечении основного заболевания температура тела редко достигает существенного уровня, и не причиняет ребёнку страданий [86].
Последовательность назначения энтеральных форм препаратов ибупрофена и парацетамола в алгоритме не имеет принципиального значения, являясь лишь отражением фармако-экономической эффективности антипиретической терапии, выявленной в ходе исследования [47, 49]. В алгоритме не предусмотрена возможность одномоментного назначения препаратов ибупрофена и парацетамола, а только последовательного. Последовательное применение одного и того же препарата в разных формах выпуска необоснованно (например, последовательное назначение парацетамола внутрь, далее ректально и внутривенно).
Предложенный алгоритм допускает применение Анальгина у детей, но только в тех случаях, когда отсутствует техническая возможность обеспечить венозный доступ в ургентной ситуации. Необходимость его применения в финале последовательного назначения препаратов ибупрофена и парацетамола обозначена лишь гипотетически.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 |




