Центральный научно-исследовательский
и проектный институт лесохимической промышленности
ЭКСТРАКТИВНЫЕ ВЕЩЕСТВА БЕРЕСТЫ:
ВЫДЕЛЕНИЕ, СОСТАВ, СВОЙСТВА, ПРИМЕНЕНИЕ
ОБЗОР
KISLITSYN А. N. BIRCH BARK EXTRACTIVES: ISOLATION, COMPOSITION. PROPERTIES. APPLICATION. It was shown that the birch bark being a multitonnage industrial waste is a promising chemical raw material comprising 20...40% of extractives and 30...40% of suberin. The methods of extractives isolation are fairly simple and feasible. The main component of the extractives is betulin, a pentacyclic triterpenic diol C30H50O2. Its concentration in the extractives is minimum 60%. Betulinol with the bark material content 95% can be obtained by recrystallization. The suberic acid is a complex mixture of approximately thirty aliphatic C18-C22 mono - and dicarbonic saturated and unsaturated oxy - and epoxy acids. The extractives and suberic acids may find use in production of such products as film formers, plasticizers and surfactants. Be tulinol itself, with its biologically active properties, is of great interest for the synthesis of various derivatives, promising biologically active substances.
Keywords: birch bark, extractives, suberic acids, composition, properties, application.
Ключевые слова: береста, экстрактивные вещества, субериновые кислоты, состав, свойства, применение.
Древесина березы широко используется в фанерном и (в возрастающих объемах) в целлюлозно-бумажном производствах. Березовая кора – многотоннажный отход процесса переработки березы. Содержание коры составляет примерно 12,5% от массы древесины [1, 2], а по неопубликованным данным ВНИИБа – даже 16...17%. На долю наружного слоя коры-бересты приходится 16...20% от ее массы [1, З], Береста, имеющая необычный состав — она содержит до 50% «экстрактивных» веществ, извлекаемых органическими растворителями и щелочами, — представляет большой потенциальный интерес для химической переработки с целью получения новых (например, поверхностно-активных, пленкообразующих, полимерных и т. п.) продуктов и биологически активных веществ. Поэтому, учитывая доступность и потенциальную ценность бересты для химической переработки, целесообразно рассмотреть имеющиеся многочисленные литературные данные о способах выделения из нее химических продуктов, их составе, свойствах и возможных областях применения. Но прежде необходимо уточнить некоторые термины.
В 1788 г. Ловиц из березовой коры путем сублимации выделил соединение, которое Мэзон в 1831 г. назвал бетулином (от лат. betula — береза). В дальнейшем бетулин стали выделять экстракцией органическими растворителями и последующей перекристаллизацией экстрактивных веществ, называя бетулином как экстрактивные вещества, так и индивидуальный тритерпеновый спирт C30H50O2, получаемый при перекристаллизации из экстрактивных веществ. Между тем последние – сложная смесь с массовой долей бетулина 60...85%, и называть их бетулином неправильно. Это экстрактивные вещества. Что касается тритерпенового спирта C30H50O2, то в литературе употребляются названия «бетулин», «бетулинол», в Chemical Abstracts он фигурирует как луп-20(29)-ен-3р,28-диол. Мы используем название «бетулинол», показывающее, что это спирт.
Суберин (от лат. suber – пробковое дерево) – такое название дал Бусиньоль в 1836 г. веществам, извлеченным из коры пробкового дерева Quercus suber спиртовой щелочью. Этим словом называют до сих пор как вещество, находящееся в пробке или бересте, так и получаемые из них кислоты. С «химической» точки зрения это совершенно разные вещества: суберин – полиэфир (полиэстолид), кислоты – смесь мономерных соединении, из которых построен суберин. Поэтому кислоты, получаемые при омылении суберина, следует называть субериновыми кислотами, а не суберином.
Основными химическими компонентами бересты являются собственно экстрактивные вещества (вещества, извлекаемые органическими растворителями), суберин (полиэстолид нерегулярного строения), лигнин и полисахариды. Береста берез Betula verrucosa и B. pubescens – основных видов, произрастающих на евразийской территории, – содержит 20...40% экстрактивных веществ и 30...40% субериновых кислот – продуктов омыления суберина спиртовой щелочью [4...9]. Некоторые другие виды берез характеризуются следующим содержанием экстрактивных веществ и субериновых кислот в бересте (%): В. alba 14,1 и 19,7; В. costata 21,0 и 8,6; В. davurica 20,0 и 25,5 и В. ermani 19,0 и 38,8 соответственно [8].
Содержание экстрактивных веществ, и в том числе бетулинола, зависит не только от вида березы, но и от места произрастания и возраста дерева, сезонности [7, 10...14].
Выделение экстрактивных веществ и субериновых кислот. Химические свойства экстрактивных веществ и суберина предопределяют возможные способы переработки бересты: экстрактивные вещества выделяют экстракцией органическими растворителями; суберин, нерастворимый в растворителях, омыляют щелочью и извлекают в виде солей субериновых кислот.
Выделение экстрактивных веществ и субериновых кислот возможно двумя способами: путем последовательного раздельного их выделения (последовательный способ) и путем одновременного извлечения с последующим разделением (совмещенный способ).
По первому способу вначале из бересты извлекают экстрактивные вещества, а затем субсриновые кислоты. В качестве экстрагента для извлечения экстрактивных веществ опробованы алифатические углеводороды и их хлорпроизводные, бензол, спирты C1–C4, ацетон. Хотя растворимость экстрактивных веществ в этих растворителях невелика (не более 50 г/л при температуре кипения), все растворители, за исключением петролейного эфира, пригодны для этой цели. В лабораторной практике чаще всего используют этанол или бензол, экстрагирующая способность которых одинакова, или их смесь.
Пасих [15] исследовал процесс извлечения экстрактивных веществ в аппарате Сокслета и нашел, что наибольший выход достигается при использовании трихлорэтилена (44%) по сравнению с 28, 25 и 22% при использовании бензола, диэтилового эфира и хлороформа. Он же попытался интенсифицировать процесс экстракции с помощью ультразвука, но не получил положительных результатов.
Яэскелайнен [16] изучил кинетику и глубину извлечения экстрактивных веществ рядом растворителей и установил, что петролейный эфир после 30-ч экстракции извлекает всего 6,0%, четыреххлористый углерод, перхлорэтилен и ацетон 33,4...36,4%, а этанол, трихлорэтилен и метиленхлорид 40,3...42,3% экстрактивных веществ от массы бересты. Анализ этих данных показал, что имеется тенденция увеличения скорости и глубины экстракции с ростом «полярности» (Ет) растворителя.
Основательно изучен процесс извлечения бетулинола из бересты Эккерманом и Экманом [17]. Изучение скорости экстракции бетулинола в процессе нагревания 100 г бересты в 1 л растворителя показало следующее. При использовании бересты мелкого помола (размер частиц 0,15...1,5 мм) происходит быстрое растворение бетулинола в большинстве использованных растворителей (углеводородный растворитель LIAV-200, дихлорметан, метанол, изопропанол-азеотроп, этанол-азеотроп, 2-бутанол-азеотроп, ацетон), в течение 5 мин в раствор переходит свыше 90% содержащегося в бересте бетулинола. Исключение составляет углеводородный растворитель LIAV-110. Из-за плохой растворимости бетулинола в последнем экстракт становится насыщенным уже при растворении 30% бетулинола бересты. При обработке более крупной бересты (размер частиц 0,8...4,0 мм) наблюдается дифференциация в скоростях и глубине экстракции бетулинола различными растворителями. Наивысшая скорость экстракции – при использовании LIAV-200 благодаря высокой температуре процесса (не ниже 150°С). 90%-ная степень извлечения достигается через 30 мин. При использовании других растворителей скорость и глубина экстракции увеличиваются в ряду дихлорметан<изопропанол=изобутанол=аце-тон<метанол<этанол, за 60 мин извлекается от 75 до 93% бетулинола от содержащегося в бересте.
Микроскопическое изучение сечений частиц бересты, подвергнутой экстракции, показало, что проникновение растворителя и диффузия экстрактивных веществ из бересты происходят, в основном, между слоями пластинок. Поэтому для ускорения процесса экстракции очень важно не только измельчить бересту до частиц определенного размера (по площади), но и разодрать их на тонкие пластинки.
Авторы [17] изучили устойчивость бетулинола в кипящем растворе LIAV-200 при барботаже воздуха. Установлено, что бетулинол неустойчив, сразу начинается его окисление, через 10 ч окисляется 28%, через 20 – 75% бетулинола. В присутствии бересты благодаря наличию в ней фенольных компонентов, действующих как антиокснданты, окисление начинается значительно позже – более чем через 100 ч.
В работе [17] изучен также процесс выделения тритерпеноидов из экстрактов, полученных экстракцией в аппарате Сокслета. Чтобы обеспечить растворимость извлекаемых тритерпсноидов, в колбу заливали 1,5 л растворителя на 100 г бересты. Экстракт упаривали до объема 440 мл, охлаждали до 15°С, выдерживали 24 ч и отделяли кристаллический осадок от маточника фильтрацией. Выход и характеристика продуктов, полученных при этом, приведены в табл. 1.
Таблица 1.
ВЫХОД И ХАРАКТЕРИСТИКА ЭКСТРАКТИВНЫХ ВЕЩЕСТВ
Показатель
Углеводородный растворитель, Ткип 150…185°C
Дихлорметн
Метанол
Изопропанол-вода (азеотроп)
Этанол-вода (азеотроп)
Ацетон
2-Бутанол-вода (азеотроп)
Выход экстрактивных веществ, % от массы бересты
31
33
34
35
35
35
35
Массовая доля бетулинола в экстрактивных веществах, %
71
67
64
64
63
63
62
Массовая доля кристаллического осадка из упаренного экстракта, % от массы экстрактивных веществ
91
73
71
70
68
64
63
Массовая доля бетулинола в кристаллическом осадке, %
76
71
72
78
70
74
82
Выход бетулинола, перешедшего в кристаллический осадок, % от содержания бетулинола в экстрактивных веществах
97
77
80
85
75
75
83
Из таблицы следует, что большинство растворителей извлекает примерно одинаковое количество экстрактивных веществ (33...35%) с примерно одинаковой массовой долей бетулинола в них – 62...67%. Экстракт, полученный с растворителем LIAV-200, более светлый, что объясняется меньшей экстракцией полярных компонентов этим неполярным растворителем. Поэтому выход экстрактивных веществ с ним самый низкий (31%), а концентрация бетулинола в экстрактивных веществах самая высокая (71%). В осадок переходит 97% бетулинола от содержания его в экстрактивных веществах, тогда как при использовании других растворителей в осадок переходит значительно меньшее количество – 75...85%. Среди последних заслуживают внимания два растворителя – 2-бутанол (азеотроп) и изопропанол (азеотроп); в кристаллическом осадке из них самая высокая массовая доля бетулинола (82 и 78%), а в осадок переходит 83 и 85% бетулинола соответственно.
тритерпеноидов в кристаллическом осадке и в фильтрате (маточнике) представлено в табл. 2. Из таблицы видно, что, если не брать во внимание растворитель LIAV-200, наибольшая концентрация бетулинола наблюдается в осадке из азеотропа изопропанол-вода. По расчетам в фильтрате концентрация бетулинола в 2,5 раза ниже, а всех остальных в 3,1 раза выше, чем в кристаллическом осадке.
Таблица 2.
МАССОВАЯ ДОЛЯ ТРИТЕРПЕНОИДОВ В БЕРЕСТЕ И СООТНОШЕНИЕ ИХ В КРИСТАЛЛИЗАТЕ И ФИЛЬТРАТЕ ДЛЯ РАЗЛИЧНЫХ РАСТВОРИТЕЛЕЙ [17]
Тритерпеноид
Концентрация в сухой бересте, г/кг
Отношение массовых долей тритерпеноидов в
кристаллизате и фильтрате для растворителей
Углеводородный растворитель, Ткип 150...185°С
Изопропанол-вода (азеотроп)
2-Бута-нол-вода (азеотроп)
Метанол
Ди-хлор метан
Аце-тон
Этанол-вода (азеотроп)
Бетулинол
220,0
74,3
8.2
6.5
5,5
4,3
3,8
3,6
Лупеол
20,0
1.4
0,7
0,9
1,9
1,0
1,4
0.9
Прочие
25,8
3,5
1.0
0,9
1,1
1,1
0,9
0,8
Авторы [17] предлагают два способа получения бетулинола в зависимости от требуемой чистоты его. В качестве экстрагента в обоих случаях используется углеводородный растворитель LIAV-200. В первом варианте вышеописанным способом получают кристаллический осадок, в который из экстракта переходит 97% бетулинола с содержанием основного вещества 76%. По второму варианту этот кристаллический осадок подвергается повторной кристаллизации из азеотропа 2-бутанол-вода. В результате массовая доля основного компонента повышается до 95%, но уменьшается доля перешедшего в кристаллический продукт бетулинола до 80% от содержания его в экстракте. Таковы данные об изучении первой стадии последовательного способа переработки бересты.
Вторая стадия – омыление суберина с получением субериновых кислот – специально никем не изучалась. Обычно омыление суберина проводят большим избытком спиртового или водно-спиртового раствора гидроксида калия. Дальнейшая обработка экстракта сводится к отгонке спирта. разложению солей разбавленной сильной кислотой и отделению субериновых кислот фильтрацией или экстракцией органическими растворителями. При омылении суберина водной щелочью выход субериновых кислот не меняется, но скорость омыления ниже, чем при использовании спиртовой щелочи. Состав кислот при омылении водной щелочью иной вследствие перехода главного компонента субериновых кислот – 9,10-эпокси-18-гидроксиоктадекановой кислоты – в 9,10,18-тригидроксиоктадекановую [18].
Следует упомянуть, что некоторые исследователи использовали иную последовательность извлечения экстрактивных веществ и субериновых кислот: вначале извлекали щелочерастворимые компоненты обработкой аммиачной водой (Schulze. Pierch, Chem. Ber., 1922, Bd. 55, S. ) или раствором соды (Dieschendorfer, Grillmayer, Monatshefte Chem., 1926, H. 47, S. 419), а затем – экстрактивные вещества. Показано [19], что бетулин (экстрактивные вещества), полученный таким образом, содержит меньше примесей и легче подвергается очистке.
Бетулинол из бересты можно выделить не только экстракцией, но и сублимацией. Так его впервые и получил Ловиц. Метод исследовался и позже (Vesterberg, Chem. Ber., 1932, Bd. 65, S. 1305). Однако бетулинол в сублимате сильно загрязнен, и выход его невелик. Лучшие результаты получены при вакуумной (давление 1,3...1,8 кПа) сублимации бетулинола из бересты, предварительно обработанной кипящими водными растворами щелочи. Выход сублимата 23%. Содержание бетулинола высокое, так как после 1...2 перекристаллизаций из спирта получено вещество с температурой плавления 258...259°С [19].
Возможен и принципиально иной путь выделения субериновых кислот – алкоголизом полиэфира суберина, в частности обработкой метанолом в присутствии серной кислоты [18, 20]. Правда, в этом случае получаются не субериновые кислоты, а метиловые эфиры их. Кроме того, эпоксикислоты превращаются в 9-(или 10)-метокси-10-(или 9)-гидроксипроизводные. Степень превращения суберина около 90%.
При щелочной плавке бересты, освобожденной от экстрактивных веществ, с гидроксидом калия при 330°С суберин превращается в смесь насыщенных моно - и дикарбоновых кислот. Выход таких кислот составил 450...500 г/кг сухой проэкстрагированной бересты [20].
Совмещенный способ извлечения экстрактивных веществ и субериновых кислот из бересты предложен [21]. Сущность его состоит в следующем. Измельченная береста истирается совместно с водной щелочью. К полученной корьещелочной массе добавляется изопропанол (азеотроп), и смесь при нагревании перемешивается. Суспензия твердого лигноуглеводного остатка в спиртоводном растворе разделяется фильтрованием. Из фильтрата отгоняется спирт, к остатку добавляется вода. Из образующейся водно-бетулиновой эмульсии отделяются фильтрацией экстрактивные вещества (бетулин), а из фильтрата выделяются субериновые кислоты. Изучено [22] влияние расхода щелочи, модуля спирт–водная щелочь, примеси луба на выход и качество продуктов. Найдены оптимальные параметры процесса. Выход экстрактивных веществ и субериновых кислот равен 23,5...25,5 и 30,0...31,5% при содержании их в бересте 23,6 и 29,5% соответственно. Состав продуктов не изучался.
Литературные данные показывают, таким образом, что химическая переработка бересты с получением экстрактивных веществ (или бетулинола) и субериновых кислот вполне технически осуществима. Информации о реализации химической переработки бересты в промышленности не имеется.
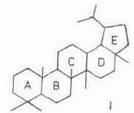
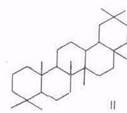
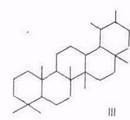
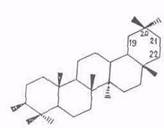
Химический состав тритерпеноидов. В экстрактивных веществах внешней коры берез большинства видов преобладают пентациклические тритерпеноиды лупанового ряда (I), реже олеананового (II). Найдены также представители ряда урсана (III).
Все они различаются лишь скелетом кольца Е. Основным представителем тритерпеноидов ряда лупана является бетулинол, обусловливающий белый цвет коры. Массовая доля бетулинола в бересте колеблется в очень широких пределах (10...35%) в зависимости от вида березы, места и условий произрастания, возраста дерева и др. факторов [16, 23, 24]. Минимальное содержание бетулинола отмечено для березы с черной корой – В. davurica, где это соединение является минорным, а преобладают тритерпеноиды ряда олеанана – олеаноловая кислота и ее производные [23,. 25], да и содержание экстрактивных веществ в коре этой березы низкое. Постоянный спутник бетулинола в тритерпеноидах из В. verrucosa и В. pubescens – лупеол (~10% от бетулинола). В работе [26] отмечено аномально высокое содержание лупеола примерно равное массе бетулинола. Биосинтез бетулинола протекает через гераниол, сквален и лупеол [24].
Для качественного определения принадлежности вещества к группе тритерпеноидов предложено использовать УФ-спектроскопию в концентрированной серной кислоте. Различные тритерпеноиды ряда I, II, III имеют общий максимум поглощения при 310 нм, который характеризуется большой экстинкцией и не меняется при введении в молекулу различных заместителей. Стероиды указанного максимума поглощения не дают [27].
Для разделения тритерпеноидов при исследовании химического состава применяется препаративная тонкослойная и колоночная хроматография [13, 14, 28...36] (как правило, на силикагеле), для анализа – газожидкостная хроматография с использованием набивных и капиллярных колонок (как правило, с SE-30 в качестве жидкой фазы) [6, 13, 14, 30, 37...44]. Разработана методика количественного определения бетулинола [45]. Используется для исследования состава тритерпеноидов также высокоэффективная жидкостная хроматография [46]. Для детектирования вместо УФ-спектроскопии и рефрактометрии недавно предложено использовать более чувствительный (в 5 раз) метод комбинационного рассеяния света [47].
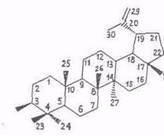
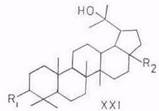
Финскими [6, 36] и российскими ( с сотр., Тихоокеанскнй ин-т биоорганической химии ДВЦ РАН) [11, 13, 14, 23, 25, 48, 49] исследователями в экстрактах из внешней коры берез, произрастающю на евразийской территории — В. pubescens, В. verrucosa Ehrh. (В. pendula Roth.), В. costata, В. davurica. В. ermanii, В. mandshurica и В. maximowicziana – идентифицированы следующие тритерпеноиды:
R1
R2
IV
–OH
XIV
–CH3
V
–OH
XV
–CH2OH
VI
–OH
XVI
–CHO
VII
–OH
XVII
–COOH
VIII
–OH
XVIII
–COOCH3
IX
=O
—
–CH3
Х
=O
—
–CHO
XI
=O
—
–COOH
–OCOCH3
XIX
–COOH
XII
–OCOCH=CH–C6H3(OH)2
—
–CH2OH
XIII
–OCOCH=CH–C6H3(OH)2
XX
–COOH
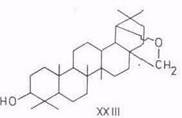
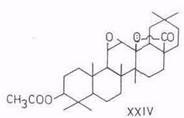
лупеол (IV), бетулинол (V), бетулиновый альдегид (VI), бетулиновая кислота (VII), метилбетулинат (VIII), лупенон (IX), бетулоновый альдегид (X), бетулоновая кислота (XI), кофеаты бетулинола (XII) и бетулнновой кислоты (XIII), р-амирнн (XIV), эритродиол (XV), олеаноловый альдегид (XVI), олеаноловая кислота (XVII), метилолеанолат (XVIII), ацетат (XIX) и кофсат (XX) олеаноловой кислоты, лупан-3β,20-диол (моногинол) (XXI, R1=OH, R2=CH3), лупан-3β,20,28-триол (XXI, R1=OH, R2=CH2OH), кофеат лупан-Зβ,20,28 (XXI, R1= C6H3(OH)2–CH=CH–COO, R2=CH2OH), урсоловая кислота (XXII), аллобетулин (XXIII) и Зβ-ацетил-11α,12α-эпоксиолеан-13,28-олид (XXIV). 6α-Ацетоксиурсоловая кислота выделена из коры березы В. utillis [50].
Наиболее полный количественный состав тритерпеноидов коры березы B. verrucosa приведен в работе Экмана [6] (табл. 3). Массовая доля тритерпеноидов в свежей бересте составляет 21,0... 40,0% (в среднем 31,5%), в промышленных образцах с ЦБП – в среднем 26,9%.
Таблица 3
СОСТАВ ТРИТЕРПЕНОИДОВ КОРЫ В. VERRUCOSA [6], % ПО МАССЕ*
Компонент
Свеж. береста
Пром. береста
Лупеол
2,6...14,2(6,6)
(7,9)
Эритродиол
0,5...21,4(3.6)
(2,8)
Метилолеанолат
0,5...9,7 (3,0)
(2,0)
Метилбетулинат
2,0...13,4(5.5)
(4,3)
Бетулиновый альдегид
0,6...2,2 (1,1)
(1,2)
Бетулинол
55,5...84,1 (77,4)
(78,1)
Прочие (4 помп.)
1,9...4,9 (2,8)
(3,7)
* Здесь и в табл. 4 в скобках приведены средние значения.
Тритерпеноиды составляют 85% от экстрактивных веществ, извлекаемых ацетоном. Из табл. 3 видно, что массовая доля бетулинола колеблется значительно. В отдельных пробах значительна доля метилбетулината, луренола и эритродиола. Составы тритерпеноидов свежей и промышленной бересты близки.
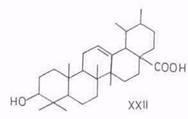
Химический состав субериновых. кислот, изучавшийся многими исследователями в течение полутора столетии со времени их выделения, в настоящее время установлен полностью. Первый большой вклад в расшифровку состава внес Зетше с сотр., опубликовавший в 30-х годах серию статей в Helvetica acta. Им в субериновых кислотах из пробки идентифицированы флоионовая (9,10-диоксиоктадека-1,18-диовая), флоионолевая (9,10,18-триоксиоктадекановая), феллоновая (22-оксидокозановая) н эйкозан-1,20-диовая кислоты. Большую работу провел Йенсен [51...55], идентифицировавший в кислотах из бересты помимо вышеуказанных еще 18-оксиоктадец-9-еновую и октадека-9-ен-1,18-диовую кислоты. Он выделил (но не идентифицировал) кислоту состава C18H34O2, которая, сейчас это ясно, была 9,10-эпокси-18-гидр-оксиоктадекановой кислотой. Качественный сдвиг произошел после привлечения методов газожидкостной хроматографии в сочетании с масс-спектрометрией. Относительно использования последней имеется следующее предостережение. Тенденция двойной связи мигрировать при электронной атаке вынуждает использовать не сами ненасыщенные кислоты, а их производные – бром-, эпокси-, гидрокси-, дейтеродери-ваты. Наиболее удачен перевод ненасыщенных кислот в дигидрокси-производное под действием тетраоксида осмия и последующий перевод их в метил-триметилсилиловые эфиры [56]. Свой вклад в исследование состава субериновых кислот внесли Холловей [57...59] и ряд других исследователей [60...62].
Изящная методика количественного анализа субериновых кислот и тритерпеноидов, без разделения, предложена Экманом [6]. Особое внимание уделено подбору условий выделения кислот в неизмененном виде, так как эпоксикислоты нестойки по отношению к водной щелочи и (особенно) кислотам. К сожалению, в статье не приводятся данные об относительных временах удерживания и поправочных коэффициентах. Автор дает самый полный перечень кислот, идентифицированных в суберине, – 32 кислоты, не считая нескольких артефактов и феруловой кислоты. Массовая доля субериновых кислот, по результатам анализа 20 образцов свежей бересты В. verrucosa, колеблется от 29,9 до 36,3%. Состав основных компонентов смеси субериновых кислот приведен в табл. 4.
Таблица 4
СОСТАВ СУБЕРИНОВЫХ КИСЛОТ КОРЫ В. VERRUCOSA [6], % ПО МАССЕ*
Кислота
Свеж. береста
Пром. береста
Октадека-9-ен-1,18-диовая
2,1...3,9 (3.1)
(3,7)
Октадекан-1,18-диовая
0.5...1,5 (0.9)
(0,9)
18-Гидроксиоктадец-9-еновая
6,0...1,3)
(10,8)
9.16- и 10,16-Дигидроксигексадекановая
2,3...6,2(3,7)
(3,1)
9,10-Эпокси-18-гидроксиоктадекановая
29,2...43,2 (36,0)
(37,9)
20-Гидроксиэикозановая
2,3...4,4(3,1)
(2,5)
9,10,18-Тригидроксиоктадекановая
6.3...11,4(9,4)
(7,8)
Докозан-1,22-диовая
3,6...7,4 (5,7)
(6,5)
22-Гидроксидокозановая
11,7...17,4(14,4)
(14,7)
Прочие (23 комп.)
9,5...14,7(12,4)
(12,1)
Из табл. 4 видно, что основным компонентом смеси субериновых кислот является 9,10-эпокси-18-гидроксиоктадекановая кислота. В значительных количествах (не менее 10%) содержатся 22-гидроксидокоза-новая, 18-гидроксиоктадец-9-еновая и 9,10,18-триоксиоктадекановая кислоты. Последняя, возможно, продукт гидролиза 9,10-эпоксикислоты. ω-Гидроксикислоты в сумме составляют примерно 75%, α,ω-дикарбоновые кислоты – примерно 10% от суммы кислот.
Таким образом, субериновые кислоты – сложная смесь алифатических C18-C22 моно - и дикарбоновых насыщенных и ненасыщенных окси- и эпоксикислот.
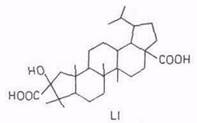
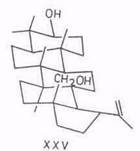 Химические свойства бетулинола. Бетулинол – это пентациклический тритерпеновый спирт C30H50O2 лупанового ряда. Классическими исследованиями установлено, что вторичная гидроксильная группа у хирального углеродного атома ЗС занимает β(S)-положение. Сравнительно недавно [63] для определения абсолютной конфигурации бетулинола в числе других терпенолов использован простой, изящный метод с применением, благодаря газожидкостной хроматографии, микроколичеств исследуемого вещества. Пространственное расположение метильных групп в бетулиноле доказано химическими методами, а в последнее время с помощью ЯМР [64...66]. Характеристика ИК - и масс-спектров бетулинола приведена в работе [67], кристаллическая и молекулярная структура диацетата бетулинола – в [68]. Пространственное строение бетулинола изображается формулой XXV. Указываемая в литературе температура плавления бетулинола колеблется от 251 до 261°С. Более высокие значения получены после сублимации перекристаллизованного бетулинола. Низкая температура плавления (251...252°С) бетулинола, полученного перекристаллизацией из этанола, связывается с образованием молекулярного соединения бетулинол – этанол [24]. Бетулинол растворим в пиридине, тетрагидрофуране, слаборастворим в большинстве органических растворителей (не более 1%) и совсем нерастворим в воде.
Химические свойства бетулинола. Бетулинол – это пентациклический тритерпеновый спирт C30H50O2 лупанового ряда. Классическими исследованиями установлено, что вторичная гидроксильная группа у хирального углеродного атома ЗС занимает β(S)-положение. Сравнительно недавно [63] для определения абсолютной конфигурации бетулинола в числе других терпенолов использован простой, изящный метод с применением, благодаря газожидкостной хроматографии, микроколичеств исследуемого вещества. Пространственное расположение метильных групп в бетулиноле доказано химическими методами, а в последнее время с помощью ЯМР [64...66]. Характеристика ИК - и масс-спектров бетулинола приведена в работе [67], кристаллическая и молекулярная структура диацетата бетулинола – в [68]. Пространственное строение бетулинола изображается формулой XXV. Указываемая в литературе температура плавления бетулинола колеблется от 251 до 261°С. Более высокие значения получены после сублимации перекристаллизованного бетулинола. Низкая температура плавления (251...252°С) бетулинола, полученного перекристаллизацией из этанола, связывается с образованием молекулярного соединения бетулинол – этанол [24]. Бетулинол растворим в пиридине, тетрагидрофуране, слаборастворим в большинстве органических растворителей (не более 1%) и совсем нерастворим в воде.
Функциональными группами в бетулиноле являются первичная и вторичная гидроксигруппы и двойная связь в изопропенильной группе у пятичленного кольца Е. В соответствии с этим бетулинол способен вступать в реакции, характерные для спиртов (этерификации, окисления), и реакции с участием изопропенильнои группы (изомеризации, восстановления, окисления). Рассмотрим основные реакции, свойственные бетулинолу, а также соединениям, близким к нему по строению (аллобетулин, бетулиновая кислота и т. п.), так как ознакомление с превращениями последних может послужить толчком к изучению новых синтезов на основе бетулинола.
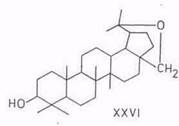
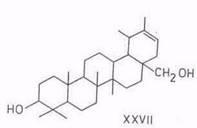
Реакции изомеризации. Впервые изомеризационные превращения бетулинола в аллобетулин (19β,28-эпоксиолеан-3-ол) (XXIII) – соединение со скелетом олеанана (II) – под действием муравьиной кислоты (88- или 100%-ной концентрации) или бромистого водорода в хлороформе описаны в начале 20-х годов текущего столетия. Переход бетулинола в аллобетулин протекает также под воздействием смеси ледяной уксусной и концентрированной серной кислот [69], концентрированной соляной кислоты в этаноле [70]. В последнем случае в качестве побочного продукта с выходом примерно 20% образуется 20,28-эпокси-19α(Н)-лупан-3-ол (XXVI) [71]. Аллобетулин при дальнейшей обработке хлористым бензоилом при 150°С переходит с выходом 60% в соединение со структурой урсана (III) – гетеробетулин (18α(Н), 19β(Н)-урс.20-ен-3β,28-диол) (XXVII) [72].
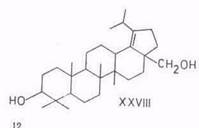
Диацетат бетулинола под воздействием бромистого водорода в смеси уксусного ангидрида и уксусной кислоты изомеризуется в диацетат Зр,28-дигидроксилуп-18-ена (XXV1I1) с выходом 74% [73]. Об аналогичном перемещении двойной связи в лупеноне сообщалось ранее [74].
Реакции замещения водорода в гидроксигруппе. Реакционная способность гидроксигрупп в бетулиноле низка. Тем не менее обе гидроксигруппы можно в присутствии пиридина этерифицировать.
Эфиры высших жирных кислот (лауриновой, пальмитиновой и др.) получаются как при обработке хлорангидридами кислот, так и путем прямой конденсации. Моноэфиры при прямой конденсации получаются при температуре не ниже 180°С, для получения диэфиров температура реакции должна быть не ниже 240°С [75].
Кислые диэфиры двухосновных кислот (янтарной, фталевои, трихлорфталевой) получены ацетилированием ангидридами кислот в присутствии пиридина в бензольном растворе [76, 77]. Дималеинат получен путем нагревания бетулинола с малеиновым ангидридом без катализатора при 200°С [78].
Изучено получение полиэфиров бетулинола взаимодействием схлорангидридами терефталевой и себациновой кислот в диметилацетамиде и в расплаве. Получаются олигоэфиры с молекулярной массой около 2800 и выходом до 75% [79]. В работе [78] установлено, что при полиэтерификации бетулинола терефталоилхлоридом в присутствии триэтиламина скорость реакции в 150...600 раз ниже, чем у этиленгликоля. Реакционная способность первичной группы в четыре раза выше, чем вторичной. С увеличением диэлектрической проницаемости растворителя реакционная способность немного растет и лишь в пиридине достигается значительная активность.
Изучена реакция оксиэтилирования бетулинола оксидом этилена. Выходы продуктов низкие, продукты сильно различаются по длине полиоксиэтиленовой цепи. Изучен процесс получения полиоксиэтиленовых производных бетулинола не прямым оксиэтилированием последнего, а через кислые сложные эфиры – сукцинаты, путем этерификации их полиэтиленгликолем [16].
Реакция гликозилирования бетулинола изучена в работах [80, 81]: при конденсации 3- или 28-моноацетата бетулинола с α-ацетобромглю-козой получены соответственно 28- или 3-тетраацетил-β-глюкопиранозиды с довольно высоким выходом (60...70%). Отмечено образование А-нор-Δ3.5-бетулинола – продукта перегруппировки бетулипола по Вагнеру и Меервейну.
Гидроксигруппы бетулинола способны вступать во взаимодействие с изоцианатами, образуя полиуретаны [82].
Реакции окисления – восстановления. Бетулинол, имеющий в своей структуре две гидроксигруппы и двойную связь, претерпевает при окислении в зависимости от окислителя разнообразные превращения.
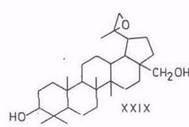
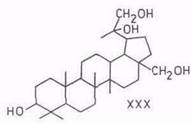
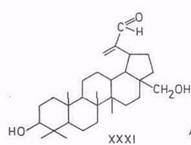
В обзоре [16] со ссылкой на работы Ружички [83], выполненные до 1952 г., указывается, что из бетулина образуются: 20,29-оксид бетулинола (XXIX) при действии мононадфталевой кислоты; 20,29-дигидроксибетулинол (XXX) при действии четырехокиси осмия; 3β,28-дигидроксилуп-20(29)-ен-30-аль при действии диоксида селена (XXXI); бетулоновый альдегид (X) при действии триоксида хрома.
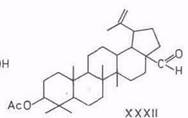
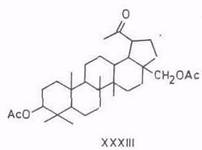
При окислении триоксидом хрома защищенные ацетилированием гидроксигруппы не окисляются. Так, 3β-ацетат бетулинола окисляется в ацетат бетулинового альдегида (XXXII), а диацетат окисляется по изопропенильной группе в дигидроксинорлупанон (XXXIII) [84...86]. Формильная группа не защищает 3-гидроксигруппу от окисления: из 3-формиаталлобетулина с хорошим выходом (75%) получается аллобетулон [67].
Изучена кинетика окисления тритерпеновых, в том числе лупановых, вторичных спиртов хромовой кислотой. Установлено, что реакция имеет второй порядок вплоть до степени превращения 80...90%, спирты с аксиальными гидроксигруппами более реакционноспособны, чем их экваториальные аналоги, спирты олеананового ряда окисляются быстрее соответствующих спиртов лупанового ряда [87].
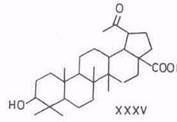
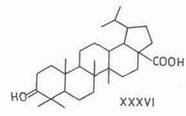
Тетраоксид рутения окисляет бетулинол по изопропенильной и первичной гидроксигруппе в 3β-окси-30-норлупан-20-он-28-овую кислоту (XXXV), а дигидробетулиновую кислоту – в дигидробетулоновую (XXXVI) [88].
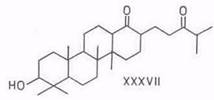
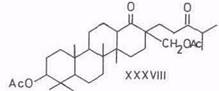
При окислении 3β,28-дигидроксилуп-18-ена (XXVIII) тетраоксидом рутения раскрывается кольцо Е и в качестве главного продукта получается 3β-гидрокси-28-нор-18,19-секолупан-18,19-дион (XXXVII) – тетрациклический терпеноид ряда бакхарана [88, 89]. Окисление, вероятно, протекает через 28-овую кислоту, которая, будучи β-кетокислотой, в условиях реакции декарбоксилируется. В случае окисления диацетата диола XXVIII окисления первичной гидроксигруппы у C28 не происходит, поэтому нет и отщепления, в результате образуется 3β,28-диацетоксн-18,19-секолупан-18,19-дион (XXXVIII). Последний, однако, при щелочной обработке дает также дион XXXVII.
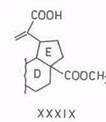
Диоксид селена является специфическим окислителем метильных групп в α-положении к этиленовой связи до альдегидной группы. Бетулинол окисляется в соединение XXXI. Метиловый эфир 3β-ацетилбетулиновой кислоты окисляется с хорошим выходом (70%) в 30-аль-производное [90]. При окислении того же метил-3β-ацетилбетулината смесью диоксида селена и пероксида водорода альдегидная группа окисляется дальше в карбоксильную (XXXIX) (выход 40%). Одновременно двойная связь окисляется в эпоксисоединение, которое после изомеризации в альдегид и окисления его дает кислоту (XL) с выходом 40% [91].
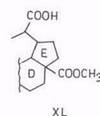
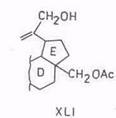
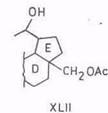
Надкислоты действуют не столь избирательно. Так, пермуравьиная, перуксусная, м-хлорпербензойная кислоты окисляют диацетат бетулинола в сложную смесь диацетатов спиртов – луп-20(29)-ен-3β, 28,30-триола (XLI) и дигидрокси-3β,28-норлупан-20-ола (XLII), соответствующих им CO-производных и других соединений [92, 93]. Аналогичным образом – по изопропенильнои группе – окисляется 3-ацетил-бетулиновая кислота [94].
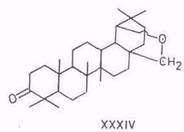
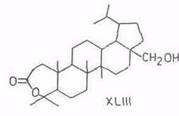
Дигидробетулинол (и лупеол) окисляется м-хлорпербензойной кислотой по вторичной гидроксигруппе, давая с выходом 50% дигидробетулон. Последний при дальнейшем окислении по реакции Байера–Виллигера раскрывает кольцо A и дает лактон XLIII (выход 20%) [94]. При окислении аллобетулона XXXIV образуется лактон XLIV [67]. С высоким выходом (80...85%) получается этот лактон – 19β,28-эпокси-4-гидрокси-3,4-секо-18α-олеанан-3-овая кислота – также при окислении аллобетулона надуксусной кислотой и пероксидом водорода в муравьиной кислоте [95].
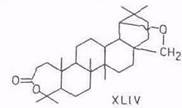
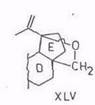
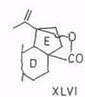
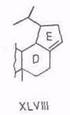
Ацетат ртути (II) – специфический дегидрогенизирующий реагент: из бетулинола (V) и 3-ацетилбетулинола с хорошим выходом получаются 19,28-эпоксипроизводные (XLV). Аналогично ацетилбетулиновая кислота дает 19,28-лактон (XLVI) [96, 97]. Побочными, а не основными, как считалось ранее [98], продуктами являются 13,28-оксиды или лактоны и соединения олеанановой структуры.
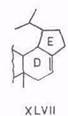
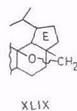
Изучено фотоокисление производных бетулинола тетраацетатом свинца. При окислении 3β-ацетилдигидробетулинола отщепляется оксиметильная группа и образуется смесь 3β-ацетоксипроизводных 28-норлуп-16-ена (XLVII) и 28-норлуп-17(22)-ена (XLVII1) и продукта дегидрирования – 3β-ацетокси-13р,28-эпоксилупана (XLIX) [99].
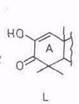
Окислением тритерпеноидов; в которых 3β-гидроксигруппа превращена в карбонильную и отсутствует двойная связь, кислородом в присутствии трет-бутилата калия удается перевести метиленовую группу у C-2 в карбонильную. Так, из аллобетулона XXXIV получается 19β,28-эпокси-2-гидрокси-18α-олеан-1-ен-3-он (L) [67]. Соединение с аналогичной структурой получается из дигидробетулиновой кислоты [100]. При последующей обработке его баритовой водой происходит сужение кольца А и образуется оксиднкарбоновая кислота (LI).
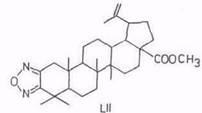
2,3-Дионы (то же самое, что 1-ен-2-гидрокси-3-оны L) являются промежуточным звеном в синтезе фуразанов, например из метилбетулоната (LII). [101, 102].
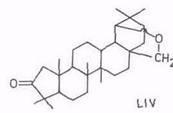
При щелочной плавке тритерпеноидов лупанового ряда происходит дегидрирование по вторичной гидроксигруппе и сужение кольца A [103]. Химизм процесса включает: обратимую реакцию дегидрирования – гидрирования, при которой кетон находится в равновесии с 3α- и 3β-спиртами; 1,2-дегидрирование с расщеплением кольца A в дикарбоновую кислоту и циклизацией ее по реакции Дикмана в норкетон. Состав и выход продуктов приведены в табл. 5.
Таблица 5
СОСТАВ И ВЫХОД ПРОДУКТОВ ЩЕЛОЧНОЙ ПЛАВКИ ТРИТЕРПЕНОИДОВ [103] .
Исх. в-во
Соединение и его выход, % от исх.
Кетон с исходным скелетом
Норкетон
Побочные продукты
Лупеол (IV)
Лупенон (IX), 26
Норкетон (аналог L1V), 26
3α-Лупеол, 11
Аллобетулин (XXIII)
Аллобетулон (XXXIV), 23
Норкетон (L1V), 29
1,2-Дегидро-аллобетулон, 7
Бетулинол (V)
Бетулон (LIII), 64
-
-
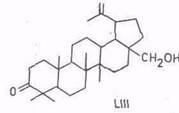
Из табл. 5 видно, что дегидрирование по 3β-ОН и дегидрирование с сужением кольца A в случае лупеола и аллобетулина протекает в равной степени. В случае бетулинола сужения кольца А не наблюдается, а с высоким выходом получается продукт дегидрирования по гидроксигруппе LIII. При восстановлении гидроксикетона по Вольфу–Кижнеру с выходом 93% получается жасминол (LV), выделенный из листьев Jasminum auriculatum Vahl.
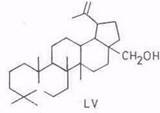
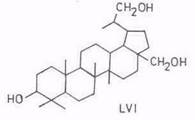
По двухстадийному способу последовательного гидроборирования и окисления из бетулинола можно синтезировать 3β,28,30-тригидрокси-лупан (LVI) [104, 105].
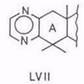
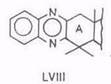
При нагревании аллобетулона XXXIV с серой в морфолине карбонильная группа передвигается в положение C(2) – образуется 19β,28-эпокси-18α-олеан-2-он. При нагревании того же аллобетулона, а также 2α-оксиаллобетулона и 2-кетоаллобетулона с серой в морфолине в присутствии этилендиамина получается пиразиновое (LVII), а с фенилен-диамином – хиноксалиновое (LVIII) производное [106]. Это простой путь к азотсодержащим пиразинам олеананового ряда.
Никель Ренея в кипящем n-цимоле вызывает в тритерпеноидах (лупеол, метилбетулинат, урсоловая кислота и др.) реакции трех типов [107, 108]: окисление 3-гидроксигруппы; восстановление двойной связи; обратимый сдвиг двойной связи в соседнее положение. Так, метилбетулонат с хорошим выходом превращается в метилдигидробетулонат.
Гидрирование этиленовой связи в бетулиноле легко идет на никелевом [16] и платиновом [109] катализаторах. Эффективным катализатором гидрирования является хлористый 3-(3-фенилфосфин)-родий [110].
Восстановительные процессы наблюдаются также при сольволизе тозилатов. Так, при сольволизе производных бетулинола (3-окси-, 3-оксо-, 3-ацетил-28-тозилатов) путем кипячения в диметиланилине осуществляется расширение пятичленного кольца Е в шестичленное (за счет ангулярного C-28) с одновременной изомеризацией изопропенильной группы в изопропилиденовую [85, 111]. При сольволизе дитозилатов бетулинола под действием кипящей безводной уксусной кислоты или хлороксида фосфора в пиридине в результате перегруппировки по Вагнеру–Меервейну кольцо Е, как и в предыдущем случае, расширяется, а кольцо A, наоборот, сужается. Изопропенильная группа сохраняется [112].
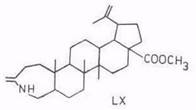
Упомянем еще о синтезе некоторых N-производных бетулинола: 28-аминолупеола [86], 3,4-секопроизводных (LIX) [113], лактама (LX) [102]. Последний получается при обработке 3-оксосоединений, например, метилбетулоната, гидроксил-0-сульфоновой кислотой. Метилбетулонат по реакции Шмидта и его оксим по реакции Бекмана дают сложную смесь [114].
Работ по изучению биохимических превращений лупановых тритерпеноидов не обнаружено. Но α-амирон с помощью культуры гриба Culvularia lunata восстанавливается в смесь α-амирина и эпи-α-амирина [115].
Этот, разумеется далеко неполный, обзор показывает, что бетулинол и его производные способны к разнообразным химическим превращениям и на их основе можно синтезировать множество соединений, которые могут представлять потенциальный практический интерес (прежде всего как биологически активные вещества).
Химические свойства субериновых кислот. Субериновые кислоты – желтая или светло-коричневая мазеобразная масса, хорошо растворимая в этаноле, изопропаноле, изобутаноле, бензиловом спирте, этил - и амилацетате, серном эфире, анилине, пиридине. Хуже кислоты растворяются в трихлорэтане, хлороформе, ацетиленхлориде и нерастворимы в петролейном эфире, бензине, толуоле, ксилоле, четыреххлористом углероде. Кислотное число субериновых кислот близко к 160. Они, как правило, содержат примесь нейтральных веществ – не полностью извлеченных из бересты на первой стадии экстрактивных веществ. После их удаления кислотное число возрастает на 20...25 единиц [5]. Число омыления равно 200...210. Йодное число 28...31. Массовая доля непредельных кислот, рассчитанная по йодному числу, составляет 40...45%. Массовая доля гидроксигрупп колеблется значительно: от 5,14 [5] до 7,25% [22]. Другие характеристики субериновых кислот: температура размягчения 60...80°C, nD20 около 1,5, d420 около 1,0. При хранении кислот при обычной температуре в течение 3 мес. кислотное число не меняется, через 5 мес. снижается на 10...15 единиц. Основания и (особенно) кислоты сильно ускоряют процесс полиэстерификации: нагрев при 100°C в течение 30 мин в присутствии 2% соляной кислоты ведет к снижению кислотного числа со 160 до 68, серная кислота в этих же условиях за 15...20 мин превращает субериновые кислоты в каучукоподобный эластичный продукт. Химические свойства субериновых кислот, естественно, определяются наличием окси-, эпокси-, карбоксигрупп и специально не изучались. Возможности синтеза каких-либо индивидуальных продуктов отсутствуют из-за пестрого состава субериновых кислот. Можно лишь говорить о получении производных по тем или иным функциональным группам. Имеется сообщение о разложении суберина малины спорами гриба Fusarium solani pisi и Armillaria melea [116]. Разложение суберина в процессе грибкового патогенеза рассмотрено в работе [117].
Использование «экстрактивных» веществ. Наружная часть коры березы – береста – давно используется для получения берестового дегтя, который до сих пор применяется в фармакопее и ветеринарии как антисептик и противочесоточное средство. Береста в народной медицине сама по себе также использовалась в качестве антисептика при лечении ран и кожных заболеваний [118]. Бересту использовали для стерилизации помещений, сжигая ее в смеси с нитратом калия [16].
Значительное число работ посвящено поиску путей использования продуктов химической переработки бересты, особенно бетулинола. Изучались возможности использования его для получения пленкообразователей, пластификаторов, поверхностно-активных и биологически активных веществ.
Ранние работы по получению пленкообразователей с использованием бетулина (возможно, это экстрактивные вещества) и суберина описаны в брошюре [119]. Отмечается, что пленки, получаемые только из бетулина, быстро высыхают, но хрупки, пленки из суберина обладают высокой эластичностью, но медленно высыхают. Лаки, приготовленные на основе этерифицированпых бетулином субериновых кислот, непригодны для покрытии по дереву в качестве заменителей спиртовых лаков и вполне пригодны для покрытий по металлу при условии горячей сушки. Облагораживание бетулино-субериновых смол малеиновым и фталевым ангидридом не дало положительного результата: пленки склонны к быстрому старению.
Пирятинский [120] использовал бетулинол, как двухатомный спирт, для частичной замены (до 30%) пентаэритрита при получении канифольных смол. У такой смолы более высокая температура плавления и повышенная водостойкость.
Получению пленкообразователей посвящена работа [19]. Продукты, полученные взаимодействием бетулинола с фталевым ангидридом и адипиновой кислотой, представляют собой твердые высокоплавкие смолы, дающие твердые и блестящие, но хрупкие пленки. Способность этих смол совмещаться как с сырыми, так и полимеризованными растительными маслами показывает возможный путь их пластификации. Высокоплавкие смолы получены при этерификации бетулинола смоляными кислотами. Масляные лаки, содержащие дирезинаты бетулинола, дают пленки с более высокими показателями твердости и большей скоростью высыхания, чем лаки, содержащие глицериновые эфиры канифоли. Интересные свойства имеет диолеинат бетулинола: в присутствии сиккатива он дает быстро высыхающие, твердые пленки, что резко отличает его от всех описанных ранее эфиров олеиновой кислоты и различных многоатомных спиртов (глицерина, пентаэритрита, маннита). Учитывая это, автор предположил, что введение бетулинола в состав смол типа глифталевых позволит значительно повысить скорость высыхания и твердость пленок. Действительно, путем алкоголиза растительных масел при температуре 240...265°C смесью бетулина и глицерина с последующей этерификациеи свободных гидроксигрупп фталевым ангидридом получены смолы, дающие пленки с высокими физико-химическими показателями при одновременной значительной экономии фталевого ангидрида.
Позднее Аслам и Алам сообщили, что покрытия из смол на основе смоляных кислот и бетулинола имеют повышенную стойкость к воде и царапинам по сравнению с эфирами смоляных кислот с пентаэритритом [121], а эфиры бетулинола. с жирными кислотами льняного масла дают покрытия более высокого качества, чем без бетулинола [122].
Изучена возможность использования в качестве пленкообразователей эфиров бетулинола и жирных кислот таллового масла [75]. Пленки получали сушкой на воздухе в присутствии нафтената кобальта. Пленки, за исключением высушенных при 150°C, мутнеют в воде. Все пленки нестойки к органическим растворителям.
Смолы, полученные сополимеризацией ненасыщенных полиэфиров из малеинового ангидрида и гликолей со стиролом, в случае введения бетулинола в эфир имеют более высокую температуру размягчения и повышенную водо - и химстойкость. Авторы отмечают, что затруднения, связанные с синтезом высокомолекулярной полиэфирной смолы из малореакционноспособного бетулинола, вполне преодолимы [78].
Проводились исследования по синтезу полиуретанов. Так, на основе смеси примерно равных количеств моно - и дипальмитата бетулинола и изоцианата марки Desmodur N синтезированы полиуретаны. Пленки из них бесцветны, прозрачны, имеют карандашную твердость 2H и достаточную устойчивость к органическим растворителям [75]. Полиуретаны на основе бетулинола и изоцианата марки Desmodur E22 образуют пленки с прочностью на разрыв 12400 кПа и коэффициентом растяжения 315%. Эти наилучшие показатели определены для пленок из полиуретана, полученного полимеризацией в толуоле. Выбор растворителя имеет важное значение [82].
Описан синтез диакрилатов и диметилметакрилатов бетулинола взаимодействием последнего с 2,3-эпоксипропилакрилатом и 2,3-эпокси-пропилметакрилатом в растворе диоксана, толуола и пиридина. Максимальный (75%) выход продукта конденсации достигнут при использовании пиридина. При полимеризации акрилатов в присутствии 2,2'-азоизобутиронитрила получаются щелоче - и термостойкие полимеры, начальная температура потери массы достигает 250°С [123].
Диглицидиловый эфир бетулинола предложен в качестве мономера для получения эпоксиполимеров с высокими диэлектрическими свойствами [124].
Эфир пальмитиновой кислоты бетулинола испытан в качестве пластификатора поливинилхлорида [75]. Установлено, что при замене половины стандартного пластификатора (диоктилфталата) эфир хорошо совмещается со смесью, образуя свободно текучую пасту. Отлитая из нее пленка мягкая, бурая, прозрачная. После месячного хранения пленки при комнатной температуре выпотевания эфира не наблюдается.
Бетулинол предложен в качестве светостабилизатора древесной массы. Бетулинол действует как отражатель фотохимически активного света и не участвует в химических реакциях [125].
Кислые эфиры бетулинола (сукцинат, фталат, тетрахлорфталат) – эффективные эмульгаторы для систем вазелин-вода и кокосовое масло-вода [126]. Рекомендуется применять их в качестве эмульгаторов, диспергаторов и компонентов лекарственных препаратов [76].
О биологической активности бетулинола известно давно. Еще в прошлом веке Велёр (Wheeler, 1899) отметил антисептические свойства бетулинола, его использовали для стерилизации пластырей и бинтов. Бетулинол наносили для снятия зуда (Holmes, 1921). Бетулинол, лупеол и бетулиновая кислота идентифицированы в эфирном экстракте из коры В. utilis, используемой в индийской медицине также в качестве антисептика [127]. Бетулин и бетулиновая кислота содержатся также в противоопухолевых препаратах растительного происхождения [128, 129].
Противоопухолевая активность бетулинола и других тритерпеноидов лупанового ряда показана многими исследователями. Так, бетулинол эффективен против саркомы Уолкера 256 (Walker 256) [130, 131], аденомы грудной железы MCF-7 in vitro и лейкемии Р 388 in vivo и проявил большую активность, чем известный ионотодиол [132]. Бетулинол особенно эффективен против эпидермоидной канцеромы носоглотки (in vitro) [133]. Бетулиновая кислота проявляет цитостатическую активность против carcinoma cell line-115 толстой кишки [134]. Бетулинол, лупеол, бетулиновая кислота оказывают ннгибирующее действие на вирус Эпштейна-Барра [129]. Высокой ингибирующей активностью по отношению к этому вирусу в лимфобластоидных клетках Раджи обладают эритродиол и бетулиновая кислота [135]. Диацетат бетулина, другие ацилоксипроизводные с C≤18, тозилоксипроизводные являются активными компонентами противораковых препаратов [136].
Бетулинол, лупеол и бетулиновая кислота проявляют бактериостатическую активность против Escherichia coli, Salmonella typhi, Shidella ftexneri и Staphylococcus aures [129]. Противовоспалительной активностью обладает кофеат бетулиновой кислоты [137, 138].
В работе [139] изучено влияние шести тритерпеноидов, в том числе бетулинола, его диацетата и аллобетулина, на резистентность организма к повреждающим воздействиям и установлено, что заслуживает внимания сочетание гастро - и гепатопротектиновых свойств у бетулинола.
С целью выявления взаимосвязи между структурой тритерпеноидов и стероидов и их физиологической активностью изучено влияние 3β,28-дигидроксилупен-30-аля (XXXI), 3β,20,28-тригидроксилупана (LVI) и гетеробетулина (XXVII) на водно-солевой обмен и показано, что они влияют на скорость выведения почкой крысы воды, натрия и калия [140].
Бетулинол давно предложен в качестве компонента для туалетных порошков и косметических средств (Puranen, 1941). Бетулинол оказывает лечебное действие на волосы, поэтому используется как добавка в шампуни [141]. Литература этого направления нами не рассматривается.
Разнообразной биологической активностью обладают также терпеноиды олеананового и урсанового ряда. В качестве примера укажем, что 3-карбоксиметилурсоловая кислота обладает высоким гиполипидемическим действием [142], а производные глицирризиновой кислоты (олеанановый ряд) проявляют противоязвенную, противовоспалительную, анальгезирующую, жаропонижающую активность и стимулируют репаративную регенерацию кожи (РЖХ, 1993, 21О101П—21О107П).
Изучено антифидантное действие различных соединений - алкалоидов, флавоноидов, полиолов и бетулинола — на насекомых Dysdercus отряда Heleroptera (клопы), встречающихся на хлопчатнике, и показано, что бетулинол обладает эффективным отпугивающим свойством на D. fulvoniger [143]. Антифидантной активностью по отношению к колорадскому картофельному жуку бетулиновая кислота, ее ацетат и кофеат не обладают. Олеаноловая кислота более активна [33].
Работ по использованию субериновых кислот мало. Согласно патенту США [144], сополимеры 1,4-циклогександиметилола и смеси субериновой и фталевой кислот являются хорошими клеями-расплавами для склеивания ненагретых металлов.
Разработан способ получения оксиэтилированного суберина [145]. Получаемое поверхностно-активное вещество предложено использовать в качестве деэмульгатора водонёфтяных эмульсий [146]. По эффективности действия он в 3-4 раза превосходит известный реагент ОП-10 и сравним с высокоэффективными реагентами проксанолом, диссольваном 4411.
Не исключено, что субериновые кислоты бересты могут иметь антибактериальную или антигрибковую активность по аналогии со свойствами субериновых кислот из коры черной ольхи. Эти кислоты показали значительную противогрибковую активность против Aphanoyces euteiches. Против Streptococcus faecium и Escherichia coti они не активны [147].
Сообщалось также [6] о работе шведских исследователей по изысканию путей использования экстрактивных веществ и субериновых кислот [148].
Итак, заканчивая обзор, можно констатировать, что береста - многотоннажный отход фанерного и некоторых других производств – является интересным химическим сырьем, содержащим 20...40% экстрактивных веществ и 30...40% суберина. Способы выделения экстрактивных веществ и суберина в виде субериновых кислот достаточно просты и технически осуществимы. Основной компонент экстрактивных веществ – бетулинол, пентациклический тритерпеноид C30H50O2; концентрация его в экстрактивных веществах не менее 60%. Простой перекристаллизацией можно получить бетулинол с содержанием основного вещества 95%. Субериновые кислоты – сложная смесь алифатических C18-C22 моно - и дикарбоновых насыщенных и ненасыщенных окси- и эпоксикислот. Экстрактивные вещества и субериновые кислоты можно использовать в производстве таких технических продуктов, как пленкообразователи, пластификаторы, поверхностно-активные вещества. Бетулинол, сам по себе обладающий биологически активными свойствами, представляет большой интерес для синтеза разнообразных производных – потенциальных биологически активных веществ.
СПИСОК ЛИТЕРАТУРЫ
1. Использование древесных отходов фанерного спичечного производств. – М., 1987 – 182 с.
2. . . , , Исследования в области переработки всей биомассы деревьев лиственных пород. 1. Физические свойства и химический состав отдельных частей дерева березы и осины // Химия древесины. – 1980. – № 4. – С. 98-102.
3. , , Химический состав коры и древесины хвойных и лиственных пород // Гидролизн. и лесохим. пром-сть. – 1977. – № 4. – С. 9-11.
4. , К вопросу о химическом составе древесной коры. Кора березы (Сообщ. 1) // Лесохим. пром-сть. – 1932. – № 3-4. – С. 30-33.
5. , Химический состав бересты березы // Сб. тр. СвердНИИП древесины. – М., 1969. – Вып. 4. – С. 86-93.
6. Ekman R. The suberin monomers and triterpenoids from the outer bark of Belula verrucosa Ehth. // Holzforschung. – 1983. – Bd. 37, N 4. – S. 205-211.
7. Jensen W. Om ytskiktsavfallet vid framstalling av bjorkfaner // Acta Acad. Aboensis. Math. Phys. – 1948. – Bd. XVI. – S. 3-135.
8. , , О химическом составе древесной коры (Сообщ. 6). О суберине // Лесохим. пром-сть. – 1938. – № 5. – С. 8-12.
9. , Химия коры // Химия древесины / Под ред. . – М., 1967. – С. 350-410.
10. , , Утилизация древесной биомассы. – Красноярск, 1987. – 166 с.
11. , , Состав тритерпеноидной фракции экстрактов внешней коры Betuta pendula н Belula pubescensll Химия древесины. – 1990. – № 6. – С. 74-77.
12. , , Изопреноиды из внешней коры Betuia mandshurica, Beluta costata и Betula davurica // Экстрактивные вещества древесных растений: Тез. докл. Всесоюз. конф. – Новосибирск, 1986. – С. 57-58.
13. , , Уварова Н. И. Изучение состава внешней коры Betuta mandshurica // Химия природ. соед. – 1986. – № 15. – С. 647-648.
14. , , . Изопреноиды внешней коры дальневосточных берез Betula costata и Belula ermanii // Химия природ. соед. – 1987. – № 4. – С. 609-610.
15. Pasich J. Emulgatory z grupy trojterpenoidow. Cz. 1. Ekstrakcja betuliny z kory brozowy Betula alba L. za pomoca trojchloretylenu // Farmac. polska. – 1964. – Bd. 20, N 23-24. – S. 911-914.
16. Jaasketainen P. Betulinol and its utilisation // Paperi ja Puu – Pap. och Tra. – 1981. – N 10. – P. 599-603.
17. Eckerman Ch., Ekman R. Comparison of solvents for extraction and crystallisation of betulinol from birch bark waste // Paperi ja Puu – Pap. och Tra. – 1985. – N 3. – P. 100–106.
18. Ekman R., Eckerman Ch., MalUla Т., Suokas Е. Saponification of biopolyesters to acide or their salts // Fr. Demande 2 05 sept. 1986. Fl Appl. 85/863, 04 Mar. 1985; 13 р.
19. Получение бетулина и синтез сложноэфирных пленкообразователей на его основе: Автореф. дис.... канд. техн. наук. – М., 1953. – 10 с.
20. Ekman R., Eckerman Ch. Aliphatic carboxylic acids from suberin in birch outer bark by hydrolysis, methanolysis and alkali fusion // Paperi ja Puu. – 1985. – Vol. 67, N 4. – P. 255–256, 258–260, 262, 273.
21. А. с. 382657 СССР. Способ выделения бетулина и суберина / , Ц БИ. – 1973. – № 23. – С. 66-67.
22. Выделение, исследование и применение высокомолекулярных карбоксил - и гидроксилсодержащих лесохимических продуктов как сырья для производства ПАВ: Автореф. дис....канд. техн. наук. – Л., 1975. – 19 с.
23. , Изопреноиды различных видов рода Betula // Химия природ, соед. – 1988. – № 3. – С. 325-341.
24. Hayek Е. W. Н., Jordis U., Moche W., Sauter F. A bicentennial of betutin // Phytochem. – 1989. – Vol. 28, N 9. – P. .
25. , , Тритерпеноиды коры и веточек Betula davurica // Химия природ, соед. – 1985. – № 3. – С. 414-415.
26. , , Ким Хя Ок, О случае аномально высокого содержания лупеола в коре белой березы // Журн. прикл. химии. – 1967. – Т. 40, Вып. 4. – С. 920-921.
27. . , Спектры поглощения лентациклических тритерпеноидов в серной кислоте // Химия природ, соед. – 1971. – № 7. – С. 147–150.
28. Ekman R.. Sioholm R. Betulinol 3-cafteate in outher bark of Betula verrucosa Ehrh. // Finn. Chem. Lett. – 1983. – N 5-6. – P. 134-136.
29. Rimpler H., Kuhn H., Louckert Ch. Die Triterpene von Betula pendula Roth. und Betula pubescens Ehrh. Eine vergleichende Untersuchung der Rinden // Arch. Pharmaz. und Ber. Dtsch. Pharmaz. Ges. – 1966. – Bd. 299. – N 5. – S. 422-428.
30. Ohara S., Yatagai M., Hayashi Y. Utilization of wood extractives. 1. Extractives from the bark of Betula plalyphtilla Sukatchev var, japonica Hara // Mokuzai Gakkaishi. – 1986. – Vol. 32, N 4. – P. 266-273.
31. Cote В. I. W., Bentley M. D., Ниа Yun, Ви Lin. Triterpenoid constituens in the outer bark of Betula alleghaniensis (yellow birch) // J. Wood Chem. and Technol. – 1991. – Vol. 11, N 2. – P. 209-223.
32. Cole В. I. W., Bentley M. D., Ниа Yun. Triterpenoid constituens in the outer bark of Betula lenia (black birch) // Hoizforschung. – 1991. – Bd. 45, N 4. – S. 265-268.
33. Ниа Yun. Bentley M. D., Cole B. I. W., Murray K. D., Alford A. R. Triterpenes from the outer bark of Betula nigra // J. Wood Chem. and Technol. – 1991. – Vol. 2, N 4. – P. 503-516.
34. Heino K; Jarolin V., Sorm F. Uber einige inhaltstoffe des weissen teiles der birkenrinde // Collect. Czech. mun. – 1965. – Vol. 30. – P. .
35. Seshard Т. R., Vedantham Т. H. Chemical examination of the barks and heart-woods of Betula species of American orign // Phytochem. – 1971. – Vol. 10. N 4. – P. 897-898.
36. Lindgren В. O., Svahn С. M. Lupan-3β,20-diol and lupan-3β,20,28-triol in bark from birch Betula verrucosa Ehrh. // Acta Chem. Scand. – 1966. – Vol. 20, N 6. – P. .
37. Madani С., Chambaz E. M. High resolution glass capillary columns with chemically bonded stationary phases: Application to the gas chromatographic analysis of sterols and steroids in biological extracts // J. Amer. Oil Chem. Soc. – 1981. – Vol. 58. – P. 63-70.
38. Ikekawa N. Gas-liquid chromatography of polycyciic triterpenes // Methods Enzymol. – 1965. – Vol. 15. – P. 200-219.
39. Ikan R., Gottlieb R. Gas chromatography of tetra - and pentacyclic triterpenes // Isr. J. Chem. – 1970. – Vol. 8. – P. 685-689.
40. Ikekawa N.. Natori Sh., Itokawa H, Tobinaga S., Malsui M. Gas chromatography of triterpenes. 1 Ursanane, oleanane and lupane groupe // Chem. Amer. Pharmac. Bull. – 1965. – Vol. 13. N 3. – P. 316-319.
41. Itoh Т., Uetsuki T., Tamara Т.. Matsumolo Т. Characterization of triterpene alcohols of seed oils from some species of theaceae, phytolaccaceae and sapotaceae // Lipids. – 1980. – Vol 15. – P. 407-411.
42. O'Connel M., Bentley M. D., Campbell Ch. S., Cole B. 1. W. Betulin and lupeol in bark from four white-barked biches // Phytochem. – 1988. – Vol. 27, N 7. – P. .
43. Ohmoto Т., Ikuse M., Natori S. Triterpenoids of the gramineae // Phytochem. – 1970. – Vol. 9. – P. .
44. , Белова H. В. Газожидкостная хроматография тритерпеноидов. II. Производные пентациклических спиртов и кислот. Анализ кислот из растительных экстрактов // Химия природ. соед. – 1975. – № 11. – С. 735-739.
45. , Содержание бетулинола во внешней коре березы // Фармация. – 1992. – Т. 41. – С. 24-27.
46. Lin J. Т., Nes W. D., Heftmann E. High-performance liquid chromatography of triterpenoids // J. Chromatogr. – 1981. – Vol. 207. – P. 457-463.
47. Taipale H. Т., Lapinjoki S. P. Use of evaporative light scattering mass detection in high perfomance liquid chromatography of triterpenes in the bark resin of Betula species // Phytochem. Anal. – 1991. – Vol. 2, N 2. – P. 84-86.
48. . , Пахало H. Д., Уварова H. И. Кофеат олеаноловой кислоты из внешней коры Betula davurica // Химия природ, соед. – 1985. – С. 270-271.
49. Похило H. Д., , Уварова H. И. Тритерпеноиды внешней коры Betula maximowicziana // Химия природ, соед. – 1986. – N 5. – С. 650-651.
50. Khan M. A. Atta-ur-Rahman. Karachic acid. New triterpenoid from Betula utillis // Phytochem. – 1975. – Vol. 14, N 3. – P. 789-791.
51. Jensen W. Studies on suberin. I. The suberin in the outer bark of Betula verrucosa // Paper! Ja Puu. – 1950 – Vol. 32 B, N 9. – Р. 261-266. II. The suberin in core of Quercus suber // Paper and Timber. – 1950. – Vol. 32. N 10. – Р. 291-292. III. The structure of phellonic acid // Paper! ja Puu. – 1950. – Vol. 32 B, N 10. – P. 293-294 IV. Isolation of phellonic acid from suberin of Quercus suber // Paperi ja Puu. – 1952. – Vol. 34, N 12. – P. 467-469.
52. Jensen W., Ihalo P., Varsa K. Studies on suberin. VIII. Separation of the acids of suberin by means countercurrent distribution of their methyl esters // Pap. och Tra. – 1957 – Vol.39, N 4. – P.237-242.
53. Jensen W., Ostman R. Comparison of the chemical composition of suberins from Betula verrucosa and Quercus suber // Paperi ja Puu. – 1954. – Vol. 36 – P. 427-428.
54. Jensen W., Rinne P. Studies on suberin. VI. Isolation and constitution of phloionolic acid from the suberin of Betula verrucosa and Quercus suber // Paperi ja Puu. – 1954. – Vol. 36. N 2. – P. 32-34.
55. Jensen W., Tinnis W. Studies on suberin. IX. Identification of unsaturated acids in suberin of Quercus suber and Betula verrucosa // Paperi ja Puu. – 1957 – Vol. 39. – P. 261-264.
56. Eglinton G., Hunneman D. H., McCormik A. Gas chromalographic – mass spectrometric studies of long chain hydroxy acids. III. The mass spectra of the methyl ester trimethyliylil ethers of alifatic hydroxy acids. A facile method of double bond location // Org. Mass Spectrometry. – 1968. – Vol. 1. – P. 593-611.
57. Holloway P. J. The composition of suberin from the corks of Quercus suber L. and Betula pendula Roth. // Chem. Phys. Lipids. – 1972. – Vol. 9. – P. 158-170.
58. Holloway P. J., Deas A. H. B. Occurrence of positional isomers of dihydroxyhexadecanoic acid in plant cutins and suberins // Phytochem. – 1971. – Vol. 10. – P. .
59. Holloway P. J., Deas A. H. B. Epoxy-octadecanoic acid in plant cutins and suberins // Phytochem: – 1973. – Vol. 12. – P. .
60. Bolmgren I., Noris T. Direct methylation of salts of acid in hydrolysis mixtures of natural products by phase transfer catalysis. An investigation of the suberin fraction of birch bark (Betula verrucosa Ehrh.) // Acta chem. Scand. – 1981. – Bd. 35. – S. 742-743.
61. Ekman R., Ketola M. Long-chain ω-hydroxy acids in Finnish sphangnum peat // Finn. chem. Lett. – 1981. – N 1. – P. 44-48.
62. Waltan Т. J., Kolattukudy P. E. Determination of the structures of cutin monomers by a novel depolymerisation procedure and combined gas chromatography and mass Spectrometry // Biochem. – 1972. – N 11. – P. .
63. Gilbert J. D., Brooks C. I. W. Absolute configuration of secondary alcohols: Refinement and extension of a gas-chromatografic modification of Horeau's method // Anal Lett. – 1973. – Vol. 6. N 7. – P. 639-648.
64. Lehn J.-M., Ourisson G. Resonance magnetique nucleaire de produits naturels. I. Introduction generale triterpenes de la serie du lupane: les groupes methyles // Bull. Sor. Chim. France. – 1962. – N 6. – P. .
65. Lehn J.-M., Vystrcil A. Resonance magnetique nucleaire de produits naturels. VI. Triterpenes derives de la betuline // Tetrahedron. – 1963. – Vol. 19. – P. .
66. Sholichin M., Yamasaki K., Kasai R., Tanaka O. Carbon-13 nuclear magnetic resonance of lupane-type triterpenes, lupeol, betulin and betulinic acid // Chem. Pharm. Bull. – 1980. – Vol. 28, N 3. – P. .
67. Lugemwa F. H., Huang F.-Y., Bentley M. D., Mendel M. J., Alford A. R. A heliothis zea antifeedant from the abundant birch-bark triterpene betulin // J. Agric. Food Chem. – 1990. – Vol. 38, N 2. – P. 493-496.
68. Das Pratap Kumar, Mukherjee Manika. Crystal and molecular structure of betuline diacetate C34H54O4 // Indian J. Phys. – 1983. – Vol. 57A. N 3. – P. 182-189.
69. Barton D. H. R., Holness N. I. Triterpenoids. V. Some relative configuration in rings C, D and E the amyrin and lupeol group of triterpenoids // J. Chem. Soc. – 1952. – P. 78-92.
70. Lawrie W., McLean J., Taylor G. R. Triterpenoids in the bark of mountain ash (Sorbus aucuparia L.) // J. Chem. Soc. – 1960. – P. .
71. Errington S. G., Chlsalberti E. L., Jefferies P. R. The chemistry of the Euphor-biaceae. XXIV. Lup-20(29)-ene-3β,168,28-triol from Bayeria brevifolia var. // Austr., J. Chem. – 1976. – VoL 29. N 28. – P. .
72. Klinot J., Vystrcil A. Nebenprodukte bei der umsetzung von allobetulin zu hetero-betulin // Collect. Czech. mun. – 1964. – Vol. 29, N 2. – P. 516-530.
73. Денисенко M. В., Одинакова Л. Э., Уварова H. И. Окисление тритерпеноидов – производных 18-лупена и 18,19-секолупана тетраоксидом рутения по улучшенной методике // Химия природ, соед. – 1989. – № 5. – С. 655-664.
74. Yokoyama Y., Moryama Y., Tsuyuki Т., Takahashi T. Synthesis of lupane derivatives // Koen Yoshishu Koryo, Terupen oyobi Seiyu Kagaku ni Kansuru Toronkai, 23rd 1979 (Japan). – Chem. Soc. Japan. – 1979. – P. 255-257.
75. Era V., Jaaskelainen P., Ukkonen K. Fatty acid esters from betulinol // J. Amer. Oil Chem. Soc. – 1981. – Vol. 58, N 1. – P. 20-23.
76. Pasich J. Emugatory z grupy trojterpenoidow. Cz. II. Otrzvmywanie niektorych esterow betuliny // Farmac. polska. – 1965. – B. 21, N 1-2. – S. 9-12.
77. Пат. ПНР № 000. Pasich J. Sposob wytwarzania kwasnego dwuesteru ftalowego betuliny.
78. Vasnev V. V., Konkina I. N., Korshak V. V., Vinogradoaa S. V., Lindberg J. J., Jaaskelainen P., Pironen K. Syntheses of unsaturated polyesters containing betulinol moieties // Macromol. Chem. – 1987. – Vol. 188. – P. 683-691.
79. Lehlonen A., Era V., Mustonen Т., Anitalainen E. Oligoesters from betulinol //Macromol. Chem.. Rapid Commun. – 1980. – N 1. – P. 499.
80. , , M., Уварова Н И. Гликозилирование бетулина и его ацетатов в присутствии карбоната кадмия // Химия природ, соед. – 1984. – № 2. – С. 182-187.
81. , , Гликозилирование тритерпеновых спиртов ряда лупана // Химия природ. соед. 1988. – № 2. – С. 212-217.
82. Era V., Jaaskelainen P., Ukkonen K. Polyurethanes from betulinol // Angew Makromol. Chem. – 1980. – Bd. 88. – S. 79-88.
83. Elseviers Encyclopaedia of Organic Chemistry. Series III. – Vol. 14. – London 1952.
84. Ludwiczak R. S., Wrzeclono V., Szczawinska K., Mroczkiewicz A. Azotowe pochodne trojterpenow. III. Pochodne lupanu. II // Rocz. chem. – 1971. – R. 45, N 6. – S. .
85. Vystrcil A., Kfeiek V., Budesinsky М. Elimination reactions on angular hydroxymethyl group of the lupane skeleton // Collect. Czech. mun. – 1974. – Vol. 39, N 9. – P. .
86. Wrzeciono V., Dembezynska Н. Azotowe pochodne trojterpenow. I. Pochodne lupanu // Roczn. chem. – 1969. – R. 43, N 7-8. – S. .
87. Hair М. R., Hilgard S., Klinot J., Waisser K., Vystrcil A. Oxidation rates of triterpenoid secondary alcohols with chromic acid // Collect. Czech. mun. – 1976. – Vol.41, N 3. – P. 770-790.
88. , , Окисление бетулина, дигидробетулина и 3β,28-гидрокси-18-лупена тетраоксидом рутения // Химия природ. соед. – 1991. – № 3. – С. 430-431.
89. , , Ретроальдольная реакция производных 28-гидрокси-18,19-секолупан-18,19-диона или окисление тетраоксидом рутения производных 28-гидрокси-18-лупена – пути синтеза производных 28-нор-18,19-секолупан-18,19-диона // Журн. орг. химии. – 1991. – Т. 27, вып. 10. – С. .
90. Dutta Gopal, Bose Samarendra Н. Preparation and circular dichroism studies of triterpene lactones of lupane series // Tetrahedron Lett. – 1988. – Vol. 29, N 45 – P. .
91. Pradhan В. P., Ghosh P., Chakraborty S. Oxidation of triterpenoids. X. Oxidation of lupenyl acetate and methyl acetylbetulinate with selenium dioxide and hydrogen peroxide in tert-butanol // Indian J. Chem., Sect. B. – 1991. – Vol. 30B, N 6. – P. 549-553.
92. Klinot J., Hovorkova N., Vystrcil A. Triterpenes. XVIII. Oxvdation of the isopropenyl group with peracids // Collect. Czech. munl – 1970. – Vol. 35, N 4. – P. .
93. Patra A. Chaudkuri S. K. Studies on triterpenoids: treatment of 3-acetylbetulinic acid with m-chloroperbenzoic acid and sulfuric // Indian J. Chem. B. – 1988. – Vol. 27, N 2. – P. 170-172.
94. Tori М., Matsuda R., Sono М., Kohama Y., Asakavoa Y. The reaction of lupane and friedo-oleanane type triterpenes with m-chloroperbenzoic acid // Bull. Chem. Soc. Japan. – 1988. – Vol. 61. N 6. – P. .
95. Sejbal J., Klinot J., Hrncirova D., Vystrcil A. Oxydation of 19β,28-epoxy-18α-oleanan-3-one and 1-one with peracids // Collect. Czech. mun. – 1985. – Vol. 50. N 12. – P. .
96. Vistrcil A., Btecha Z. A rewised structure for the product of oxidation of betulin with mercuric acetate // Chem. Ind. – 1969. – N 13. – P. 418-419.
97. Vystrcil A., Btecha Z. Triterpenes. XIX. Dehydrogenation of derivatives of 20(29)-lupene with mercuric acetate // Collect. Czech. mun. – 1970. – Vol. 35. N 11. – P. ; XXII. Dehydrogenation of derivatives of 20(29)-lupene with mercuric acetate. II. Degradation of the side chain // Collect. Czech. mun. – 1972. – Vol. 37, N 2. – P. 610-623; XXIII. Dehydrogenation of derivatives of 20(29)-lupene with mercuric acetate. III. Dehydrobetulinic acid // Collect. Czech. mun. – 1972. – Vol. 37, N 2. – P. 624-636.
98. Allison J. М., Lawrie W., McLean J., Taylor A. М. Dehydrogenation with mercuric acetate in the lupane series. 1. Betulin and betulinic acid // J. Chem. Soc. – 1961. – P. .
99. Vystrcil A., Protiva J. Photo-oxidation of 28-lupanol and its derivatives // Collect Czech. mun. – 1974. – Vol. 39, N 5. – P. .
100. Lehn J.-M., Ourisson G. Synthesis dans la serie du lupane // Bull. Soc. Chem. France. – 1962. – N 6. – P. .
101. Ready R. P., Ready V. R. N., Ravindranath A., Ramiah T. S. Azatriterpenes. IX. A simple one step synthesis of За-aza-A-homo-3-oxopentacyclic triterpenes // Indian J. Chem., Sect. B. – 1989. – Vol. 28B, N 10. – Р. 850-851.
102. Govardhan С., Reddy R. P., Ramiach T. S., Rao T. V. Azatriterpenes. IV. Synthesis of ring A fused (3,2-C)isoxazoles and (3,2-C)furazans of methyl oleanolate and methyl betulinate // Indian Chem Soc. – 1983. – Vol. 60. N 9. – P. 858-860.
103. Hase T. A., Suokas E., Weckman A. Dehydrogenation of triterpenoid alcohols in alkali melt. A short synthesis of the so-called jasminol // mun. – 1981. – Vol. 11, N 6. – P. 489-492.
104. , Синтез триоксилупана // Жури. общ. химии. – 1976. – Т. 46, вып. 12. – С. .
105. А. с. 505621 СССР. Способ получения триоксилупана / Ц БИ. – 1976. – № 9. – С. 61.
106. Sejbal J., Klinot J., Protiva J., Vystrcil A. Reactions of triterpenoid ketons with sulfur and morpholine under the conditions of Willgerodt-Kindler reaction // Collect. Czech. mun. – 1986. – Vol. 51, N 1. – P. 118-127.
107. Mahato S., Banerjee S. K., Chakravarti R. N. Effect of reney nickel on triterpenoids // Bull. Calcutta School Trop. Med. – 1968. – Vol. 16. N 4. – P. 122, 125.
108. Mahato S., Banerjee S. K., Chakravarti R. N. Reactions in higli boiling solvent. II. Effect of reney nickel an triterpenoids // Tetrahedron. – 1971. – Vol. 27, N 1. – P. 177-186.
109. Chretien-Bessiere Y., Duhamel L. Sur la presence de betuline dans le liege // Bull. Soc. Chim. France. – 1963. – N 2. – P. 228-229.
110. Protiva J., Lepsa L., Klinotova E., Klinot J., Krecek V., Vystrcil A. Homogeneous hydrogenation and deuteration of pentacyclic triterpenoids: duble bonds in sidechains // Collect. Czech. mun. – 1981. – Vol.46. N 11. – P. .
111. Vystrcil A., Krecek V., Budesinsky М. Elimination reaction of angular hydroxy-methyl group of 20(29)-lupene derivatives // Collect. Czech. mun. – 1983. – Vol. 48, N 5. – P. .
112. Anjaneyulu A. S. R., Harayana Rao М., Sree A., Murty V. S. Wagner-Meerwein rearrangements in lupanes // Indian J. Chem. – 1980. – Vol. 19B. – P 735-738
113. Klinot J., Sumenova V., Vystrcil A. Triterpenes. XXI. 3,4-Seko-derivatives of betulinic acid // Collect. Czech. mun. – 1972. – Vol. 37, N 2. – P. 603-609.
114. Rao К. L., Ramraj S. K., Sundararmaiah T. Aza-triterpenes. II. A-aza-triterpenes of the lactones of methyloleanonate and methvl betulonate // J. Indian Chem. Soc. – 1980. – Vol. 57. N 8. – P. 833-834.
115. Briesekorn С. Н., Deeken М., Degel U., Atallah A. Die triterpenkolile des rosmarin-blatters // Arch. Pharmaz. und Ber. Dtsch. Pharmaz. Oes. – 1966. – Bd. 299, N 8. – S. 663-670.
116. Zimmerman W., Seemutler E. Degradation of raspberry suberin by Fusarium sotani f. sp. pisi and Armillaria mellea // Phytopathol. Z. – 1984. – B. 110, N 3. – S. 192-199.
117. Kollattukudy P. E., Crawford М. S. The role of polymer degrading enzimes in fungal pathogenesis // Mol. Determ. Plant Dis.. (U. S. – Jpn. – Sem.), 5th 1985 (Pub. 1987), 75 – 95 (Eng.) Edited by Nishimura, Syoyo; Vance, Carrol P.; Doke, Noriyuki Jap. Sci. Soc. Pres: Tokyo, Japan.
118. Handbuch der Pharmazeutischen Praxis. – 4th Edn. (1967–1980) // Ed. Н. Hager, P. Н. List, L. Horhammer. – Berlin.
119. Спиртовые мебельные лаки из отечественного лесохимического сырья. – М„ 1949. – 170 с.
120. А. с. 69481 СССР. Способ получения лаковых смол / . . . Опубл. 31.10.47.
121. Aslam М., Alam К. Properties and applications of betulin based rosin esters // Pakistan J. Sci. Ind. Res. – 1961. – Vol. 4. – P. 62-65.
122. Aslam М., Alam K. Preparation of linseed fatty acids – betulinol esters and their evaluation as propertive coating vehicles // Pakistan J. Sci. Ind. Res. – 1965. – Vol. 8. – P. 31-36.
123. Era V., Mustonen Т., laaskelainen P. Polyakrylates from betulinol // Macromol. Chem., Rapid Commun. – 1981. – N 2. – P. 283-286.
124. А. с. 1671666 СССР. Диглицидиловый эфир на основе бетулинола в качестве мономера для получения эпоксиполимеров с высокими диэлектрическими свойствами / , . // БИ. – 1991. – № 31. – С. 18.
125. Заказов А. Н., , Добавки и светостойкость древесной массы // Бум. пром-сть. – 1984. – № 11. – С. 20-21.
126. Pasich J. Emulgatory z grupy trojterpenoidow. Cz. V. Wlasciwosci emulgujace betuliny i jej niektorych estrow // Farmac. polska. – 1965. – Vol. 21, N 17-18. – S. 661-665.
127. Batta A. K., Ragaswami S. Crystalline chemical components of some vegetable drugs // Phitochem. – 1973. – Vol. 12. – P. 214-216.
128. Maurya S. K., Devi S., Pandey V. В., Khosa R. 1. Content of betulin and betulinic acid, antiturmor agents Zizyphus species // Fitoterapia. – 1989. – Vol. 60, N 5. – P. 468-469; РЖХим, 1990, 12Е77.
129. Liu J., Zuo C. Исследование химических компонентов растения Pyrus communis // Zhiwu Xuebao, Acta bot. sin. – 1987. – Vol. 29, № 1. – P. 84-87; РЖХим, 1987. 12Е64.
130. Seth K., Bianchi E. et. al. // J. Pharm. Sci. – 1973. – Vol. 62. – P. 139.
131. Seth K., Joland S et. al. // J. Pharm. Sci. – 1972. – Vol. 61. – P. 1819.
132. Kahlos K., Kangas L., Hullen R. // Acta Pharm. Fenn. – 1987. – Vol. 96. – P. 33.
133. Miles D. Н., Kokpol U. et. al. // J. Pharm, Sci. – 1974. – Vol. 63. – P. 613.
134. Tomas-Barbsran F. A., Hosteltmanu K. A cytotoxic triterpenoid and flavonois from Crossopteryx febrifuga // Planta Med. – 1988. – Vol. 54, N 3. – P. 266-267.
135. Konoshima Т., Takasaki M., Kozuka М. Studies on inhibitors of skin-tumor promotion. I. Inhibitory effects of triterpenes from Euptelea polyandra on Epstein. Barr virus activation // J. Nat. Prod. – 1987. – Vol. 50, N 6. – P. ; РЖХим, 1988, – Р. 170-173.
136. Pat.() Japan. Противораковые агенты, содержащие бетулнн / Н. Lamaguchi, M. Sugimoto, Т. Mwakami, N. Tanaka // СА. – 1990. – Vol. 112,48788.
137. Otsuka H., Fujioka S. et. al. // Chem. Pharm. Bull. – 1981. – Vol. 29. – P. 3099.
138. Rang V., Ye X. C. Zhongguo Zhongguao Zazhi (Gil.) – 1989. – Vol. 14. – P. 681.
139. Сравнительная оценка влияния некоторых тритерпеновых соединении на резистентиость организма к повреждающим воздействиям // Экстрактивные вещества древесных растений. – Новосибирск, 1986. – С. 160-161.
140. , , Соколова M. M. Пентациклические тритерпены и экскреция ионов почкой крысы // Бюл. эксперим. биологии и медицины. – 1975. – Т. LXXIX, № 3. – С. 63-65.
141. Howak G. A. Cosmetic and medicinal properties of the birch // Amer. Perfumer Cosmet. – 1966. – N 1. – P. 37-38.
142. A. c. 1550907 СССР. 3-Карбоксиметилен-окси-α-амиро-12-ен-28-овая кислота, обладающая гиполипидемнческой активностью / , , И. M. Дубровкин // БИ. – 1991. – № 16. – С. 227.
143. Schoonhoven L. M., Derksen-Koppers I. Effects of secondary plant substances in drinking behaviour in some Heteroptera II Entomol. Exp. Appl. – 1973. – Vol.16.– P. 141-145.
144. Pat 4079047 US Polyesters containing a critical range of suber in acid / Jackson W. J., Jr., Darnel W. R. // СА. – 1978. – Vol. 89, 147796K
145. A. c. 363743 СССР. Способ получения неионогенного поверхностно-активного вещества / , , // БИ. – 1973. – № 4. – С. 65.
146. A. c. 457713 СССР. Способ обезвоживания и обессолнвания нефти / Г. И. Федорищев. , , // БИ. – 1973. – № 3. – С. 60.
147. Putman L. J., Laks P. Е., Pruner M. S. Chemical constituents of black locust bark and their biological activity // Hoizforschung. – 1989. – Bd. 43, N 4. – S. 219-224.
148. Krindstad К. Forest industry by products as raw material for chemicals and proteins. – Rep. N 65 / Swed. Agency Tech. Dev. – Stockholm, 1977.
Поступило в редакцию 01.07.94



