Регуляция ПФП: ключевыми ферментами являются - глюкозо-6-фосфатдегидрогеназа, 6-фосфоглюконатдегидрогеназа, транскетолаза. Активность ПФП увеличивается при повышении отношения НАДФ+/ НАДФН, а также под влиянием инсулина и йодтиронинов. ПФП ингибируют глюкокортикостероиды.
Глюкоза крови
Концентрация глюкозы в крови поддерживается на постоянном уровне 3,3 - 5,5 ммоль/л. Он обеспечивается двумя противоположно направленными процессами: 1) поставляющими глюкозу в кровь (переваривание углеводов в ЖКТ, ГНГ, распад гликогена печени) и 2) использующими глюкозу в тканях (гликолиз, синтез гликогена, ПФП, синтез жира). При очень высокой концентрации глюкозы в крови (> 9 – 10 ммоль/л), она может быть снижена за счет выведения ее с мочой. Такое явление называют глюкозурией. В норме концентрация глюкозы в моче составляет 0,2 - 1,2 ммоль/л.
Регуляция глюкозы крови гормонами
Гормоны, повышающие концентрацию глюкозы в крови, называются гипергликемическими, к ним относятся: глюкагон, катехоламины, глюко-кортикостероиды и соматотропин (соматотропный гормон). Гормоны, снижающие концентрацию глюкозы в крови, называются гипогликеми-ческими. Гипогликемическим гормоном является инсулин. Гипергликемические гормоны повышают глюкозу крови за счет усиления распада гликогена печени и стимуляции ГНГ. Инсулин снижает глюкозу крови благодаря: 1) увеличению проницаемости клеточных мембран для глюкозы; 2) ингибированию процессов, поставляющих глюкозу (ГНГ, распад гликогена печени); 3) усилению процессов, использующих глюкозу (гликолиз, синтез гликогена, ПФП. синтез жира).
Патология углеводного обмена
Среди патологий углеводного обмена можно выделить такие патологии, причиной которых является наследственная или приобретенная недостаточность ферментов. К таким болезням относятся дисахаридозы, гликогенозы, агликогенозы, галактоземия.
Дисахаридозы вызваны недостаточностью дисахаридаз. При этом возникает непереносимость отдельных видов углеводов, например лактозы. Дисахариды подвергаются действию ферментов микрофлоры кишечника. При этом образуются кислоты и газы. Симптомами дисахаридозов являются метеоризм, понос.
Гликогенозы. В этом случае нарушен распад гликогена. Гликоген накапливается в клетках в больших количествах, что может привести к их разрушению. Клинические симптомы: увеличение размеров печени, мышечная слабость, гипогликемия натощак. Известно несколько типов гликогенозов. Они могут быть вызваны недостаточностью глюкозо-6-фосфатазы, фосфорилазы или g-амилазы.
Агликогенозы вызываются недостаточностью ферментов, участвующих в синтезе гликогена. В результате нарушается синтез гликогена и снижается его содержание в клетках. Симптомы: резкая гипогликемия натощак, особенно после ночного перерыва в кормлении. Гипогликемия приводит к отставанию в умственном развитии. Больные погибают в детском возрасте.
Галактоземия возникает при отсутствии гена, отвечающего за синтез уридилтрансферазы – ключевого фермента унификации галактозы. В результате в тканях накапливается галактоза и галактозо-1-фосфат, вызывая повреждение головного мозга и печени, а также помутнение хрусталика (катаракту). Свободная галактоза у таких больных в больших количествах обнаруживается в крови. Для лечения используется диета без молока и молочных продуктов.
Другим видом патологий углеводного обмена является нарушение гомеостаза глюкозы, которое характеризуется гипер - или гипогликемией.
Гипергликемия - это повышение концентрации глюкозы в крови. Причины гипергликемии:1) алиментарная (пищевая); 2) сахарный диабет (возникает при недостатке инсулина); 3) патология ЦНС (менингит, энцефалит); 4) стресс; 5) избыток гипергликемических гормонов; 6) повреждение островков поджелудочной железы (панкреатит, кровоизлияния). Невысокая и кратковременная гипергликемия не опасна. Длительная гипергликемия приводит к истощению запасов инсулина (сахарному диабету), потере воды тканями, поступлению ее в кровь, увеличению кровяного давления, увеличению диуреза. Гипергликемия в 50-60 ммоль/л может привести к гиперосмолярной коме.
Длительная гипергликемия приводит к неферментативному гликозилированию белков плазмы крови, эритроцитов, кровеносных сосудов, почечных канальцев, нейронов, хрусталика, коллагена. Это изменяет свойства белков, что является причиной тяжелых осложнений: тканевых гипоксий, склерозирования сосудов, катаракты, почечной недостаточности, нарушения нервной проводимости, снижения срока жизни эритроцитов и т. д.
Гипогликемия - это снижение концентрации глюкозы в крови.
Причины гипогликемии: 1) пищевая; 2) усиленное использование глюкозы (при тяжелой мышечной работе); 3) патология ЖКТ (воспалительные процессы); 4) патология печени; 5) патология ЦНС; 6) недостаток гипергликемических гормонов; 7) избыток инсулина (опухоль поджелудочной железы, передозировка инсулина). Гипогликемия очень опасна, так как приводит к гипогликемической коме.
5.3. Самостоятельная работа по теме:
5.3.1. Вопросы для самостоятельной подготовки к занятию:
- определение и классификация углеводов;
- строение моносахаридов, дисахаридов, полисахаридов;
- переваривание углеводов пищи;
- всасывание продуктов переваривания углеводов;
- роль печени в обмене углеводов;
- синтез гликогена, ход реакций, регуляция, значение;
- понятие о гликолизе и гликогенолизе. Ход реакций в гликолизе;
- регуляция гликолиза;
- биологическая роль гликолиза;
- определение глюконеогенеза. Ход реакций в глюконеогенезе;
- регуляция глюконеогенеза;
- значение глюконеогенеза;
- глюкозо-лактатный цикл;
- пентозофосфатный путь: ход реакций окислительной части,
представление о неокислительной части; значение и регуляция;
- пути образования и использования глюкозо-6-фосфата;
- источники глюкозы крови;
- регуляция глюкозы крови гормонами;
- причины гипогликемии;
- причины гипергликемии;
- неферментативное гликозилирование белков;
- Гетерополисахариды: гликозаминогликаны (гепарин, гиалуроновая кислота, хондроитинсульфаты) и гликопротеины. Строение, функции.
5.3.2. Лабораторная работа
Определение концентрации серогликоидов в сыворотке крови
Оборудование: | 1. | Штатив с пробирками. |
2. | Пипетки на 1 мл, 2 мл и 5 мл. | |
3. | Мерная пробирка на 10 мл. | |
4. | Центрифуга. | |
5. | КФК. | |
6. | Кюветы толщиной 1 см. |
Реактивы: | 1. | 0,9% NaCl (физ. раствор). |
2. | 1,8 н хлорная кислота. | |
3. | 5% фосфорновольфрамовая кислота. | |
4. | Сыворотка крови. |
Принцип метода. Под названием серогликоиды (или серомукоиды) объединяется группа гликопротеидов, которые не осаждаются серной кислотой, трихлоруксусной и сульфосалициловой кислотами. Метод основан на осаждении всех белков, кроме серогликоидов, хлорной кислотой. Серогликоиды выделяют осаждением фосфорновольфрамовой кислотой и по степени помутнения раствора судят о содержании серогликоидов.
Ход работы. К 0,5 мл сыворотки приливают 4,5 мл 0,85% раствора хлористого натрия и добавляют по каплям 2,5 мл 1,8 H раствора хлорной кислоты. Хорошо перемешивают и оставляют на 10 мин при комнатной температуре. Затем центрифугируют 15 мин при 3000 об/мин. 5 мл центрифугата смешивают с 1 мл 5% раствора фосфорновольфрамовой кислоты и через 15 мин измеряют мутность на ФЭКе в кювете толщиной 1 см при красном светофильтре против контроля. Контроль готовят, смешивая 3,3 мл физиологического раствора с 1,7 мл хлорной кислоты и 1 мл фосфорновольфрамовой кислоты.
Результат выражают в условных единицах – значении оптической плотности.
Норма содержания серогликоидов в крови – 0,13-0,2 условных единиц.
Диагностическое значение определения серогликоидов в крови
Увеличение серогликоидов наблюдается при всех воспалительных и некробиотических процессах: у больных с инфарктом миокарда, желтушным синдромом (особенно на почве новообразования), злокачественной опухолью, обострением хронического холецистита, с деструктивной формой туберкулеза легких, ревматизмом, мозговым инсультом и другими патологическими состояниями.
Снижение серогликоидов наблюдается при инфекционном гепатите, гематоцеллюлярной дистрофии, рассеянном склерозе.
5.4. Итоговый контроль знаний:
5.4.1. Вопросы для защиты лабораторной работы
1. Что такое серогликоиды?
2. Принцип метода определения концентрации серогликоидов в крови.
3. Зачем к сыворотке крови приливают раствор хлорной кислоты?
4. Каким образом рассчитывается концентрация серогликоидов?
5. Для чего проводится центрифугирование?
6. Какая существует связь между концентрацией серогликоидов и состоянием больного?
7. В каких случаях содержание серогликоидов в крови может быть высоким?
8. Можно ли на основании повышения концентрации серогликоидов диагностировать определенное заболевание?
5.4.2. Ситуационные задачи
1. Глюкозу, меченную 14С при С-6, добавляли в раствор, содержащий ферменты и кофакторы окислительной части пентозофосфатного пути. Какова судьба радиоактивной метки?
2. На экзамене у студента содержание глюкозы в крови оказалось равным 7,2 ммоль/л. Имеются ли отклонения от нормы?
3. Будет ли содержать радиоактивную метку рибозо-5-фосфат, полученный в пентозофосфатном пути из глюкозы, меченой С14 по 1-му атому?
4. Выберите пути использования метаболитов пентозофосфатного пути:
1) НАДФ нуклеотидов.
2) Рибозо-5-фосфат. В. Восстановительные реакции
в процессе синтеза жирных кислот.
3) 3-фосфоглицериновый
альдегид. С. Реакции гидроксилирования.
4) Фруктозо-6-фосфат. Д. Гликолиз.
5. Выберите определения, характеризующие свойства НАДН и НАДФН.
1) Является коферментом дегидрогеназ. А. Характерно для НАД+.
2) Служит донором водорода для дыха - В. Характерно для НАДФН
тельной цепи.
3) Используется в реакции рибозо-фос - С. Характерно для обоих.
фат → рибулозо-5-фосфат. Д. Не характерно для этих
4) Образуется в окислительной части ПФП. коферментов.
5) Образуется в гликолизе. Е. Характерно для НАДН
6) Образуется при синтезе липидов.
5.4.3. Тесты
1. В РОТОВОЙ ПОЛОСТИ КРАХМАЛ ПЕРЕВАРИВАЕТСЯ ПОД ДЕЙСТВИЕМ:
1) фосфорилазы;
2) a-амилазы слюны;
3) лактазы;
4) сахаразы.
2. ДАННУЮ ПОСЛЕДОВАТЕЛЬНОСТЬ РЕАКЦИЙ СИНТЕЗА ГЛИКОГЕНА КАТАЛИЗИРУЮТ ФЕРМЕНТЫ В СЛЕДУЮЩЕМ ПОРЯДКЕ:
Глюкоза ® глюкозо-6-фосфат ® глюкозо-1-фосфат + УТФ ®
® УДФ – глюкоза ® гликоген
1) гексокиназа, фосфоглюкомутаза, трансфераза, гликогенсинтетаза;
2) фосфоглюкомутаза, трансфераза, гликогенсинтетаза, гексокиназа;
3) гексокиназа, фосфоглюкомутаза, гликогенсинтетаза, трансфераза;
4) трансфераза, фосфоглюкомутаза, гексокиназа, гликогенсинтетаза.
3. ФОСФОРОЛИЗ ГЛИКОГЕНА – ЭТО ПРОЦЕСС РАСЩЕПЛЕНИЯ ГЛИКОГЕНА С ИСПОЛЬЗОВАНИЕМ:
1) фосфорной кислоты;
2) АТФ;
3) воды;
4) ФАД.
4. СИНТЕЗ ГЛИКОГЕНА АКТИВИРУЕТ
1) инсулин;
2) глюкокортикостероиды;
3) катехоламины;
4) глюкагон.
5. ГЛИКОЛИЗ – ЭТО
1) расщепление глюкозы до лактата в анаэробных условиях;
2) расщепление глюкозы до ацетата в анаэробных условиях ;
3) расщепление глюкозы до СО2 и Н2О;
4) расщепление глюкозы до пирувата в анаэробных условиях
6. СУБСТРАТНОЕ ФОСФОРИЛИРОВАНИЕ В ГЛИКОЛИЗЕ ПРОИСХОДИТ В РЕАКЦИИ, КАТАЛИЗИРУЕМОЙ
1) гексокиназой;
2) фосфофруктокиназой;
3) пируваткиназой;
4) енолазой.
7. ГЛЮКОНЕОГЕНЕЗ (ГНГ) – ЭТО
а) синтез глюкозы из неуглеводных предшественников;
б) синтез глюкозы из жирных кислот;
в) синтез гликогена;
г) синтез глицерина.
8. ПЕНТОЗОФОСФАТНЫЙ ПУТЬ НАИБОЛЕЕ АКТИВЕН
1) в костной ткани;
2) в жировой;
3) в коре почек ;
4) в хрящевой ткани;
9. СЕРОГЛИКОИДЫ – ЭТО:
а) белки, содержащие серу;
б) гликопротеины крови, не осаждающиеся хлорной кислотой;
в) протеогликаны, входящие в состав межклеточного матрикса;
г) липопротеины.
10. ИНСУЛИН БЫСТРО НОРМАЛИЗУЕТ ПОВЫШЕННЫЙ УРОВЕНЬ ГЛЮКОЗЫ В КРОВИ:
1) увеличивая ее поступление в клетки;
2) путем ингибирования ферментов ПФП;
3) путем активации синтеза белка;
4) путем индукции синтеза ферментов ГНГ.
6. Домашнее задание для уяснения темы занятия
(смотрите методические указания к занятию № 3)
7. Рекомендации по выполнению НИРС, в том числе список тем, предлагаемых кафедрой.
Подготовить рефераты:
- Патобиохимия гипергликемии.
- Патобиохимия гипогликемии.
- Гликозилирование белков, биологическое значение.
Занятие №3
1. Тема: «Липидный обмен. Биохимическая диагностика атеросклероза: определение общего холестерина, холестерина липопротеинов высокой плотности. Расчет коэффициента атерогенности. Контроль по теме «Липидный обмен»»
2. Форма организации занятия: лабораторное занятие. Разновидность занятия: опыт.
Метод обучения: репродуктивный.
3. Значение темы: Липиды – это вещества, которые объединены в один класс одним их свойством. Они не растворяются в воде и в основном имеют биологическое происхождение. Разнообразие веществ этого класса определяет разнообразие их функций. Нарушение этих процессов может привести к гипоэнергетическому состоянию, в одних случаях, или к ожирению, в других. Атеросклероз – заболевание, осложнения которого являются причиной инвалидности или смерти большого количества людей в развитых странах. Поэтому будущему специалисту необходимо знать биохимические причины возникновения атеросклероза, факторы риска для его развития, биохимическую диагностику и лечения этого заболевания.

4. Цели обучения:
- общая: обучающийся должен обладать общекультурными компетенциями ОК-1, ОК-5 и профессиональными компетенциями ПК-1.
- учебная:
знать: строение липидов, первый этап катаболизма пищевых и эндогенных жиров, обмен глицерина, жирных кислот, кетоновых тел и холестерина. Липиды крови. Патология липидного обмена.
уметь: определять содержание общего холестерина и холестерина ЛПВП в сыворотке крови; анализировать полученные лабораторные данные; решать ситуационные задачи;
владеть: приемами работы на фотоэлектроколориметре (КФК).
5. План изучения темы:
5.1. Контроль исходного уровня знаний.
5.1.1. Тесты:
1. ЛИПИДЫ - ЭТО
а) вещества, не растворимые в воде, но растворимые в неполярных органических растворителях;
б) вещества, состоящие из аминокислот;
в) продукты, образующиеся при анаэробном окислении глюкозы;
г) альдегидоспирты.
2. ТРИАЦИЛГЛИЦЕРИНЫ - ЭТО
а) эфиры глицерина и фосфорной кислоты;
б) эфиры глицерина и высших жирных кислот;
в) эфиры сфингозина и высших жирных кислот;
г) эфиры глицерина и аминокислот.
3. ЖИРЫ ВЫПОЛНЯЮТ СЛЕДУЮЩИЕ ФУНКЦИИ
а) энергетическую;
б) являются резервом эндогенной воды;
в) входят в состав клеточных мембран;
г) необходимы для растворения и всасывания жирорастворимых витаминов;
д) защищают от механических и термических воздействий.
4. ГЛАВНЫМ ФЕРМЕНТОМ, ПЕРЕВАРИВАЮЩИМ ЖИРЫ У ВЗРОСЛЫХ, ЯВЛЯЕТСЯ
а) амилаза;
б) липаза желудка;
в) пепсин;
г) липаза поджелудочной железы;
д) трипсин.
5. В СОСТАВ ГЛИЦЕРОФОСФОЛИПИДОВ ВХОДЯТ
а) глицерин;
б) жирные кислоты;
в) фосфорная кислота;
г) азотистые основания (холин, этаноламин);
д) азотистые основания (тимин, аденин).
7. ГЛАВНОЙ ФУНКЦИЕЙ ЛИПОИДОВ ЯВЛЯЕТСЯ
а) энергетическая;
б) регуляторная;
в) мембранная;
г) механическая.
8. ЛИПИДЫ НЕ МОГУТ НАХОДИТЬСЯ В КРОВИ В СВОБОДНОМ СОСТОЯНИИ, ТАК КАК
а) не растворимы в воде;
б) токсичны;
в) связывают биологически активные вещества крови;
г) препятствуют свертыванию крови.
9. ГИДРОЛИЗ - ЭТО
а) превращение одних изомеров в другие;
б) расщепление связей с помощью воды, когда она присоединяется по месту разрыва этой связи;
в) расщепление связей с помощью фосфорной кислоты;
г) перенос электронов от одного вещества к другому.
10. ГИДРОЛАЗЫ - ЭТО ФЕРМЕНТЫ, КАТАЛИЗИРУЮЩИЕ
а) перенос химических групп;
б) синтез сложных веществ из простых с затратой АТФ;
в) расщепление связей с помощью воды;
г) расщепление связей без помощи воды.
5.2. Основные понятия и положения темы
Липиды – это органические вещества, нерастворимые в воде, но растворимые в неполярных органических растворителях.
Функции жира
1. Энергетическая: при окислении 1 г жира выделяется около 9,3 ккал энергии.
В сутки человек в среднем потребляет 60-80 г жира, что составляет 35-40% суточного калоригенеза.
2. Резерв эндогенной воды (1 г жира при окислении дает 1,07 г воды).
3. Жир необходим для растворения и всасывания жирорастворимых витаминов.
4. Защитный барьер, предохраняющий от термических и механических воздействий.
Функции липоидов
1. Мембранная:
- обеспечивают избирательную проницаемость;
- участвуют в активном транспорте;
- необходимы для упорядочения ферментативных цепей;
- необходимы для создания биопотенциалов не только на нейронах, но и мембранах митохондрий;
- входят в состав рецепторов для гормонов и обеспечивают механизм усиления эффектов.
2. Специфические функции:
- обеспечивают устойчивость эритроцитов;
- ганглиозиды связывают токсины и яды.
3. Энергетическая (не имеет большого значения).
Функции биологически активных липидов
1. Регуляторная
- стероидные гормоны (половые и гормоны коры надпочечников);
- гормоны, производные полиненасыщенных жирных кислот.
2. Витаминная
- витамины А, Е, К, Q (производные изопрена);
- витамин Д (производное холестерина).
Переваривание жира (триацилглицеринов - ТГ)
Переваривание жира происходит под действием ферментов липаз (класс гидролаз), которые расщепляют сложноэфирные связи.
Переваривание жира в ротовой полости не происходит. Установлено, что в слизистой корня языка синтезируется так называемая лингвальная липаза, активность которой не может проявиться в полости рта, и основным местом ее действия является желудок. Оптимум рН для этой липазы находится в области рН 4 – 4,5. Она действует на ТГ, содержащие жирные кислоты (ЖК) с короткой и средней длиной цепи, что характерно для ТГ молока. Таким образом, лингвальная липаза имеет большое значение у грудных детей. Активность этого фермента у взрослых крайне низкая.
В желудке синтезируется собственная липаза, значение которой у взро-слых незначительно, так как содержание этой липазы в желудочном соке невелико. Кроме того, рН желудочного сока далек от оптимума (рН 5,5-7,5); в желудке нет условий для эмульгирования жира, а липаза может активно действовать только на эмульгированные ТГ. В отличие от взрослых у грудных детей в желудке умеренная кислотность (рН 5,0), жир молока эмульгирован, липаза синтезируется в достаточном количестве и активна. Таким образом, переваривание жира в желудке в основном происходит у детей.
Главным местом переваривания ТГ у взрослых является тонкий кишечник.
На ТГ действует липаза поджелудочного сока. Панкреатическая липаза является гликопротеидом с оптимумом рН 8-9, поступает в верхний отдел тонкой кишки в неактивном состоянии в виде пролипазы. Превращение пролипазы в активный фермент происходит при участии желчных кислот и колипазы (пептид с М. м. 10 кДА). Колипаза присоединяется к пролипазе, что активирует ее и делает устойчивой к действию трипсина. Липаза расщепляет ТГ, находящиеся в эмульгированном состоянии. Панкреатическая липаза отщепляет жирные кислоты, находящиеся в a-положении. Продуктами переваривания жира в кишечнике являются: глицерин, жирные кислоты, а также моноглицерины.
Роль желчных кислот в переваривании жира
1. Активируют панкреатическую липазу.
2. Эмульгируют жир.
3. Необходимы для всасывания продуктов переваривания жира.
Всасывание продуктов переваривания жира
Глицерин и жирные кислоты с короткой цепью хорошо растворимы в воде, поэтому легко всасываются стенкой кишечника. Жирные кислоты с длинной цепью сначала нужно перевести в растворимую форму. Для этого жирные кислоты связываются с желчными кислотами (1:3), образуя холеиновые комплексы, которые легко всасываются. В виде холеиновых комплексов всасываются моно-, ди - и триацилглицерины (последние в небольших количествах). Внутри эпителиальных клеток кишечника происходит ресинтез жира в основном из моноацилглицеринов и жирных кислот.
Ресинтез жира – это синтез жира, свойственного данному организму. Не все жирные кислоты могут этерифицироваться. В неизменном виде они поступают в кровь, где связываются с альбуминами и в таком виде разносятся кровью органам и тканям. Свободные жирные кислоты называются неэстерифицированными или НЭЖК.
Хиломикроны и пути их использования
Образованные в эпителиальных клетках ТГ покрываются оболочкой из белка и фосфолипида. В результате образуются хиломикроны (ХМ). ХМ – это микроскопические липопротеидные частицы диаметром около 500 нм.
В составе ХМ 1-2% белка и 98-99% липидов, из которых 88% ТГ, 8% - ФЛ (фосфолипидов) и 4% ХС (холестерина). 90% ТГ пищевого происхождения транспортируется в виде ХМ, оставшиеся 10% поглощаются в виде жирных кислот. НЭЖК переносятся в печень, там они либо окисляются, либо идут на синтез липидов. Печень характеризуется ограниченной способностью к запасанию ТГ и даже небольшой их избыток секретируется в виде ЛПОНП (липопротеидов очень низкой плотности). В отличие от ХМ ЛПОНП содержат 10% белка и 90% липидов.
Таким образом, ХМ и ЛПОНП являются транспортными формами. ХМ транспортируют экзогенные липиды, а ЛПОНП – липиды, синтезированные в печени. 70% ХМ поступает в лимфу, а 30% - прямо в кровеносные капилляры. Появление "молочного" вида у плазмы крови после приема жирной пищи обязано наличию в ней ХМ (т. н. хилезная кровь).
Пути использования хиломикронов
ХМ расщепляются липопротеинлипазой (ЛПЛ-аза), которая действует на триглицеридную часть. Этот фермент располагается в поверхностном слое эндотелиальных клеток капилляров, особенно жировой ткани, лактирующей молочной железы, скелетной и сердечной мышц. ТГ хиломикронов расщепляются на глицерин и жирные кислоты. В ХМ липида становится меньше, плотность такой частицы повышается, она превращается в, так называемый, остаточный ХМ. Липопротеидлипаза активируется гепарином. Остаточный ХМ переносится в печень, где метаболизируется. Выделяющиеся из ХМ НЭЖК поступают в клетки сердца и мышц, где окисляются.
Содержание липидов в кровотоке может понижаться вследствие откладывания их в различных тканях. Способность откладывать жир характерна для всех тканей, кроме мозга. Главную роль в обмене липидов играют жировая ткань и печень. Примерно 65% веса жировой ткани приходится на ТГ. Количество жировой ткани нарастает с возрастом. Различают белую жировую ткань (подкожная жировая ткань и сальник) и бурую жировую ткань (находится в межлопаточной области). Белый жир является источником глицерина и жирных кислот. Бурый жир выполняет термогенную функцию, так как в нем жир сгорает с образованием воды, углекислого газа и тепла. Много бурого жира у новорожденных и у зимоспящих животных.
Липолиз
Липолиз – это расщепление жира до глицерина и жирных кислот. Катализируется триглицеридлипазой, диглицеридлипазой и моноглицеридлипазой, которые действуют соответственно на ТГ, ДГ и МГ. Триглицеридлипаза является лимитирующим ферментом липолиза. Она имеет две формы: фосфорилированную (активную) и нефосфорилированную (неактивную).
Превращение неактивной формы в активную происходит под влиянием протеинкиназы. Протеинкиназа, в свою очередь, активируется в результате присоединения к ее аллостерическим центрам цАМФ.
Регуляция липолиза происходит под действием гормонов.
Активируют липолиз: катехоламины, глюкагон, СТГ, АКТГ, тироксин, липотропин гипофиза, цАМФ. Ингибирует липолиз инсулин.
Липогенез
Липогенез – это синтез жира. Для синтеза жира необходимы глицерин и жирные кислоты в активных формах. Активной формой глицерина является
3-фосфоглицерол (α-глицерофосфат). Активной формой жирной кислоты является ацил-КоА.
В жировой ткани 3-фосфоглицерол образуется из ДОАФ (метаболит гликолиза) путем гидрирования под действием глицерофосфатдегидрогеназы с затратой НАДН. Таким образом, синтез жира в жировой ткани происходит из углеводов. В печени и почках 3-фосфоглицерол образуется путем фосфорилирования глицерина под действием глицеролкиназы с затратой АТФ.
Ацил-КоА образуется при взаимодействии жирной кислоты с НSКоА с затратой АТФ под влиянием ацил-КоА-синтетазы.
Сборка триглицерида происходит из 3-фосфоглицерола и ацилов-КоА под действием ацилтрансферазы.
Ингибируют липогенез КА, СТГ, ЙТ, АКТГ, АДФ. Активируют – инсулин, эстрогены и АДФ.
Обмен глицерина
В зависимости от типа ткани, в которую он поступает, глицерин может:
- окисляться до СО2 и Н2О с образованием 21 АТФ (см лекцию);
- использоваться в синтезе липидов (ТГ и ФЛ);
- использоваться на синтез глюкозы в глюконеогенезе.
Окисление жирных кислот. Регуляция
Происходит в митохондриях. Активная форма жирных кислот ацил-КоА образуется в цитоплазме под действием ацил-КоА-синтетазы.
![]() Жирная кислота + НSКоА + АТФ Ацил-КоА + АМФ + РР
Жирная кислота + НSКоА + АТФ Ацил-КоА + АМФ + РР
Мембрана митохондрий не пропускает жирные кислоты. Для переноса жирных кислот в митохондрии существует специальный переносчик – карнитин. С помощью фермента карнитинацилтрансферазы-1 остаток жирной кислоты (ацил) переносится на карнитин, в результате образуется ацилкарнитин, способный проникать в митохондрии. В митохондриях комплекс ацилкарнитин распадается, освободившийся ацил присоединяется к НSКоА с образованием ацил-КоА с помощью карнитинацилтрансферазы-2.
Карнитин возвращается в цитоплазму за новой молекулой жирной кислоты. Легче всего окисляют жирные кислоты те ткани, где много карнитина, например, в таких органах, как сердце, скелетные мышцы, почки.
Окисление жирных кислот является циклическим процессом. В результате одного цикла (витка) жирная кислота укорачивается на два углеродных атома, при этом в ходе окислительно-восстановительных реакций образуются НАДН и ФАДН2. Количество витков рассчитывается по формуле: количество атомов углерода в кислоте делят на 2 и отнимают 1
Энергетическая роль жирных кислот в разных тканях различна. Так, для миокарда окисление жирных кислот дает 70% энергии, для мышечной ткани – 50%, в головном мозге они не окисляются.
Регуляция β-окисления жирных кислот
Ключевым процессом является поступление жирных кислот в митохондрии. Карнитинцилтрансфераза-1 является аллостерическим ферментом, аллостерическим ингибитором которого является малонил-КоА. КА, СТГ – активируют, инсулин – тормозит окисление жирных кислот.
Синтез жирных кислот. Регуляция
Происходит главным образом в жировой ткани, молочной железе и печени. Местом синтеза жирных кислот является цитоплазма. Для синтеза жирных кислот необходимы СО2, ацетил-КоА, АТФ и НАДФН. Синтез жирных кислот происходит циклически. В начале каждого цикла из ацетил-КоА и углекислого газа с затратой АТФ образуется малонил-КоА.
Итак, для синтеза одной молекулы С16 потребуется 8 молекул ацетил-КоА, (из которых 7 проходят стадию образования малонил-КоА), 7 АТФ и 14 НАДФН.
Регуляция синтеза жирных кислот
Лимитирующим ферментом является ацетил-КоАкарбоксилаза. Аллостерические активаторы – АТФ и цитрат, ингибиторы – жирные кислоты с длинной цепью. Инсулин, эстрогены активируют, катехоламины и стресс ингибируют синтез жирных кислот.
Обмен ацетил-КоА
Пути образования ацетил-КоА
1. Из пирувата в ходе пируватдегидрогеназной реакции. Этот путь преобладает при кратковременной и напряженной мышечной работе.
2. β-окисление жирных кислот. Преобладает в следующих ситуациях: длительная мышечная работа, холод, голод, беременность, сахарный диабет.
Пути использования ацетил-КоА
Ацетил-КоА окисляется в цикле Кребса, используется в синтезе жирных кислот и идет на синтез холестерина и кетоновых тел. Путь использования ацетил-КоА зависит от энергообеспеченности и потребности организма в этих веществах.
Кетоновые тела и их функции
Под кетоновыми телами понимают три вещества: ацетоацетат, β- гидроксибутират и ацетон.
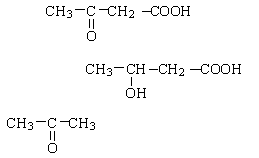 Ацетоацетат
Ацетоацетат
3-гидроксибутират
Ацетон
Кетоновые тела образуются в печени и выполняют следующие функции:
1. Энергетическая. Скелетная и сердечная мышцы, мозг и другие внепеченочные ткани обеспечивают значительную долю своих энергетических потребностей за счет катаболизма кетоновых тел. Печень не может окислять кетоновые тела.
2. Кетоновые тела необходимы для образования миелиновых оболочек нервов и белого вещества головного мозга.
Накопление кетоновых тел в организме называется кетозом. Кетоз сопровождается кетонемией и кетонурией. Кетоз бывает физиологическим и патологическим. Физиологический кетоз возникает при голодании, длительной мышечной работе и у новорожденных, патологический – при сахарном диабете.
Накоплению кетоновых тел способствуют катехоламины и СТГ. Инсулин снижает синтез кетоновых тел.
Обмен холестерина
Источники холестерина:
- пищевые продукты (желток куриного яйца, головной мозг, печень, сливочное масло и др.);
- синтез из ацетил-КоА.
Всасывание холестерина из кишечника происходит с участием желчных кислот. После всасывания большая часть холестерина этерифицируется жирными кислотами с образованием стеридов, которые входят в состав липопротеинов.
Синтез холестерина происходит из ацетил-КоА с затратой НАДФН и АТФ. 80% холестерина синтезируются в печени, 10% - в тонком кишечнике, 5% - в коже. Лимитирующим ферментом синтеза холестерина является ГМГКоА-редуктаза. Активируют синтез: КА, СТГ, ГКС, андрогены, насыщенные жирные кислоты, любые виды стресса, пища, богатая углеводами. Снижают синтез холестерина: инсулин, тироксин, эстрогены, холестерин, полиненасыщенные жирные кислоты, мышечная работа.
Роль холестерина в организме
1. Входит в состав всех клеточных мембран и обеспечивает их теку-честь.
2. В печени используется для синтеза желчных кислот.
3. В коже под действием ультрафиолета из него образуется витамин D.
4. В эндокринных железах используется на синтез стероидных гормонов (половые, минералокортикостероиды, глюкокортикостероиды).
Липопротеины
Содержат гидрофобное ядро (ТГ и холестериды) и гидрофильную оболочку (холестерин, фосфолипиды, белки).
Классификация липопротеинов основана на различной их плотности (чем больше липидов, тем меньше плотность).
Классы липопротеинов:
- хиломикроны (ХМ) содержат 1% белка и 99% липидов. Это самые гидрофобные липопротеины, имеют наименьшую плотность, не обладают электрофоретической подвижностью. Образуются в стенке кишечника. Являются главной формой транспорта пищевых липидов. Это самые крупные частицы. Исчезают из кровяного русла через 5 часов после еды. Метаболизируются липопротеинлипазой.
- пре β-липопротеины (или ЛПОНП). Содержат 10% белка, 90% липидов. Образуются в печени и очень мало – в тощем кишечнике, являются транспортной формой эндогенных липидов в жировую ткань. Те из них, которые не попадают в жировую ткань, превращаются в липопротеины низкой плотности (ЛПНП), богатые эфирами холестерина. Это превращение катализируется липопротеинлипазой.
- β-липопротеины (ЛПНП). Содержат около 25% белка и 75% липидов. Главным компонентом является холестерин (примерно 50%) в виде эфиров с линолевой кислотой и фосфолипиды. У здоровых людей до 2/3 всего холестерина плазмы находится в составе ЛПНП. Они являются главным поставщиком холестерина в ткани. ЛПНП регулируют синтез холестерина de novo. Большинство ЛПНП являются продуктами расщепления ЛПОНП липопротеинлипазой. На клеточных мембранах имеются рецепторы для ЛПНП. В клетки ЛПНП проникают путем эндоцитоза.
- α-липопротеины (ЛПВП) содержат 50% белков, 25% фосфолипидов, 20% эфиров холестерина и очень мало триацилглицеринов. Образуются главным образом в печени. ЛПВП образуют комплексы с ферментом лецитинхолестеролацилтрансферазой (ЛХАТ). С помощью этого фермента свободный холестерин ЛПВП превращается в эфир (холестерид). Холестерид является гидрофобным соединением, поэтому перемещается в ядро ЛПВП. Источником жирной кислоты для этерификации холестерина является лецитин (фосфатидилхолин). Таким образом, ЛПВП, благодаря ЛХАТ, забирают холестерин от других липопротеинов и транспортируют его в печень, предотвращая накопление его в клетках. ЛПОНП и ЛПНП считают атерогенными, то есть вызывающими атеросклероз. ЛПВП - антитиатерогенными.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 |





