Зная удельную скорость роста m1, можно вычислить продолжительность генерации g, т. е. период удвоения количества биомассы.
Эта величина обратно пропорциональна удельной скорости роста:
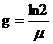
Иногда для исследователей важна величина прироста числа клеток. В этом случае определяют скорость их размножения.
Если вначале число клеток равно N0 и после определенного времени – длительности генерации – оно удваивается, тогда через n–генераций число клеток N1 равно:
N1 = N0 * 2n = 2n N0
Число генераций n; скорость размножения n и длительность генерации g можно определить по уравнениям:
n = 3,32 (lg N1 – lg N0)
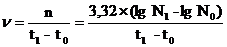
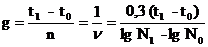
Увеличение биомассы микроорганизмов важно и при получении биомассы, и при накоплении в культурной жидкости какого-либо вещества.
В первом случае процесс прекращают, когда достигнуто максимальное количество биомассы, когда максимально использован углерод и азот среды. Если источник углерода для образования биомассы и какого-либо продукта общий, например, спиртовое брожение на сахарозе или мальтозе, тогда на определенном этапе увеличение биомассы ограничивают (при спиртовом брожении – путем образования факультативно анаэробных условий).
Методы определения роста и размножения культуры.
1. Центрифугируя или фильтруя культуральную жидкость через мембранный фильтр, и высушивая полученную пасту до постоянной массы.
2. Нефелометрически, измеряя поглощение света клеточной суспензией, что пропорционально числу и размерам клеток.
3. Определяя содержание азота в биомассе, полученной из определенного объема питательной среды.
4. По интенсивности выделения какого-либо вещества (газа, кислоты и др.).
Число клеток в питательно среде или культурной жидкости определяют:
1. микроскопически, прямым подсчетом клеток, используя специальные камеры (камера Тома, Горячева и др.).
2. по подсчету высохших колоний в чашках Петри.
3. по методу постепенного разбавления. При этом методе культуру постепенно разбавляют и определяют, при каком разбавлении не наблюдается ее роста.
Лекция №10
Основы микробиологического производства
Для приготовления питательных сред в микробиологической промышленности используют сырье минеральное, животного и растительного происхождения, а также синтезированное химическим путем. Эти вещества, входя в состав питательной среды, обеспечивают развитие культуры и биосинтез определенных.
Сырье. Характеристика основных видов сырья для микробиологического производства.
Для приготовления питательных сред в микробиологической промышленности используют сырье минеральное, животного и растительного происхождения, а также синтезированное химическим путем. Эти вещества, входя в состав питательной среды, обеспечивают развитие культуры и биосинтез определенных продуктов. Они не должны содержать вредных примесей. При выборе сырья необходимо учитывать его влияние на себестоимость, так как в микробиологическом синтезе важное значение имеет стоимость исходных веществ и материалов.
В микробиологическом производстве большое значение имеет наличие чистой воды в большом количестве.
Кристаллическая глюкоза (ГОСТ 975—63). Этот продукт не должен содержать более 9% воды и свыше 0,07% зольных веществ, в том числе не более 0,004% железа. В сухом веществе должно быть не менее 99,5% редуцирующих веществ.
Техническая сахароза (ГОСТ 5833—54). Этот продукт содержит не менее 99,75% сахарозы, не более 0,03% зольных веществ, влажность до 0,15 %.
Техническая лактоза (РТУ РСФСР 761—64). Получают лактозу из молочной сыворотки после выделения белков, сгущения до концентрации Сахаров 50% и кристаллизации. Лактозный сахар-сырец содержит не менее 92% сахара, не более 3% воды, 2% зольных веществ и 1 % молочной кислоты. Количество белка не регламентировано, но обычно оно не превышает 3%. Для нужд микробиологического синтеза иногда готовят сгущенный концентрат лактозы.
Гидроль (МРТУ 18-193—67). Представляет собой темный густой сироп с 50% сахара, главным образом в виде глюкозы. Содержит примерно 70% редуцирующих веществ по сухой массе. Примерно 18% сухого вещества гидроля составляют несбраживаемые сахара, а также органические кислоты. Количество зольных веществ не превышает 7%. Активная кислотность среды составляет примерно 4,0.
Крахмал (ГОСТ 10163—62). Влажность крахмала 20%. В зависимости от сорта (высший, I, II, III) содержание золы достигает 0,35—1,2% по сухой массе, а органических кислот 18—30 мл (по 0,1 н. NaOH). Крахмал не должен содержать хлора и свободных неорганических кислот, исключая сернистую кислоту, количество которой не должно превышать 5 мг/100 г продукта.
Узкая фракция жидкого парафина для синтеза (ТУ—75). Содержание нормальных алканов колеблется от 87 до 93%, плотность при 20°С не более 0,8 г/м3. Количество ароматических углеводородов допускается не более 0,5 /о, серы — не более 0,05%.
Уксусная кислота (ТУ 84-97—70). Является продуктом химического синтеза. В микробиологической промышленности может быть использована в качестве источника углерода. Содержание уксусной кислоты в продукте должно быть не ниже 60%, а формальдегида и муравьиной кислоты — не более 1 %. Нелетучий остаток не должен превышать 0, 1 %•
Спирт этиловый синтетический (ГОСТ 11547—65). Получают гидратацией этилена. Технический спирт содержит не менее 92° об. этанола. Допускается присутствие изопропилового спирта до 0, 21% об., сернистых соединений — до 2 мг/л, органических кислот (в пересчете на уксусную) — до 15 мг/л, сложных эфиров (в пересчете на уксусноэтиловый) — до 1% об., сухого остатка — до 10 мг/л, диэтилового эфира — до 1% об., нерастворимых в воде веществ — до 0, 15%. В качестве источника углерода в микробиологической промышленности используют также гидролизный и пищевой этиловые спирты, в том числе этиловый спирт-сырец. (ГОСТ 131—67), спирт-ректификат (ГОСТ 5962—67) и спирт этиловый ректификованный технический (ГОСТ 18300—72).
Меласса. Представляет собой нестандартный побочный продукт сахарной промышленности. Остается после второго отделения кристаллов сахара. Цвет темно-коричневый, плотностью 1. 35—1, 40. Меласса содержит 61—86% сухих веществ, 40—55% сахарозы. Кроме того, в ней имеется от 0, 5 до 2% инвертного сахара и 0, 5—2, 5% раффинозы. 1, 1 —1, 5% мелассы составляет азот, причем третья часть его находится в форме бетаина, использовать который в качестве источника азота микроорганизмы, как правило, не могут. В состав мелассы входят многие аминокислоты, например аспарагиновая, глутаминовая, лейцин, изолейцин, тирозин, а также витамины группы В — биотин, тиамин, рибофлавин, инозит, никотиновая и пантотеновая кислоты, из которых особенно большое значение в микробиологическом синтезе имеет биотин.
Мелассная барда. Является отходом спиртового завода. Содержание сухих веществ в натуральной барде 6—10%. Средний химический состав мелассной барды представлен в табл. 9.
Ацетонобутиловая барда. Является отходом производства органических растворителей.
Кукурузный экстракт (МРТУ ). Представляет собой густую жидкость коричневого цвета. Химический состав экстракта зависит как от сорта кукурузы, так и от условий ее выращивания, а также от технологии получения и условий хранения экстракта.
Молочная сыворотка. Является побочным продуктом при производство сыра, казенна и творога.
Водная вытяжка солодовых ростков. Является богатым источником витаминов группы В (содержание биотина составляет 128 мг/т сухих ростков) и аминокислот.
Кукурузная мука (ГОСТ 14176—69). Содержит 67—70% крахмала и примерно 10% других углеводов, главным образом целлюлозу, пентозаны, декстрины и растворимые углеводы. Белки составляют примерно 12%, из которых 30% приходится на глютелин и 50% — на зеин. Кукурузная мука является самым дешевым продуктом из всех зерновых и ее цена зависит от степени измельчения (помола).
Соевая мука (ГОСТ 3898—56). Различают содержащую и не содержащую масло соевую муку. Соевая мука может быть пропаренная (дезодорированная) или непропаренная. Содержание влаги в муке 9—10%. Наиболее ценный компонент соевой муки — азотсодержащие вещества главным образом белки (глицинии). В белке 20% глутаминовой кислоты. Содержание углеводов в соевой муке не превышает 25% Количество зольных веществ 4, 5—6, 5%. В соевой муке содержится много лецитина, что определяет ее эмульгирующие свойства, много ферментов и витаминов группы В.
Сапропели и их гидролизаты. Являются источником ряда биологически активных веществ органической и минеральной природы. Сапропель, или озерный ил, образуется из остатков растительных и животных организмов, обитающих в пресных озерах. После их оседания в результате микробиологических процессов органическое вещество сапропелевых отложений постепенно разлагается—минерализуется.
Серная кислота (ГОСТ 2184—67 и ГОСТ 667—53). Широко применяется для подкисления среды. Чаще всего используют техническую серную кислоту, содержащую 92, 5—94% моногидрата. Количество мышьяка не должно превышать 0, 0001 %.
Ортофосфорная кислота (ГОСТ ). Используется как источник фосфора и как средство подкисления среды. Содержит 50, 7% Р2О5. Мышьяка не должно быть более 0, 0003%.
Соляная кислота (ГОСТ 857—69). В дрожжевом производстве применяется соляная кислота, исходная концентрация которой не менее 31 %.
Карбамид или мочевина (ГОСТ 2081—69). Содержит 46, 3% азота. Необходимо учитывать, что при термической стерилизации карбамид разрушается. Иногда используют стерильные спиртовые растворы карбамида.
Сульфат аммония (ГОСТ 9097—65). Эта соль хорошо растворяется в воде. Применяется как источник азота для культивирования многих микроорганизмов, так как содержит 20% азота. Количество свободной серной кислоты 0, 05—0, 2%. В сульфате аммония не должны присутствовать завышенные количества фенола и пирокатехина.
Диаммонийфосфат (ГОСТ 8515—57). Хорошо растворяется в воде. Используется как источник азота и фосфора. Содержит 48— 50% фосфорнокислого ангидрида и 21—22% аммиака. Количество мышьяка не должно превышать 0, 005%, фтора — 0, 3%.
Хлористый калий (ГОСТ 4568—65). Хорошо растворяется в воде. Является экономически выгодным источником калия (содержание КС1 92—99% в зависимости от сорта). Количество примесей не должно превышать 2%, в том числе хлорида натрия — не более 1, 4%.
Калий углекислый кальцинированный (ГОСТ 10690—63) содержит основного вещества 97, 5—98 % — I сорт и 92, 5—93% — II сорт. Соль очень гигроскопична.
Сульфат магния. Представляет собой бесцветные кристаллы. Насыщенный раствор кипит при 108°С и содержит 75 г вещества на 100 г воды. В природе соль встречается в виде минералов: кизерита и эспомита. Бесцветные кристаллы кизерита (MgSO4 •НгО) в воде даже при нагревании растворяются медленно. Прозрачные кристаллы эспомита (MgSO4-7H2O) хорошо растворяются в ней.
Сода каустическая (ГОСТ 2263—59). Применяется для мойки аппаратуры и подщелачивания среды. Твердая каустическая сода должна содержать не менее 92—96% едкого натра, жидкая — не менее 42—50%.
Сода кальцинированная (карбонат натрия, или углекислый натрий). Применяется для мойки аппаратуры и подщелачивания среды. В микробиологическом производстве используется синтетическая сода (ГОСТ 5100—64), содержащая 96, 8% химически чистого вещества.
Олеиновая кислота. Применяется в качестве пеногасителя. Получают олеиновую кислоту гидролизным расщеплением жиров и масел. Технический олеин (ГОСТ 7580—55) представляет собой смесь непредельных жирных кислот в количестве 95% для марок А и Б и 92% — для марки В. Температура кипения 360°С, плавления – не выше 10°С. В качестве пеногасителей используют также растительные масла, жиры и синтетические пеногасители.
Синтетические пеногасители. К ним относятся такие поверхностно активные вещества, как кремнийорганические полимеры (силоксаны). четырехзамещенные аммониевые основания, алкиламиносульфаты, сложные эфиры, спирты и др.
Жир кашалотовый (ГОСТ 1304—60). Используется в качестве пеногасителя в процессе ферментации. При комнатной температуре расслаивается на осадок и жидкую фазу. Плотность жира 0. 87—0, 90. число омыления 3—20 (в зависимости от сорта). Содержит примерно 12% насыщенных и 37% ненасыщенных жирных кислот.
Мел (ГОСТ 8253—56). Мел обычно используется для стабилизации рН среды в процессе ферментации, если образуются кислоты. Для этих целей пригоден как химически осажденный из известкового молока пропусканием углекислого газа, так и природный размельченный мел. Мел должен быть в виде белого, мелкого, сыпучего порошка с содержанием влаги 1—2%, карбонатов кальция и магния — 96—98%. Количество соляной кислоты в нерастворимой части не должно превышать 5%. На процесс биосинтеза могут влиять такие примеси в меле, как магний, алюминий, железо, марганец и др.
Аммиак или аммиачная вода. Используется как источник азота и регулятор рН среды. Аммиак I сорта содержит не менее 25%, а аммиак II сорта — не менее 20% азота.
Формалин. Применяется в виде 37—37,3%-ного раствора формальдегида. Содержит 6—6,5% метилового спирта и 0,02—0,04% муравьиной кислоты. Используется как дезинфицирующее вещество.
Антиформин. Представляет собой комбинированное дезинфицирующее средство, содержит в 1 м3 раствора 100 кг хлорной извести, 75 кг кальцинированной соды и 10 кг каустической соды. Раствор хлорной извести (100 кг на 400 л воды) при 60°С вливают в раствор кальцинированной соды (75 кг на 500 л воды) и к этой смеси добавляют раствор каустической соды (10 кг на 75 л воды). Смесь отстаивают 12—24 ч и перед употреблением разводят водой в соотношении 1 : 30.
Четвертичные аммонийные соединения. Применяются в небольших дозах (0,001—0,005%) для антисептирования сырья, например мелассы. Эти соединения не токсичны для человека, поэтому, например, катапин-П используют для дезинфекции пивоваренного и других видов пищевого оборудования.
Лекция №11
Этапы технологического процесса культивирования микроорганизмов.
Приготовление и стерилизация питательной среды
Хранение культуры и размножение посевного материала.
Не смотря на то, что для получения продуктов микробиологического синтеза применяются различные культуры микроорганизмов и используются разные питательные среды и режимы культивирования, процессы синтеза имеют общую структуру. О чем свидетельствует приведенная схема (рис. 12).

Приготовление и стерилизация питательной среды.
Для выращивания микроорганизмов необходима стерильная питательная среда.
Выращивание микроорганизмов производят в сырьевом или рецептурном цехе. Питательную среду готовят по периодическому или непрерывному методу. Иногда приготовление и стерилизация среды осуществляются прямо в ферментаторе.
На современных микробиологических предприятиях практически используется только непрерывный метод приготовления среды (рис. 13).
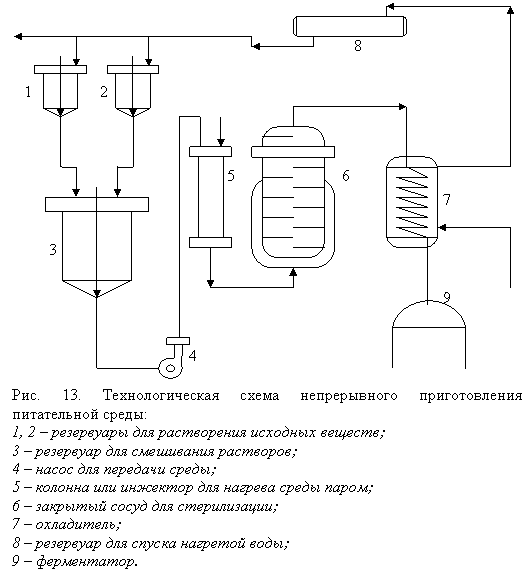
Выбор аппаратуры и технологии приготовления питательной среды зависит от количества и вида компонентов.
Если сточки зрения совместимости и стерилизации это возможно, то все они могут быть растворены в одном реакторе, если несовместимы, то в этом случае компоненты растворяют по группам и затем соединяют в смесителе. В этом случае, когда среду стерилизуют периодически паром или при помощи теплообменника, необходимо температуру во всем объеме питательной среды довести до 1200С и после того час выдерживают питательную среду при 120–1240С. Затем среду охлаждают до приблизительно 300С.
При непрерывной стерилизации нагревание среды до температуры стерилизации, выдерживание при этой температуре и охлаждение происходят в потоке. Необходимо помнить, что прямая подача пара в среду разбавляет ее на 10–20% – это необходимо учитывать при приготовлении среды. При работе с колонками используют пар давлением 0,5 МПа (5 кгс/см2). Скорость потока среды в колонке зависит от состава и температуры.
В кожух выдерживателя вводят пар давлением 0,25 МПа (2,5 кгс/см2). Длительность выдержки (5-7 мин.) зависит от состава и свойств питательной среды. Температура среды, вытекающей из выдержива–1300С.
В цехах приготовления питательной среды необходимо иметь различную измерительную аппаратуру (весы, мерную посуду, дозаторы), аппаратуру для растворения вискозных и твердых веществ, снабженную мешалками (обычные реакторы), центрифуги для осветления растворов (кларификаторы), устройства для декантации.
Хранение культуры и размножение посевного материала
Культуры микроорганизмов – продуцентов веществ – заводы получают из институтов (коллекции культур) в пробирках на косом агаре или в ампулах, законсервированными в виде чистых культур. Каждая культура имеет паспорт с подробным описанием морфологии, физиологии, характеристики среды для культивирования и хранения культуры.
При длительном хранении культуры важно сохранить ее свойства. При частом пересеве культура со временем может изменять свойства – уменьшается продуктивность, появляется гетерогенность культуры, т. е. различные варианты культуры с отличающейся морфологией и физиологией.
В гомогенности или гетерогенности культуры можно убедиться, высевая ее на твердую питательную среду и изучая морфологические и физиологические свойства колоний.
В основе хранения культур (с целью сохранения свойств культуры без изменения) лежит охлаждение, замораживание или обезвоживание. Вам известно, что во всех перечисленных случаях ограничивается или прекращается клеточный обмен веществ. Иногда при замораживании и обезвоживании клетки приводят в состояние анабиоза или преданабиоза.
На практике используют несколько способов хранения культуры:
- на косом агаре при низкой температуре (1–50С). Это позволяет хранить культуру 1–2 месяца, а иногда и дольше.
- замораживание и хранение при температуре ниже –200С. Это позволяет хранить культуру несколько месяцев. Многократное оттаивание и замораживание не рекомендуется.
- на твердых средах под слоем стерильного парафина или минерального масла можно хранить дрожжи, плесневые грибы. Слой масла под поверхностью косого агара должен быть не менее 1 см, оно предохраняет культуру от высыхания и доступа кислорода.
- на агаре без добавления питательных веществ (допускаются очень незначительные добавки питательных веществ) хранят актиномицеты.
- при лиофилизации культуру замораживают при температуре до –800С (обычно при –300С) и подвергают сублимации в вакууме (остаточное давление составляет от 6 до 130 кПа). С целью предохранения клеток от инактивации используют защитные среды (сыворотка крови, бульон, сахароза, смесь песка и глины). Лиофилизированную чистую культуру в ампулах хранят в течение нескольких лет.
- хранение в стерильной смеси песка и глины заключается в следующем: на эту смесь наносят микроорганизмы и суспензию спор и сушат при комнатной температуре и при этой же температуре хранят в посуде, закрытой ватной пробкой.
- консервация спор в песке в следующем: приблизительно 1 г. стерильного песка насыпают в пробирку, высевают туда же споры и сушат их в эксикаторе над силикагелем или хлористым кальцием. После сушки пробирки герметично закрывают пробками и заливают парафином. Через определенное время, специфичное для каждого вида хранения, культуру пересевают.
Перед началом технологического процесса культуру размножают в лаборатории в стерильных условиях при оптимальном составе среды и режиме выращивания (pH, температура, длительность).
При этом в лабораторных условиях культуру размножают двумя способами:
1) культуру продуцента высевают на косой агар, инкубируют до образования спор и смывают их стерильной водой. Суспензию спор снова переносят в свежую агаризированную среду для получения спорового материала второго поколения. Выросшие споры еще раз смывают стерильной водой и суспензию используют для получения первого вегетативного поколения продуцента на жидкой среде;
2) как и в первом случае, культуру продуцента высевают на агаризованную среду для получения спор. Полученную суспензию спор сразу же вносят в колбы с жидкой средой и выращивают их на качалке. Полученный таким образом вегетативный материал продуцента первого поколения используют в качестве посевного материала для второго поколения продуцента в колбах с жидкой средой. Вегетативный материал второго поколения используют для внесения в инокулятор. Для размножения спорового материала широко используют среды на сыпучем материале— зерне, крупе, лузге и др.
Для получения спор многих продуцентов антибиотиков часто используют среду из зерен проса. Споровый материал с таких сред можно засевать прямо в инокулятор, минуя размножение на жидкой среде в колбах. Иногда в лабораторной практике культуру продуцента начинают размножать сразу на жидкой среде в колбах, исключая предварительное получение спор.
Для обеспечения стабильного выхода активных веществ в производственных условиях надо создать достаточный запас культуры продуцента на длительный период времени (год и более), но нельзя часто менять технологию приготовления посевного материала.
После хранения культуру стерильно переносят в колбу объемом 100–200 мл и инкубируют в термостате или на качалке в зависимости от потребности культуры в кислороде. Содержимое колбы используют в качестве посевного материала для первого инокулятора цеха чистой культуры. Последовательность стадий не одинакова. Например, в производстве лизина (аминокислота) в цех чистой культуры поступает посевной материал, полученный из колб на качалке.
Иногда для уменьшения опасности заражения инфекцией в инокулятор культуру вносят прямо из пробирок. При этом длительность инокуляции увеличивается.
Лекция № 12
Стадии получения посевного материала в цехе чистой культуры.
После размножения посевного материала в лабораторных условиях, дальнейшее размножение посевного материала идет в две стадии: в цехе чистой культуры и в отделе инокуляции (рис. 14).
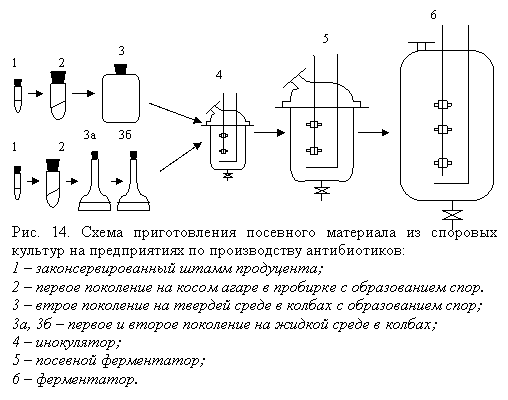
Для приготовления посевного материала используют полноценную среду, тщательно проверенную различными химическими и микробиологическими методами. Количество питательной среды в аппарате не должно превышать 60% общего объема. Если культуру в инокулятор вносят из колб, то количество посевного материала составляет примерно 0,1% объема среды. Такое небольшое количество посевного материала требует длительного периода инокуляции (2–4 суток). Для посевных ферментаторов используют 10–12% инокулятора, поэтому продолжительность приготовления посевного материала на этой стадии уменьшается и обычно не превышает 1 суток.

Главная ферментация.
Обычно она протекает в ферментаторах большого объема. Посевной материал для главной ферментации готовят в количестве 5–20% объема используемой питательной среды. Перед заполнением аппарата питательной средой его моют, проверяют на герметичность, стерилизуют горячим паром как сам ферментатор, так и систему трубопроводов.
После этого заполняют стерильной охлажденной питательной средой. Количество среды в ферментаторе не должно превышать 70% его общего объема. Затем по линии посевного материала с помощью стерильного воздуха в ферментатор вводят посевной материал. Уже перед его подачей температура и pH питательной среды должны быть доведены до оптимальных значений для данной культуры. Регулируют интенсивность аэрации и перемешивания среды. С целью предотвращения попадания нестерильного атмосферного воздуха в аппарат, давление воздуха над поверхностью жидкости повышают на 20–30 кПа.
Продолжение главной ферментации.
В пространстве над жидкостью обычно скапливается пена. Если ее слой сильно увеличивается, то в аппарат вводят химические пеногасители. Во время ферментации автоматически регулируется температура и pH среды. В случае необходимости добавляют растворы кислоты или щелочи. По специальному графику берут образцы жидкости из ферментатора для биохимического и микробиологического контроля. При получении активных веществ методом периодической ферментации, ферментация протекает в два этапа.
На первом этапе идет интенсивное размножение культуры. Она проходит через все характерные фазы развития. На этом этапе компоненты питательной среды используются главным образом на получение энергии и конструктивный обмен веществ – происходит постепенная ассимиляция источников углерода и азотсодержащих веществ, в среде накапливаются продукты окисления углеводов, например, кислоты.
На втором этапе происходит интенсивный синтез нужного материала (иногда он идет параллельно процессу роста культуры), наблюдается старение клеток и их автолиз.
Ферментацию прекращают, когда в среде накапливается максимальное количество полезного продукта. Конец ферментации можно определить и микробиологически по морфологическим изменениям клеток продуцента. Окончив ферментацию, культуральную жидкость охлаждают до 10–150С и перекачивают в резервуары, из которых она постепенно подается на дальнейшую обработку.
Выделение продукта из культуральной жидкости
В состав культуральной жидкости входят остатки использованной питательной среды, синтезированные метаболиты и клеточная масса продуцента. Наиболее простой случай – это использование всей культуральной жидкости как готового продукта, например, при получении бактериальных удобрений, если их применяют в жидкой среде.
Способ выделения продукта культуральной жидкости зависит от того, в каком виде этот выделенный продукт будет использоваться в дальнейшем, этому будет и соответствовать технология дальнейшей обработки.
Например:
1. При производстве витаминных и аминокислотных концентратов для нужд животноводства иногда используют все продукты ферментизации. В таком случае культуральную жидкость упаривают в вакуум-аппаратах и сушат в сушилках распылительного типа.
2. В производстве дрожжей, бактериальных удобрений и средств для защиты растений полезным продуктом является клеточная масса микроорганизмов. В этом случае для выделения биомассы используют сепараторы, осадительные центрифуги, фильтр-прессы, вакуум-фильтры или отстойники. Иногда биомассу осаждают добавлением электролитов (например, FeCl3), надсадочную жидкость декантируют. После центрифугирования биомассу получают в виде густой жидкости или пасты 75–90%-ной влажности. Клеточную массу промывают, фильтруют, сушат, гидролизуют, экстрагируют из нее нужный продукт.
3. Если активные вещества находятся в растворе, то биомассу используют после отделения как побочный продукт, а нужное вещество выделяют из раствора различными химическими или физическими методами:
1) отгонка спиртов и органических растворителей;
2) осаждение кислот в виде солей;
3) выделение аминокислот с помощью ионитов с последующей элюцией, упариванием элюата и кристаллизацией;
4) антибиотики выделяют, осаждая в виде малорастворимых солей из водного раствора, где они предварительно максимально концентрируются путем экстракции или ионообменным путем, а также высушивая водные растворы лиофилизацией или в сушилка распылительного типа.
Лекция № 13
Получение продуктов брожения
Хлебопекарные дрожжи, получение дрожжей из мелассы, выращивание дрожжей на этанольной среде, автолизат дрожжей, кормовые дрожжи
Хлебопекарные дрожжи
В производстве хлебопекарных дрожжей используют специально отобранные расы Sacch. cerevisiae 14,21, Томская 7 и др. При отборе культуры принимают во внимание способность дрожжей сбраживать тесто, т. е. они должны обладать хорошей подъемной силой и ферментативной активностью, хорошо расти на мелассной среде в условиях глубинной ферментации и давать высокий выход биомассы. Клетки дрожжей должны легко отделяться от культуральной жидкости сепарированием или фильтрацией и хорошо сохраняться в прессованном виде. Подъемную силу дрожжей выражают в минутах, в течение которых определенное количество дрожжей развиваясь в определенном количестве теста, увеличивает его объем на предусмотренную стандартом величину. Для хороших дрожжей подъемная сила не должна превышать 75 мин, зимазная активность — 30—40 мин, мальтазная активность — 50— 80 мин. Хлебопекарные дрожжи обладают и бродильной активностью.
Размеры клеток хлебопекарных дрожжей Saccharomyces cerevisiae равны (З-8) X (6-14) мкм. Форма их круглая или овальная.
Технология получения дрожжей имеет много различных вариантов.
Получение дрожжей из мелассы. Питательную среду для выращивания хлебопекарных дрожжей готовят из мелассы с добавками солей фосфора и азота, исходя из того, что готовая продукция должна содержать 6—7% азота и 3, 6—4, 4% Рг2О5 в пересчете на сухое вещество.
В размножении культуры дрожжей различают следующие стадии: лабораторную; чистой культуры; естественно чистой культуры; товарных дрожжей.
В производстве хлебопекарных дрожжей пытаются использовать метод непрерывной ферментации, но быстрое развитие побочной микрофлоры в этих условиях не дает возможности вести процесс дольше 4—6 сут.
Биомассу дрожжей отделяют от культуральной жидкости, используя сепараторы, производительность которых 16—35 м3/ч. Сепарирование обычно идет в три этапа, при двукратной промывке суспензии клеток водой для удаления остатков среды, бактерий и примесей. Получают концентрат дрожжей, содержащий 80—120 г/л сухой биомассы. Его охлаждают до 8—10°С, фильтруют на вакуум-фильтрах или фильтр-прессах и получают дрожжевую пасту с 70—75%-ной влажностью. После кондиционирования пасты водой до стандартной (75%) влажности, дрожжи формуют в плитки массой 50, 100, 500, 1000 г и упаковывают. Хранят прессованные дрожжи при температуре 0—4°С до 10 сут. Хлебопекарные дрожжи можно высушивать при температуре 30—40°С до влажности 8% и хранить до 6 мес.
Выращивание дрожжей на этанольной среде. Ряд культур дрожжей, в том числе Saccharomyces, в условиях недостаточного обеспечения среды кислородом и при наличии углеводов получают энергию путем анаэробного расщепления сахаров (гликолиз); при этом образуется этанол. Как только в среде появляется кислород, клетки дрожжей сразу переключаются на энергетически более выгодный аэробный метаболизм (Пастеровский эффект) и способны метаболизировать не только глюкозу, но и накопившийся в среде этанол. Усваивать этанол дрожжи могут благодаря наличию в их клетках фермента алькогольдегидрогеназы (рис. 41).
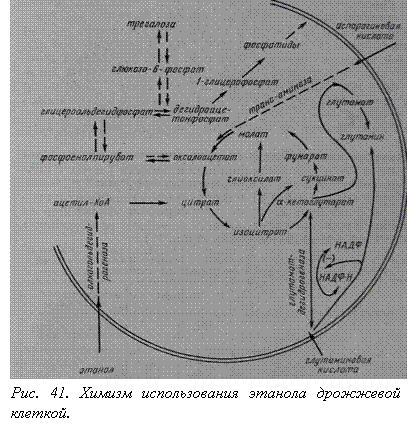 Особенности роста дрожжей Saccharomyces cerevisiac 14 на этанольной среде можно показать на основе работ, проводимых в институте микробиологии им. Л. Кирхенштейна АН ЛатвССР. Стимулирующее действие на рост дрожжей в синтетической этанольной среде, как было показано в этих, оказывают глутаминовая (0,075%) и аспарагиновая кислоты и глутатион (рис. 42); цистеин, напротив, дает обратный эффект. Эти же вещества (кроме цистеина) заметно повышают резистентность дрожжей при конвективной сушке.
Особенности роста дрожжей Saccharomyces cerevisiac 14 на этанольной среде можно показать на основе работ, проводимых в институте микробиологии им. Л. Кирхенштейна АН ЛатвССР. Стимулирующее действие на рост дрожжей в синтетической этанольной среде, как было показано в этих, оказывают глутаминовая (0,075%) и аспарагиновая кислоты и глутатион (рис. 42); цистеин, напротив, дает обратный эффект. Эти же вещества (кроме цистеина) заметно повышают резистентность дрожжей при конвективной сушке.
При выращивании дрожжей на этанольной среде в лабораторном ферментаторе по приточной схеме с добавкой 0,5% дрожжевого экстракта достигнута концентрация сухой биомассы 8—9 г/л при выходе 70—75% от использованного субстрата. Полученные дрожжи имеют несколько пониженную по сравнению с дрожжами, выращенными на мелассе, активность выделения углекислого газа (т. е. бродильную активность), кроме того, этанольные дрожжи менее устойчивы при сушке.
Автолизат дрожжей. Ценные компоненты биомассы дрожжей — аминокислоты белков, витамины, основания нуклеиновых кислот и др. — могут быть использованы для приготовления натуральных и полусинтетических сред, применяемых как в лабораториях, так и для нужд промышленного микробиологического синтеза. Однако большинство ценных компонентов клетки находится в виде различных белковых комплексов, поэтому добавление к среде нативных дрожжей не дает эффекта. Гидролиз белков можно провести ферментативно или используя кислоты и щелочи. При щелочном гидролизе белков возможно разрушение некоторых аминокислот или их изомеризация в D-формы, которые в биологических системах используются не полностью. Надо отметить, что в щелочной среде инактивируются некоторые витамины. При кислотном гидролизе белков разрушаются незаменимая аминокислота — триптофан и некоторые витамины группы В. Гидролиз белков можно осуществить, используя препараты протеолитических ферментов. Кроме того, в самих клетках дрожжей есть активные протеолитические ферменты, которые при определенных условиях в среде могут разрушать клеточные белки (автолиз).
Кормовые дрожжи
В зависимости от природы перерабатываемого сырья для производства кормовых дрожжей чаще всего используют культуры родов Candida, Trichosporon. Выбирая культуру, надо следить, чтобы скорость ее роста в соответствующей среде была максимальной, в состав биомассы входило бы много белков, витаминов, чтобы культура в определенных условиях была вирулентной (могла конкурировать с сопутствующей микрофлорой).
 Кормовые дрожжи получают из доступных, дешевых, содержащих углерод видов сырья, которые можно разделить на несколько групп:
Кормовые дрожжи получают из доступных, дешевых, содержащих углерод видов сырья, которые можно разделить на несколько групп:
1) углеводысодержащее сырье (гидролизаты древесных и сельскохозяйственных отходов, меласса, сульфитный щелок целлюлозной промышленности);
2) природные и синтетические субстраты, содержащие органические кислоты, спирты и другие окисленные соединения углерода (отходы спиртовой промышленности — барда, отходы производства синтетических моющих веществ и др.);
3) углеводороды (нефть, парафины, природные газы).
Необходимо учитывать, что необходимое количество азота можно ввести вместе с источником углерода, например мелассой, где содержится около 0,5% используемого дрожжами азота. Принимают, что коэффициент использования азота из среды равен 0,95.
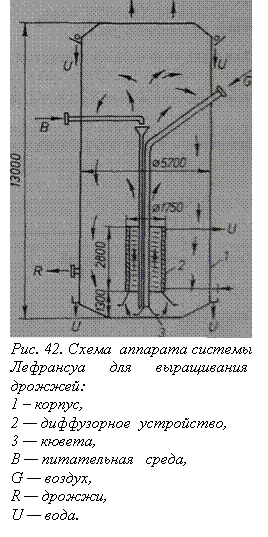
Выращивание культуры дрожжей начинается в лаборатории на 8—10%-ной солодовой питательной среде сначала в 50—100-миллилитровых колбах, затем в колбах Пастера и Карлсберга в течение 24 ч при 30°С и рН 4,5—5,5. Затем культуру размножают в инокуляторах до тех пор, пока получат посевной материал в количестве 10% от имеющегося количества сахара в рабочем объеме производственного аппарата. В инокуляторах так же, как и в лабораторной стадии, выращивание дрожжей ведется в стерильных условиях, но в них уже применяется интенсивная аэрация (30— 50 мя воздуха в час на 1 м3 среды). Основная ферментация в производстве кормовых дрожжей идет по непрерывному методу культивирования. Широко используются дрожжерастильные аппараты типа Лефрансуа, в которых среда и культура дрожжей находятся во вспененном состоянии. На рис. 42 приведен один из таких аппаратов.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 |





