1) Оксидоредуктазы – ускоряют реакции окисления-восстановления.
![]() Субстрат + акцептор оксидоредуктаза Субстрат + Акцептор восстановлено-окисленный
Субстрат + акцептор оксидоредуктаза Субстрат + Акцептор восстановлено-окисленный
Окисление протекает как процесс отнятия атомов водорода (электронов) от субстрата, а восстановление – как присоединение атомов водорода (электронов) к акцептору.
Если обозначить акцептор буквой А, а субстрат – В, то уравнение реакции окисления-восстановления при участии оксидоредуктаз примет такой вид:
![]() ВН2 + А оксидоредуктаза В + АН2
ВН2 + А оксидоредуктаза В + АН2
Характерной особенностью деятельности оксидоредуктаз в живой клетке является их способность образовывать системы (так называемые цепи окислительно-восстановительных ферментов), в которых осуществляется многоступенчатый перенос атомов водорода или электронов от первичного субстрата к конечному акцептору, которым является, как правило, кислород, так что в результате образуется вода.
2) Трансферазы – ускоряют реакции переноса функциональных групп молекулярных остатков. Трансферазы – это один из наиболее обширных классов, он насчитывает около 500 индивидуальных ферментов. В зависимости от характера переносимых группировок различают фосфотрасферазы, аминотрансферазы, гликозилтрансферазы, ацилтрансферазы, метилтрансферазы, формилтрансферазы.
3) Гидролазы – ускоряют реакции гидролитического распада.
![]() R`R`` + HOH R`H + R``OH
R`R`` + HOH R`H + R``OH
В зависимости от характера субстрата, подвергающегося гидролизу, гидролазы делят на ряд подклассов, среди которых наиболее важны следующие:
1. экстразы, ускоряющие реакции гидролиза сложных эфиров;
2. гликозидазы, ускоряющие реакции гидролиза гликозидов, в том числе углеводов;
3. пептид – гидролазы, ускоряющие реакции гидролиза (а в особых случаях и синтеза) белков, пептидов и др. соединений, содержащих пептидные связи;
4. гидролазы, действующие на C-N связи, отличающиеся от пептидных. Всего в составе гидролаз насчитывают около 500 ферментов.
4) Лиазы – ускоряют негидролитические реакции распада органических соединений по связям C-C; C-N; C-O и т. д. При этом замыкаются двойные связи и выделяются такие простейшие продукты как CO2, H2O, NH3 и т. п. Некоторые из этих реакций обратимы, и соответствующие ферменты в подходящих условиях катализируют реакции не только распада, но и синтеза.
5) Изомеразы – ускоряют геометрические или структурные изменения в пределах одной молекулы. Их насчитывается около 90 индивидуальных видов.
Изменения могут состоять во внутримолекулярном переносе водорода, фосфатных или ацильных групп, в изменении пространственного расположения атомных группировок, в перемещении двойных связей.
Важнейшими изомеразами являются триозофосфатизомераза, фосфоглицерат-фосфомутаза и др.
6) Лигазы (синтетазы).
Характерные черты действия ферментов этого класса выявлены совсем недавно. Главная их особенность – сопряженность синтеза с распадом веществ, способность поставлять энергию для осуществления биосинтетического процесса.
Лекция №6
Кинетика ферментативных реакций.
Константой равновесия, константой диссоциации, субстратная константа, константа Михаэлиса. Скорость ферментативной реакции.
Под ферментативной кинетикой понимают зависимость скорости реакции, ускоряемой ферментом, от химической природы реагирующих веществ (субстраты, фермент) и условий их взаимодействия (концентрация, температура, pH среды, наличие активаторов и ингибиторов и т. п.).
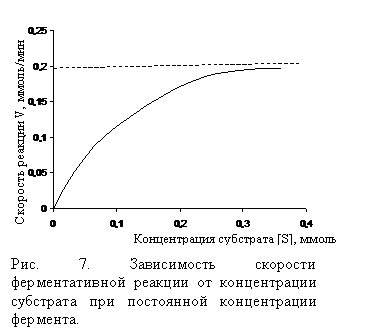 Зависимость скорости ферментативного процесса от концентрации (рис. 7), температуры, pH среды, наличия активаторов и ингибиторов в значительной мере связано с изменением свойств фермента, как белкового тела.
Зависимость скорости ферментативного процесса от концентрации (рис. 7), температуры, pH среды, наличия активаторов и ингибиторов в значительной мере связано с изменением свойств фермента, как белкового тела.
Поэтому мы рассмотрим только вопрос о закономерностях, определяемых природой и концентрацией реагирующих веществ и их изменениями.
![]() Первой фазой биокаталитического процесса является образование фермент-субстратного комплекса:
Первой фазой биокаталитического процесса является образование фермент-субстратного комплекса:
E + S ES
Эта равновесная система может быть охарактеризована соответствующей константой равновесия. Величину, обратную ей называю константой диссоциации фермент-субстратного комплекса или субстратной константой и обозначаю KS.
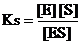
Субстратная константа зависит от природы субстрата и фермента и отражает степень их сродства.
Пример: для сахарозы (фермент, ускоряющий реакцию гидролиза сахарозы) KS = 0,0167 М, т. е. концентрация фермент-субстратного комплекса, превышает концентрацию свободного фермента и субстрата приблизительно в 60 раз. Чем ниже значение KS. тем выше, следовательно, сродство фермента к субстрату.
![]() Так как концентрация фермент-субстратного комплекса изменяется вследствие перехода последнего в продукт реакции с регенерацией свободного фермента:
Так как концентрация фермент-субстратного комплекса изменяется вследствие перехода последнего в продукт реакции с регенерацией свободного фермента:
ES E + P,
то значение субстратной константы kS находят из соотношения констант скоростей прямой (k+1) и обратной (k–1) реакции, т. е.
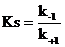
К указанному выводу можно прийти, приравнивая скорости прямой и обратной реакции, что характерно для равновесного состояния системы:
n1 = k+1 [E] [S]; n2 = k–1 [ES], если n1 = n2, то тогда k+1 [E] [S] = k–1 [ES], т. е.
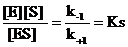
Т. о., субстратная константа диссоциации фермент-субстратного комплекса (kS) характеризует биокаталитический процесс с точки зрения сродства фермента и субстрата и соотношения констант скорости реакции распада и становления фермент-субстратного комплекса.
Так как одновременно с диссоциацией фермент-субстратного комплекса на исходные вещества происходят превращения субстрата в продукт и распад комплекса фермент-продукт на составляющие его компоненты:
![]()
![]() E + S ES E + P,
E + S ES E + P,
то для полной характеристики ферментативного процесса введено понятие о константе Михаэлиса (Km), которая представляет отношение констант скоростей всех трех реакций, осуществляющихся в процессе ферментативного катализа:
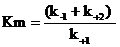
Константа Михаэлиса (Km) всегда несколько выше по числовому значению, чем kS.
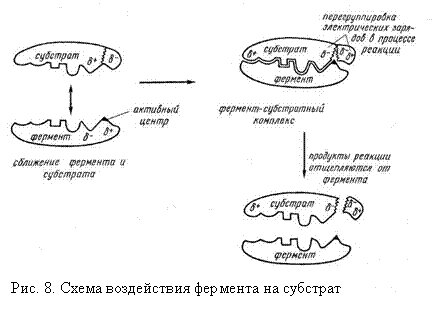
Ферменты с субстратом образуют нестабильный промежуточный продукт, при этом получается фермент-субстратный комплекс, который затем распадается на свободный фермент и продукт реакции (рис. 8).
Из уравнения видно, что фермент освобождается и может снова принять участие в реакции.
Скорость ферментативной реакции v можно охарактеризовать при помощи уравнения Михаэлиса-Ментенна:
![]()
vmax – максимальная скорость реакции;
[S] – концентрация субстрата;
Km – константа Михаэлиса.
Численно константа Km равна концентрации субстрата, при которой скорость реакции составляет половину максимальной. Km имеет размерность Моль.
Встречаются реакции и других типов, например обратимые с одним субстратом. По такому типу идет ферментативное превращение фумаровой кислоты в присутствии фермента фумаразы. Могут происходить необратимые реакции с несколькими субстратами.
В водном растворе вещества реагируют только при столкновении. Если бы не было ферментов, эти столкновения были бы крайне редки (1 : 1012). Таким образом, ферменты увеличивают вероятность протекания реакции.
Ферменты обладают очень высокой каталитической активностью. Одна молекула фермента за минуту может прореагировать с тысячами и даже миллионами молекул специфического субстрата. В клетках микроорганизмов обнаружено более 1000 различных ферментов.
В каждой клетке имеется около 100 тысяч молекул ферментов. Благодаря большой каталитической активности ферментов, каждую реакцию в клетке могут катализировать 50-100 молекул соответствующих ферментов.
Так, kS для сахарозы и комплекса сахарозы равно 0,0167 М, а Km составляет 0,0280 М. скорость химической реакции, ускоряемой ферментом (как и скорость обычной химической реакции), измеряют количеством молей субстрата, превращаемых в единицу времени.
Принципиально важно, чтобы при этом поддерживались стандартные условия для проявления активности фермента: температура 250С, полное насыщение фермента субстратом, оптимальное значение pH. Скорость ферментативной реакции, измеренной при соблюдении вышеперечисленных условий, обозначают V и называют максимальной скоростью ферментативной реакции. Она определяется концентрацией фермента и константой скорости распада комплекса фермент-продукт:
V = k+2 [E]
Скорость ферментативной реакции, наблюдаемую при отсутствии полного насыщения фермента субстратом, обозначают n. Она в каждый данный момент пропорциональна концентрации фермент-субстратного комплекса:
n = k+1 [ES]. Т. к. 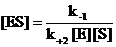 , а
, а 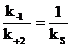 , т. е.
, т. е. ![]() , то
, то ![]() .
.
Таким образом, наблюдаемая скорость ферментативной реакции зависит от концентрации фермента и субстрата и их сродства.
Численно Km равна той концентрации субстрата (в молях на литр), при которой n составляет ½ V.
За единицу любого фермента принимают то его количество, которое в стандартных условиях катализирует превращение 1 мкмоль субстрата в минуту. Эта величина (1 мкмоль/мин) является так же единицей активности фермента.
Лекция №7
Факторы, влияющие на каталитическую активность ферментов.
Механизм действия ферментов. Влияние температуры и pH.
Каталитическая активность ферментов зависит от температуры, pH среды и присутствия различных веществ. Для действия каждого фермента характерна оптимальная температура, при которой скорость реакции максимальна. Так, α-амилаза культуры Aspergillus oryzae имеет оптимум температуры 50-550С. При повышении температуры от 20 до 600 скорость реакции растет; дальнейшее повышение температуры вызывает денатурацию белка и вместе с тем падение скорости реакции. Влияние температуры на активность ферментов показано на рис. 9. Оптимум температуры большинства используемых в биотехнологии ферментов микроорганизмов лежит в пределах 30-400С.
Оптимум действия одних ферментов, например пепсина, наблюдается в кислой среде (pH 2,0), других – в щелочной, а у большинства ферментов – в нейтральной среде. Изменение активности лактатдегидрогеназы культуры 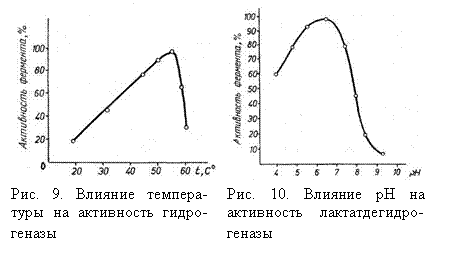 Bac. subtilis в зависимости от pH среды показано на рис. 10.
Bac. subtilis в зависимости от pH среды показано на рис. 10.
Присутствие некоторых веществ может повышать активность действия ферментов (активаторы), а так же снижать ее (ингибиторы). Активаторами многих ферментов являются цистеин и глуатион, восстанавливающие дисульфидную связь, образуя SH-группы, которые часто определяют ферментативную активность, входя в состав каталитических центров. Ингибиторы ферментов могут быть неспецифическими (например, соли тяжелых металлов, которые при связывании с белками осаждают их из растворов), или специфическими (например, синильная кислота, реагируя с определенными химическими группами ферментов, ингибирует действие железосодержащих дыхательных ферментов).
Некоторые вещества в присутствии ферментов конкурируют с субстратом. Обычно это наблюдается при попадании в сферу действия фермента структурных аналогов субстрата. Такие вещества называют субстратными антиметаболитами. Так, сукцинатдегидрогеназа катализирует превращение янтарной кислоты в фумарат.
Синтез ферментов, как и всех других белков, идет на рибосомах из свободных аминокислот. Концентрация различных ферментов в клетке не является постоянной величиной. Их количество можно тысячекратно увеличить путем индукции, которую вызывают добавлением в среду субстрата. Внесение мальтозы в среду выращивания хлебопекарных дрожжей вызывает, например, увеличение содержания фермента мальтазы в клетках дрожжей.
Механизм действия ферментов.
Ведущую роль в механизме ферментативного катализа играет образование фермент-субстратных комплексов, на существование которых было указано в 1902 г. (Д. Браун).
- На первой фазе ферментативного катализа между субстратом и ферментом возникает соединение, в котором реагенты связаны друг с другом ионной, ковалентной или иного вида связью.
- Затем вторая фаза – субстрат под действием присоединенного к нему ферменту претерпевает изменение, делающее его более доступным для соответствующей химической реакции.
- На третьей фазе происходит сама химическая реакция.
- На четвертой фазе образовавшийся продукт реакции освобождается из фермент-продуктного комплекса.
![]()
![]()
![]()
![]() E + S I ES II ES` III EP IV E + P
E + S I ES II ES` III EP IV E + P
E – фермент;
S – субстрат;
S`– активированный субстрат;
P – продукт реакции.
Эта схема была разработана в 1903 г. В. Генри, затем в 1913 г. подтверждена Л. Михаэлисом и М. Ментен прямым выделением ES–, ES` и EP-комплексов.
|
![]() СН3 — СО — О — СН2 — СН2 — N+(СН3)3 + Н2О
СН3 — СО — О — СН2 — СН2 — N+(СН3)3 + Н2О
![]() СН3 –– СООН + НО ––СН2 –– СН2 –– N+(СН3)3
СН3 –– СООН + НО ––СН2 –– СН2 –– N+(СН3)3
Ацетилхолинэстераза — однокомпонентный фермент. В ее активном центре сосредоточены по меньшей мере 4 аминокислотных радикала — глу, сер, гис и тир, обеспечивающие последовательное осуществление перечисленных выше этапов ферментативного катализа.
Сначала между ферментом (ацетилхолинэстераза) и субстратом (ацетилхолин) возникает фермент-субстратный комплекс. Он образуется за счет электростатического взаимодействия между отрицательно заряженной ионизированной СООН-группой радикала глу и положительно заряженным атомом N молекулы ацетилхолина (рис. 11, /, Б). После образования фермент-субстратного комплекса вступают в действие остальные аминокислотные радикалы активного центра ацетилхолинэстеразы. В первую очередь замыкается связь между углеродом поляризованной СО-группы ацетильного радикала холина и кислородом ОН-группы остатка сер. Затем возникает водородная связь между кислородом сложноэфирной связи в молекуле ацетилхолина и ОН-группой радикала тир (рис. 11, II, В).
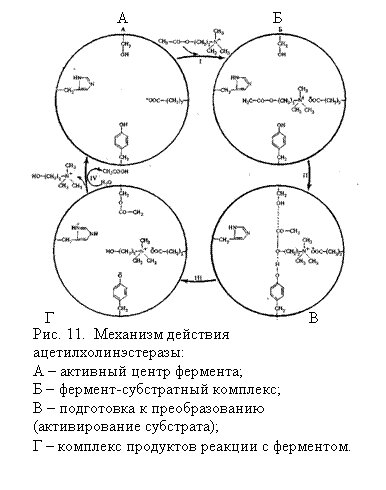 Расположение молекулы ацетилхолина и радикалов сер и тир в активном центре фермента таково, что образование упомянутых связей ослабляет связь между СО-группой и атомом кислорода сложноэфирной связи в молекуле ацетилхолина (эффект «дыбы»). В результате для ее разрыва требуется гораздо меньше энергии, т. е. энергетический барьер оказывается сниженным вследствие активации молекулы ацетилхолина. Поэтому под влиянием радикала гис, оттягивающего на себя протон от ОН-группы сер, упрочняется сложноэфирная связь между радикалом сер и ацетильной группой с одновременным разрывом сложноэфирной связи в молекуле ацетилхолина и переходом протона от радикала тир к остатку холина (рис. 11, ///, Г). Последний высвобождается из активного центра (рис. 11, IV), а его место занимает молекула воды. Она образует связь с карбонильным кислородом ацетильной группы и кислородом тир (на рис. 11 этот этап не показан), после чего протон от остатка гис возвращается к кислороду ОН-группы сер, а протон воды — к радикалу тир. Одновременно выделяется второй продукт реакции — уксусная кислота и регенерируется свободный активный центр ацетилхолинэстеразы (рис. 11, IV, А), готовый к новому акту катализа.
Расположение молекулы ацетилхолина и радикалов сер и тир в активном центре фермента таково, что образование упомянутых связей ослабляет связь между СО-группой и атомом кислорода сложноэфирной связи в молекуле ацетилхолина (эффект «дыбы»). В результате для ее разрыва требуется гораздо меньше энергии, т. е. энергетический барьер оказывается сниженным вследствие активации молекулы ацетилхолина. Поэтому под влиянием радикала гис, оттягивающего на себя протон от ОН-группы сер, упрочняется сложноэфирная связь между радикалом сер и ацетильной группой с одновременным разрывом сложноэфирной связи в молекуле ацетилхолина и переходом протона от радикала тир к остатку холина (рис. 11, ///, Г). Последний высвобождается из активного центра (рис. 11, IV), а его место занимает молекула воды. Она образует связь с карбонильным кислородом ацетильной группы и кислородом тир (на рис. 11 этот этап не показан), после чего протон от остатка гис возвращается к кислороду ОН-группы сер, а протон воды — к радикалу тир. Одновременно выделяется второй продукт реакции — уксусная кислота и регенерируется свободный активный центр ацетилхолинэстеразы (рис. 11, IV, А), готовый к новому акту катализа.
В процессе образования фермент-субстратного комплекса и на дальнейших фазах ферментативного катализа происходят неоднократные изменения третичной структуры фермента, приводящие к последовательному сближению с субстратом и ориентации в пространстве тех активных групп, которые взаимодействуют друг с другом на различных этапах преобразования субстрата. Изменение третичной структуры белка невозможно без участия всей или почти всей полипептидной цепи, образующей белковую молекулу. Следовательно, в каталитическом акте принимает участие по существу вся или почти вся молекула фермента.
Лекция №8
Культивирование микроорганизмов.
Методы выделения, идентификации микроорганизмов. Питательная среда. Методы культивирования.
Чтобы культура микроорганизмов могла нормально расти, размножаться и осуществлять биосинтез какого-то вещества, необходимы оптимальные условия окружающей среды: химические факторы – состав и концентрация питательных веществ, присутствие активаторов и ингибиторов; физические факторы – температура, давление, плотность, подвижность среды, освещение, радиация. При нарушении оптимальных границ этих факторов нарушается обмен веществ, прекращается или ограничивается рост и размножение культуры.
Методы выделения микроорганизмов.
Прямые методы.
Капельный способ Линднера. Суспензию дрожжей разбавляют жидким суслом до концентрации 100 клеток в 1 мл и стерильным чертежным пером наносят мельчайшие клетки на необезжиренное покровное стекло, простерилизованное фламбированием в пламени газовой горелки. Капельки располагают в определенном порядке, обычно по пять капель в два ряда, т. е. всего по 10 капель на стекле. Затем быстро опрокидывают стекло над влажной камерой, которую запечатывают минеральной смазкой. Все капли немедленно просматривают под микроскопом и отмечают те из них, которые содержат по одной клетке. Если все капли содержат по несколько клеток, то увеличивают разбавление суспензии и процедуру повторяют. После трех – четырех дневного инкубирования, когда отмеченные клетки образуют микроколонии, последние переносят стерильной иглой или полоской стерильной фильтровальной бумаги в жидкую среду и размножают.
Метод Линднера в видоизменении Надсона. Чистое покровное стекло проводят трижды через пламя горелки и края его обводят мастикой. На центральную часть наносят каплю прозрачной среды с 10 % желатины или
0,5 % агара. В теплую и еще не застывшую среду вносят иглой суспензию такого разведения, чтобы в каплю попало всего несколько клеток. Стекло помещают во влажную камеру и рассматривают препарат при малом увеличении микроскопа.
Находят ориентиры, которыми могут быть взвеси, пузырьки воздуха или дефекты стекла, и вычерчивают карту с расположенными по отношению к ориентирам одиночными клетками дрожжей. Через каждые 10 – 20 часов препарат повторно исследуют на предметном стекле и под контролем глаза при малом увеличении микроскопа переносят иглой материал в пробирки.
Метод Линднера, упрощенный Вунковичем. Видоизменение Вунковичем метода Линднера сводится к тому, что капельки суспензии, содержащие 3 – 4 клетки, снимают петлей, которой предварительно захватывают стерильную среду, и переносят штрихом на поверхность плотной среды. Через некоторое время появляются микроколонии, число которых на одном штрихе должно соответствовать количеству исходных клеток в отмеченной капельке.
Из этих колоний пересевом выделяют чистые культуры. Таким способом можно получить несколько одноклеточных культур за короткое время.
Выделение спор дрожжей при помощи микроманипулятора.К использованию микроманипулятора прибегают главным образом при необходимости изолировать споры из асков, так как вегетативные клетки легко повреждаются при микроманипулировании.
Аски разрывают либо механически прикосновением игл микроманипулятора, либо заранее обрабатывая суспензию препаратом ферментов (например, из пищеварительного тракта виноградной улитки Helix pomatia), лизирующих клеточную стенку дрожжей.
Для работы с микроманипулятором требуются специальные микроиглы и влажные камеры. Методика их изготовления и детали работы при извлечении аскопор дрожжей описаны в руководствах по генетике и селекции дрожжей.
Непрямые методы.
В эту группу включаются методы, основанные на разделении клеток в питательных средах и использовании специфических биологических особенностей отдельных видов для создания преимущественных условий для их роста.
Метод поверхностного посева на агаровые среды. Посевы производят либо из суспензии пипеткой, либо петлей по принципу «источающего штриха».
Каплю суспензии, содержащей дрожжевые клетки, наносят на поверхность застывшей подсохшей среды в чашке Петри. Стерильным стеклянным шпателем равномерно распределяют каплю по поверхности. Этим же шпателем можно засеять еще 2 – 3 чашки на случай, если в первой будет очень густой рост колоний. Процесс выделения чистой культуры заканчивается пересевом из отдельной, выросшей изолированно колонии в пробирку. Контролем чистоты выросшей культуры служит однородность клеток под микроскопом и однотипность колоний на чашке при последующем посеве.
Выделение чистых культур баллистоспоровых дрожжей. Баллистоспоровые дрожжи легко получить в чистой культуре, используя их способность отбрасывать споры на значительное расстояние. Если после посева на поверхность агаровой среды налить расплавленный агар в чашку Петри и инкубировать его в перевернутом положении, то через некоторое время на нижней пластине появятся колонии в результате прорастания отстрелявшихся баллистоспор.
Методы идентификации микроорганизмов.
Всю совокупность признаков, характеризующих каждый таксон, можно условно разделить на четыре большие группы:
1. Морфологические признаки, описывающие отдельные клетки и их популяции, а также способы вегетативного размножения.
2. Характеристики полового процесса.
3. Физиологические признаки, характеризующие тип питания, рост и энергетический метаболизм.
4. Биохимические признаки, объединяющие особенности образования различных метаболитов, ферментативную активность и состав клеточных компонентов.
Питательная среда.
В состав питательной среды для культивирования микроорганизмов входят углерод, азот, фосфор, кроме того к питательной среде добавляют соли K, Mg, Fe и различные органические вещества.
Источником углерода в питательной среде могут быть углеводы (моносахарозы, полисахарозы), спирты, кислоты, углеводы и др.
Концентрация этих веществ в среде может изменяться от десятых долей процента до 20%. Абсолютное содержание источника углерода для получения определенного количества нужного метаболита или биомассы рассчитывают, используя экспериментально определенные экономические коэффициенты выхода.
Источниками азота в питательной среде являются белки, пептиды, аминокислоты, соли аммония или аммиака, нитраты, а также атмосферный азот.
Количество азотсодержащих веществ для образования биомассы можно вычислить, если известно содержание азота в данной биомассе и ее вероятный урожай. Обычно принимают, что 5% азота остается в питательной среде неиспользованным.
В качестве источника фосфора обычно используют фосфаты.
Потребность микроорганизмов в соответствующих веществах выясняют, культивируя их на синтетических средах, которые состоят из компонентов чистых веществ.
Методы культивирования.
В природе встречается множество микроорганизмов. Но в производстве для микробиологического получения различных веществ используют главным образом чистые культуры, т. е. однородные популяции микроорганизмов одного определенного виды и штамма. Чистую культуру обычно получают из одной изолированной клетки, которую потом постепенно размножают в стерильной среде. Эту работу проводят в стерильном боксе.
Для выращивания аэробных микроорганизмов используют глубинный и поверхностный методы культивирования.
При выращивании микроорганизмов глубинным методом клетки суспендированы в жидкости и находятся во взвешенном состоянии. В небольшую (50–250 мл) колбу наливают жидкую питательную среду, в которую засевают чистую культуру либо с поверхности косого агара, либо из амплитуд. Затем колбу на сутки или более помещают в термостат с определенной температурой, где культура растет и размножается. Чисто аэробные микроорганизмы выращивают в специальных колбах, которые ставят на качалку в термокамере. После этого культуру пересевают в лабораторные ферментаторы со средой такого же или несколько измененного состава. Дальнейшее размножение чистой культуры в производственных условиях идет в несколько стадий при использовании металлических инокуляторов объемом от 0,1 до 100 м3 и более. Для каждой следующей стадии необходимо 3–20% посевного материала.
Последнюю стадию, в которой получают нужный продукт, называют рабочей ферментацией. В культуральной жидкости, полученной после нее, суспендированы микробная биомасса, остатки питательной среды и экстрацеллюлярные метаболиты. Методами химической технологии из культуральной жидкости получают биомассу или нужное вещество – спирт, кислоту, аминокислоту, антибиотики и прочее.
Аналогично выращивают и анаэробные микроорганизмы, только в этом случае питательную среду не продувают воздух.
Используя метод поверхностных культур, микроорганизмы выращивают на твердых средах (влажные отруби и др.) или на жидких средах, залитых тонким слоем (2–20 см) в специальные кюветы. В этом случае биомасса располагается на поверхности среды. Чаще всего этим методом выращивают грибы. Сначала размножают споры, которыми инфицирую стерильную среду. В камерах с кюветами поддерживают нужную температуру и обеспечивают аэрацию – циркуляцию воздуха между кюветами.
Культивирование микроорганизмов может быть:
1. непрерывным;
2. периодическим.
При периодическом процессе весь объем питательной среды загружают в аппарат сразу, добавляют посевной материал и при оптимальных условиях продолжают процесс до тех пор, пока не накопится нужное количество биомассы или определенного метаболита. С физиологической точки зрения периодическое культивирование невыгодно. В ходе его возникает также ряд технологических трудностей – циклический ход операций, сменные режимы, что затрудняет контроль и регуляцию процесса.
Указанные недостатки устраняются при непрерывном культивировании, методы которого разработали , , Н. Д. Иерусалимский и др. из непрерывных процессов лучше всего разработан метод глубинной ферментации. В этом случае ферментатор с культурой продуцента непрерывным потоком подается стерильная среда, а зи него непрерывно вытекает готовая культуральная жидкость. Процесс может быть гомо - и гетерогенно непрерывным.
Лекция №9
Рост и размножение.
Рост и размножение. Методы определения роста и размножения культуры.
В среде, где есть водный раствор питательных веществ, а также соответствующие физические и химические факторы (температура, pH, O2) в клетках микроорганизмов начинаются ферментативные процессы, обмен веществ с окружающей средой. Из веществ, проникающих в клетку, образуются внутриклеточные вещества и структурные элементы. Одновременно идут процессы распада веществ (диссимиляции). Если анаболические процессы преобладают над катаболическими, наблюдается рост клетки, увеличение ее размеров.
Достигнув определенных размеров в соответствующей фазе развития, клетка может начать размножаться.
Скорость размножения зависит как от видовых свойств культуры, так и от условий окружающей среды. Теоретически каждое следующее поколение у дрожжевых клеток появляется через часовой интервал, однако на практике размножение происходит гораздо медленнее, т. к. в среде роста всегда есть лимитирующие факторы: нехватка какого-либо питательного вещества, изменения температуры, pH, образование токсических веществ, избыток клеточной массы на единицу объема.
Бактерии и дрожжи имеют следующие типы размножения:
- деление, в результате которого выросшие клетки делятся на две части и образуются две клетки (чаще всего такое наблюдается у бактерий).
- почкование, начинающееся с появления небольшого выроста – почки над поверхностью материнской бактерии. Почка растет и затем отделяется в виде самостоятельной клетки, в которую переходит цитоплазма и часть ядра от материнской клетки. Такой вид размножения почти всегда встречается у дрожжей. У дрожжей и у некоторых видов бактерий размножение происходит при помощи спор. В клетках спорообразующих дрожжей величина спор достигает 2–6 мкм, а их число может быть 1, 2, 4, 8. Кокки не образуют спор.
При помощи спор или конидий размножаются микроскопические грибы. Споры образуются как внутри вегетативной части гриба, так и снаружи на конце специальных выростов – стеригмов.
Споры образуются при попадании клеток в среду с неблагоприятными условиями, где отсутствуют питательные вещества при наличии влаги и воздуха. В протоплазме клеток происходят следующие изменения: в отдельных местах клеточное вещество уплотняется до 45-55%, эти уплотнения отделяются от остальной части протоплазмы в виде шаровидных, овальных или включений другой формы.
В развитии микроорганизмов наблюдается несколько фаз (рис. 11):
I-ая фаза – лаг-фаза: лаг-фаза может длиться несколько часов: посевной материал, попав в свежую полноценную среду, сразу не начинает размножаться.
Клетки приспосабливаются к среде и окружающим условиям. В этот период активируются ферменты, при необходимости синтезируются новые ферментные системы. В период лаг-фазы быстро возрастает количество нуклеиновых кислот, особенно РНК, что важно при биосинтезе белка.
II-ая фаза – экспоненциальная или логарифмическая. Для нее характерна максимальная скорость для данной культуры размножения клеток. В результате этого запас необходимых питательных веществ в среде уменьшается, кроме того, происходит накопление различных продуктов обмена веществ, которые при определенной концентрации могут мешать нормальному протеканию биохимических процессов обмена веществ. В питательной среде может накапливаться большое количество клеток, они занимают все пространство, и не хватает поверхности для новых поколений клеток, а именно через поверхность происходят процессы обмена – попадание питательных веществ в клетку и выведение метаболитов.
Таким образом, в ходе интенсивного роста и размножения внутри закрытой системы негативное влияние лимитирующих факторов увеличивается и в результате скорость роста уменьшается, наступает фаза замедленного роста III.
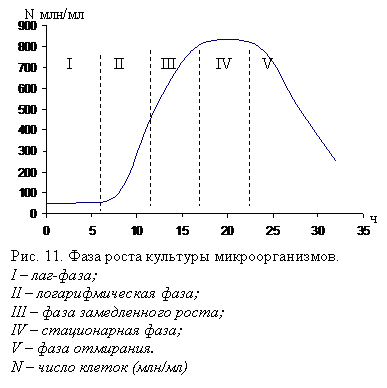 Через некоторое время в стационарной фазе IV масса клеток в питательной среде достигает максимального уровня.
Через некоторое время в стационарной фазе IV масса клеток в питательной среде достигает максимального уровня.
Затем наступает период, когда число отмерших и автолизированных клеток превышает прирост. В результате количество биомассы уменьшается – наступает фаза отмирания V.
Как видно из рис. 11 – наиболее интенсивно рост и размножение происходят в логарифмической фазе, в этой фазе еще не действуют лимитирующие факторы. Максимальная скорость роста в логарифмической фазе различна для каждой культуры и относится к наиболее важной характеристике ее физиологических свойств.
Для характеристики развития культуры микроорганизмов используют скорость роста культуры – изменение количества биомассы в единицу времени.
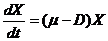
где X – концентрация биомассы, г/л, мг/мл или число клеток в 1 мл;
μ – удельная скорость роста, ч–1;
D – скорость разбавления культуры потоком среды, ч–1.
![]()
где F – скорость потока среды, мл/ч, м3/ч;
V – объем аппарата, мл, м3.
Различают общую скорость роста – это абсолютный прирост биомассы в единицу времени.
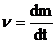
Средняя скорость роста – это прирост биомассы от исходного количества m0 до m1 за время t1 – t0.
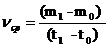
Если прирост биомассы в единицу времени относят к одной единице активной биомассы, в этом случае скорость размножения, обозначают m (или С) можно вычислить по формуле:
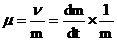
Среднюю удельную скорость роста за период t1 – t0 при увеличении биомассы на m1 – m0 определяют по формуле:
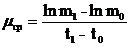
![]()
В солодовой среде (сусло) дрожжи имеют m = 0,19 ¸0,4, а кормовые дрожжи, выращиваемые на гидролизатах и отходах промышленности, имеют m = 0,12 ¸0,17.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 |





