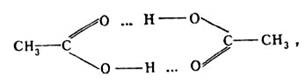Теоретическая часть.
Часть 1. Типы химической связи. Электроотрицательность и степень окисления, полярность связей. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
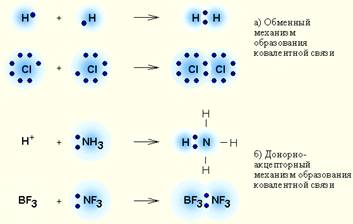
Ковалентная связь – связь между двумя атомами, которые соединяются друг с другом за счет образования ОБЩЕЙ электронной пары.
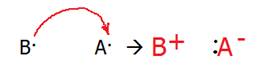
Существует два возможных механизма образования общей электронной пары: · обменный механизм, когда каждый из взаимодействующих атомов предоставляет в пару по одному электрону, · донорно-акцепторный механизм, если один из атомов предоставляет электронную ПАРУ, а другой – пустую (вакантную) орбиталь.
‼ По донорно-акцепторному механизму образованы связи в следующих веществах: 1. Все комплексные соединения; 2. Соли аммония и аминов 3. Азотная кислота, оксид азота (V), нитраты 4. Газы СО - угарный газ, О3 – озон. Электроотрицательность (ЭО) – способность атома притягивать электроны при образовании химической связи. Таким образом, электрон сместится к атому того элемента, который имеет большую электроотрицательность. Возможно три случая для двух атомов А и В, образующих связь: А - В 1) ЭО (А) = ЭО(В) (разность электроотрицательностей равна нулю). Общая электронная пара не смещена ни к одному из атомов. Не возникает ПОЛЮСОВ, электронная плотность у обоих атомов одинакова. Это НЕПОЛЯРНАЯ ковалентная связь. ‼Примеры неполярной ковалентной связи: а) двухатомные простые вещества: H–H, F–F, б) симметричные молекулы типа Н2О2 ( Н-О-О-Н) – связь между двумя атомами кислорода и т. п. 2) ЭО (А) > ЭО(В). При образовании ковалентной связи электронная пара смещена к более электроотрицательному атому А, на нём возникает частичный отрицательный заряд, а на В – частичный положительный. Такая связь называется ковалентной ПОЛЯРНОЙ. ‼ Такой тип связи характерен для молекул (или частей молекул), состоящих из двух и более неметаллов (HCl, H2O, СН3СООН). Чем больше разность ЭО, тем выше полярность связи (при этом электронная пара принадлежит обоим атомам). Например, в ряду НСl à HBr à HI полярность связи уменьшается. 3) ЭО (А) >> ЭО(В). Разность электроотрицательностей настолько велика, что атом В (металл) ОТДАЁТ свой электрон атому В (неметалл). Возникают ИОНЫ - катион В+ и анион А-.
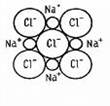
Такая связь называется ИОННОЙ. Ионная связь – предельный случай ковалентной полярной связи. ‼Такой тип связи характерен для соединений металлов с неметаллами, оксидов металлов, оснований и солей, в том числе солей органических и солей аммония. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака.
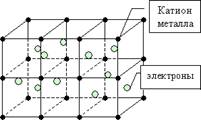
Ионная связь характеризуется ненаправленностью и ненасыщенностью. Вещества с ионной связью имеют ионную кристаллическую решетку. ‼Необходимо помнить, что существуют вещества, в молекуле которых одновременно присутствуют и ионные, и ковалентные связи (например, NaOH, KNO3). 3. Металлическая связь возникает в простых веществах – металлов между положительно заряженными ионами металла и свободно движущимися электронами («электронный газ»). Наличие такого свободного движения электронов является причиной хорошей тепло - и электропроводности металлов.
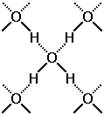
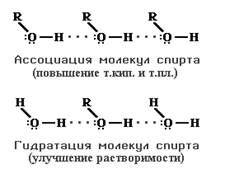
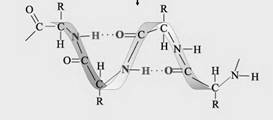
Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние электроны. Поэтому эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. "Обобществленные" электроны передвигаются в пространстве между катионами металлов и удерживают их вместе. _________________________________________________________ Водородная связь – это связь не внутри молекулы, а между молекулами или между независимыми частями молекул. Водородная связь – возникает между сильно электроотрицательными атомами (обычно водорода или фтора, реже азота) и атомом водорода другой молекулы или части молекулы:
(сплошной чертой обозначена ковалентная связь, точками – водородная связь). Наличие водородных связей приводят к аномальному повышению температур кипения у веществ, в которых она присутствует. Температуры кипения водородных соединений неметаллов VIА группы
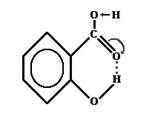
Сильные водородные связи между молекулами воды препятствуют ее плавлению и испарению. Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений, например, для салициловой кислоты.
Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца.
Уксусная, муравьиная и другие карбоновые кислоты и в жидком, и в газообразном состоянии существуют в виде димеров:
Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты.
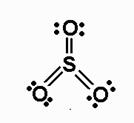
Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов. ‼ Вещества, между молекулами которых есть водородные связи: 1. Вода, лёд. 2. Фтороводород, раствор фтороводорода (плавиковая кислота). 3. Растворы аммиака NH3 и аминов – между азотом аммиака (амина) и атомами водорода воды. 4. Органические вещества, имеющие гидроксильную группу: спирты, фенолы, карбоновые кислоты. 5. Растворы углеводов – моносахаридов и дисахаридов. 6. Белки. ВАЛЕНТНОСТЬ – число связей, образованных данным атомом в данной молекуле. Например, в молекуле SO3 у серы 6 связей, т. е. сера в этой молекуле имеет валентность VI.
Валентные возможности атомов – весь набор возможных валентностей. Они определяются числом неспаренных электронов и возможных донорно-акцепторных связей (ДАС). Высшая возможная валентность элементов (без учёта ДАС), как правило, равнa номеру группы. Это правило не выполняется: А) у элементов второго периода, начиная с азота (у них отсутствуют d-орбитали и нет возможности для распаривания электронов) Б) у элементов 8 группы (в главной подгруппе для гелия, неона и в побочной подгруппе для элементов триад) В) у элементов 1 группы побочной подгруппы (у них высшая валентность больше номера группы). Пример: у серы на третьем внешнем слое есть 6 электронов. В невозбуждённом (основном) состоянии она имеет валентность II: S…3s23p4
При переходе одного электрона на d – оболочку она становится четырёхвалентной: S*…3s23p33d1
Максимально возможная валентность – VI: S** …3s13p33d2
Степень окисления – гипотетический заряд у атома в молекуле, рассчитанный, исходя из предположения об ионном характере всех связей и из того, что в целом молекула электронейтральна. Пример: +1 +6 -2 K2 Cr2 O7 (+1) ∙2 + (+6) ∙2 + (-2) ∙7 = 0 Длина, энергия (прочность) и полярность связи. Длина связи – расстояние между ядрами атомов в соединении. Она зависит: А) от радиусов атомов, образующих связь Б) от кратности связи (одинарная, двойная, тройная). Обычно чем больше длина связи, тем меньше ее энергия (прочность). Связь считается прочной, если ее энергия превышает 500 кДж/моль (например, 942 кДж/моль для N2), слабой - если ее энергия меньше 100 кДж/моль (например, 69 кДж/моль для NO2).
Одинарная связь всегда слабее, чем кратные связи - двойная и тройная - между теми же атомами. Энергии связей между атомами углерода.
Полярность ковалентной связиПолярность химической связи зависит от разности электроотрицательностей связываемых атомов.
Чем больше разность ЭО двух атомов в связи, тем она более полярная. Для ионной связи существует понятие степень ионности, которое тоже зависит от того, насколько велика разность электроотрицательностей атомов. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Часть 2. Характеристики ковалентной связи. Сигма и Пи-связь, гибридизация. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
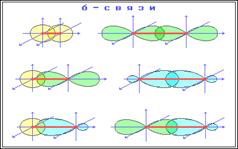
По характеру перекрывания различают сигма σ- и пи - связи - π. σ-связь - это связь, в которой перекрывание атомных орбиталей происходит вдоль оси, связывающей ядра атомов. Сигма связь может образовываться всеми типами орбиталей.
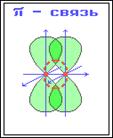
Между двумя атомами в химической частице возможна только одна σ-связь. При перекрывании параллельных друг другу атомных орбиталей перпендикулярно оси связи образуются π-связи.
Пи-связь: дополнительная к сигма связи. Одинарная связь – всегда сигма-связь Двойная связь – состоит из 1 сигма и 1 пи-связи. Тройная связь: 1 сигма и 2 пи-связи.
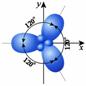
Гибридизация Если атом связан с другими атомами ОДИНАКОВЫМИ СВЯЗЯМИ, но при их образовании участвуют орбитали разного типа, то используется метод ГИБРИДИЗАЦИИ.
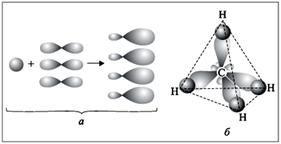
Пример: Молекула СН4 имеет форму правильного тетраэдра, в ней все 4 связи имеют одинаковую длину, прочность, находятся под одинаковыми углами друг к другу. Однако у четырёхвалентного атома углерода электроны расположены на трёх р-орбиталях и одной s-орбитали. Они разные по энергии, форме и расположены в пространстве иначе. Для объяснения используется понятие ГИБРИДИЗАЦИИ: из четырёх атомных орбиталей образуются 4 новых, гибридных орбитали, которые в пространстве располагаются НА МАКСИМАЛЬНОМ УДАЛЕНИИ ДРУГ ОТ ДРУГА. Это правильный тетраэдр, углы между связями равны 109° 29´.
Так как в образовании четырёх связей участвуют одна s и три р-оболочки, то такой тип гибридизации обозначается sp3 В зависимости от числа и типа орбиталей, которые принимают участие в гибридизации, отличают следующие типы гибридизации: 1) sp-гибридизация. Участвуют одна s-орбиталь и одна р-орбиталь. Молекула имеет линейную структуру, валентный угол – 1800.
2) sp2-гибридизация. Участвуют одна s-орбиталь и две р-орбитали. Молекула располагается в плоскости (концы гибридных орбиталей направлены к вершинам равностороннего треугольника), валентный угол – 1200.
3) sp3-гибридизация. Участвуют одна s-орбиталь и три р-орбитали. Молекула имеет тетраэдрическую форму, валентный угол – 109,280.
4) sp3d-гибридизация. Форма молекулы - тригональная БИПИРАМИДА.
5) sp3d2-гибридизация, пример – SF6. Форма молекулы - ОКТАЭДР.
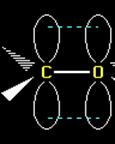
Как определить тип гибридизации? 1. В гибридизации участвуют сигма-связи и НЕПОДЕЛЁННЫЕ ИОННЫЕ ПАРЫ. 2. Общее число участвующих орбиталей – определяет тип гибридизации. Задание: определить тип гибридизации атома углерода в молекуле фосгена. O=C – Cl \ Cl 1) углерод образует 2 одинарные связи (это сигма-связи) и одну двойную связь (сигма+пи).Все 4 электрона углерода участвуют в образовании этих связей. 2) таким образом, в гибридизации примут участие ТРИ СИГМА-связи. Это sp2-гибридизация, молекула имеет форму плоского треугольника. Пи-связь располагается перпендикулярно плоскости этого треугольника.
|
Контрольные вопросы по теме Строение вещества.
1. Каковы механизмы образования ковалентной связи? Какую связь мы называем ковалентной?
2. Чем отличается ионная связь от ковалентной?
3. Что такое валентность? Как определяется валентность атомов?
4. У каких атомов высшая валентность не равна номеру группы?
5. Полярность связи – какими факторами она определяется?
6. Какое вещество обладает самой большой степенью ионности?
7. Что такое металлическая связь?
8. Какие свойства металлов связаны с металлическим типом связи?
9. Когда возникает водородная связь? Как она влияет на физические свойства веществ?
10. От каких факторов зависит прочность и длина связи?
11. Сигма и пи связи. Отличия и характеристики.
12. Типы гибридизации орбиталей в органических и неорганических веществах. Форма молекул с разными типами гибридизации.
13. Типы кристаллических решеток. Характеристики решеток разного типа: прочность, физические свойства.
14. Донорно-акцепторная связь – особенности образования, вещества, в которых она присутствует.