Количество сидероцитов костного мозга у большинства больных лимфомами не превышало границы пределов нормы (0-15%), но достоверно отличалось от больных первичным миелодиспластическим синдромом (41,3±3,7%) (табл.9).
Таблица 9
Количество сидероцитов костного мозга у больных лимфомами и первичным МДС
Показатель | МДС | НХЗЛ | ЛХ | Р | ||
С миелодисплазией (n=52) | Без миелодисплазии (n=21) | С миелодисплазией (n=15) | Без миелодисплазии (n=15) | |||
1 | 2 | 3 | 4 | 5 | ||
Сидероциты% | 41,3±3,7 | 17,0±2,0 | 7,0±0,2 | 5,5±0,5 | 2,5±0,3 | Р1-2,1-3, 1-4,1-5, 2-3 p<0,05, Р4-5 p>0,05 |
При анализе частоты ремиссий у больных лимфомами (табл. 10) отмечено, что при наличии миелодисплазии в дебюте заболевания безремиссионное течение и ранние рецидивы были характерны для 59,6% пациентов с НХЗЛ и 46,7% больных лимфомой Ходжкина, что достоверно отличалось от показателей пациентов с отсутствием диспластических изменений элементов костного мозга, где ремиссия после индукционных курсов не была достигнута у 33,3% больных НХЗЛ и 20,0% пациентов с ЛХ (Р<0,05). При отсутствии дисмиелопоэза ремиссия была достигнута у 66,7% больных неходжкинскими лимфомами и 80,0% - ЛХ, а у больных с миелодисплазией только в 40,4% случаев НХЗЛ и у 53,3% - при ЛХ.
Таблица 10
Частота ремиссий у больных лимфомами при наличии миелодисплазии в дебюте заболевания и при ее отсутствии
НХЗЛ | ЛХ | Р | |||
С миелодисплазией (n=52) | Без миелодисплазии (n=21) | С миелодисплазией (n=15) | Без миелодисплазии (n=15) | ||
1 | 2 | 3 | 4 | ||
Ремиссия более 1 года | 40,4% (21) | 66,7% (14) | 53,3% (8) | 80,0% (12) | Р1-2,3-4 p<0,05 |
Отсутствие ремиссии и ранние рецидивы | 59,6% (31) | 33,3% (7) | 46,7% (7) | 20,0% (3) | Р1-2,3-4 p<0,05 |
Полученные данные свидетельствуют о высокой частоте встречаемости миелодисплазии клеток костного мозга при гемобластозах, особенностью у больных лимфомами является отсутствие бластных форм, гиперплазии эритрона, макроцитоза эритроцитов и высоких показателей сидероцитов костного мозга.
ПОКАЗАТЕЛИ ОБМЕНА ЖЕЛЕЗА У БОЛЬНЫХ ВТОРИЧНОЙ МИЕЛОДИСПЛАЗИЕЙ ПРИ ЛИМФОМАХ И ПЕРВИЧНЫМ МИЕЛОДИСПЛАСТИЧЕСКИМ СИНДРОМОМ
Для уточнения генеза анемического синдрома у пациентов с лимфомами проводилось исследование показателей обмена железа (железо сыворотки крови, общей железосвязывающей способности (ОЖСС), коэффициент насыщения трансферрина (КНТ), уровень ферритина), уровня витамина В12 и фолиевой кислоты сыворотки крови. При оценке показателей феррокинетики выявлено, что у большинства больных неходжкинскими лимфомами (более 80%) показатели сывороточного железа, ОЖСС, КНТ, ферритина были в пределах нормальных значений. Признаки железодефицитного состояния (низкий уровень сывороточного железа, КНТ, повышение ОЖСС и низкий уровень ферритина) наблюдались лишь у 5,3% больных. У 3,2% обследованных больных были низкие показатели железа и КНТ при нормальном и повышенном уровне ферритина. Это может указывать на нарушение мобилизации железа из депо и его утилизации костным мозгом, а также на железоперераспределительный характер анемического синдрома у данной группы пациентов. В группе больных лимфомой Ходжкина признаки дефицита железа выявлены у 33,3% больных, среди которых преобладали молодые женщины с полименореей. В группе больных первичным миелодиспластическим синдромом показатели феррокинетики были в пределах нормальных значений у 38 пациентов из,0%). У 2 пациентов, помимо диспластических изменений, наблюдались признаки дефицита железа (5,0%), а у 1 (2,5%) – признаки перераспределения железа (низкое железо сыворотки и нормальный уровень ферритина).
Уровень витамина В12 (446,3±18,8 pg/ml) и фолиевой кислоты (10,9±0,8 ng/ml) во всех группах был в пределах нормальных значений. Эти данные позволяют исключить В12- и фолиево-дефицитный генез анемического синдрома у обследованных больных. Наличие же диспластических изменений эритроидных клеток говорит о том, что в большинстве случаев анемический синдром при лимфомах связан с нарушениями кроветворения вследствие неэффективного гемопоэза.
УРОВЕНЬ СЫВОРОТОЧНОГО ЭРИТРОПОЭТИНА И ЭКСПРЕССИИ РЕЦЕПТОРОВ К ЭРИТРОПОЭТИНУ У БОЛЬНЫХ ВТОРИЧНОЙ МИЕЛОДИСПЛАЗИЕЙ ПРИ ЛИМФОПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЯХ И ПЕРВИЧНЫМ МДС
При анализе уровня сывороточного эритропоэтина продукция эндогенного эритропоэтина была неадекватной у 62,5% больных лимфопролиферативными заболеваниями, среди которых преобладали пациенты с признаками миелодисплазии, следовательно, большую роль в патогенезе анемического синдрома у больных гемобластозами играет неадекватная продукция эритропоэтина и недостаточная стимуляция ранних эритроидных предшественников костного мозга. У больных первичным миелодиспластическим синдромом, несмотря на довольно большой процент пациентов с высокими цифрами сывороточного эритропоэтина (с-ЭПО), не происходит восстановления уровня гемоглобина и уменьшения степени тяжести анемического синдрома вследствие снижения количества клеток, экспрессирующих рецепторы к эритропоэтину (ЭПО-Р) и увеличенного апоптоза (табл.11).
Таблица 11
Уровень сывороточного эритропоэтина у больных НХЗЛ с анемическим синдромом и первичным МДС
Показа-тель | Больные НХЗЛ с признаками миелодисплазии (n=31) | Больные НХЗЛ без признаков миелодисплазии (n=7) | МДС (n=40) | ||||||
1 | 2 | 3 | |||||||
Абс. | Чел. | % | Абс. | Чел. | % | Абс. | Чел. | % | |
Средний с-ЭПО, mIU/ml | 50,6±7,2 | 31 | 100 | 49,7±4,4 Р1-2 p>0,05 | 7 | 100 | 77,2±9,9 Р1-3,2-3, p>0,05 | 40 | 100 |
С-ЭПО норма, mIU/ml | 73,3±10,3 | 10 | 32,3 | 64,8±8,8 | 2 | 28,6 | 76,0±3,3 Р1-3,2-3, p>0,05 | 15 | 37,5 |
С-ЭПО повышен, mIU/ml | 537,4 | 1 | 3,2 | 210,3 | 1 | 14,2 | 212,1±9,2 Р1-3, p<0,05 Р 2-3,p>0,05 | 19 | 47,5 |
С-ЭПО снижен, mIU/ml | 15,3±4,2 | 20 | 64,5 | 14,8±2,2 | 4 | 57,1 | 15,3±3,4 Р1-3,2-3, p>0,05 | 6 | 15,0 |
У 27,0% больных лимфомами с миелодисплазией обнаружено снижение количества клеток, экспрессирующих ЭПО-Р и у 49% снижение экспрессии ЭПО-Р при достаточном количестве эритрокариоцитов, что может быть причиной резистентности эритроидных предшественников костного мозга к эритропоэтину и неэффективности применения препаратов рекомбинантного человеческого эритропоэтина, что подтверждают исследования (2005). Эти изменения, вероятно, наблюдаются на фоне нарастания выбросов проапоптозных цитокинов со стороны микроокружения и иммунной системы как реакция на опухолевый рост, что приводит к снижению пролиферации ранних эритроидных предшественников, угнетению эндогенной продукции эритропоэтина, а также развитию миелодисплазии, результатом которой является снижение рецепторов к эритропоэтину на поверхности эритрокариоцитов костного мозга.
ЭКСПРЕССИЯ БЕЛКОВ-РЕГУЛЯТОРОВ АПОПТОЗА НА КЛЕТКАХ РАЗЛИЧНЫХ МОРФОЛОГИЧЕСКИХ ВАРИАНТОВ НЕХОДЖКИНСКИХ ЗЛОКАЧЕСТВЕННЫХ ЛИМФОМ
Проводился комплексный анализ экспрессии важнейших белков-регуляторов апоптоза и клеточной пролиферации на опухолевых клетках при различных морфологических вариантах неходжкинских злокачественных лимфом
Для определения прогностической роли молекулярных маркеров опухолевой прогрессии были проанализированы все пациенты с лимфомами, в зависимости от наличия и отсутствия миелодисплазии и результатов лечения: с хорошим ответом (полная и частичная ремиссия) и отсутствием эффекта от лечения (безремиссионное течение).
Экспрессия маркеров апоптоза у больных лимфомами с миелодисплазией была выше, чем у пациентов без диспластических изменений клеток костного мозга: мутантного р-53 был выше - в 1,4 раза (51,9% в группе больных с миелодисплазией против 38,3% в группе больных с отсутствием дизмиелопоэза), онкопротеина c-myc - в 2,8 раза (40,4% против 14,3%; р<0,05, соответственно) и bcl-2 – в 1,8 раза (76,9% в группе с миелодисплазией против 42,9% в группе с отсутствием дисплазии; (р<0,05), маркер множественной лекарственной устойчивости p-gp – в 2 раза (43,2% против 19,3%; р<0,05, соответственно) (таб.11).
Таблица 11.
Частота встречаемости маркеров апоптоза у больных НХЗЛ с миелодисплазией и без нее
Тип маркера | С миелодисплазией (n=52) | Без миелодисплазии (n=21) | Р | ||
1 | 2 | ||||
Количество больных | % | Количество больных | % | ||
bcl-2 | 40 | 76,9 | 9 | 42,9 | Р1-2 p<0,05 |
Р-53 | 27 | 51,9 | 8 | 38,1 | Р1-2 p>0,05 |
c-myc | 21 | 40,4 | 3 | 14,3 | Р1-2 p<0,05 |
p-glycopr | 22 | 42,3 | 4 | 19,0 | Р1-2 p<0,05 |
В группе больных лимфомами с хорошим ответом на лечение уровень экспрессии р-53, bcl-2, c-myc, ki-67, р-гликопротеина (p-gp) был ниже, чем в группе пациентов с отсутствием эффекта от проводимой терапии: р-53 ниже - в 2 раза (28,6% в группе больных с хорошим ответом на терапию против 58,1% в группе больных с отсутствием эффекта; р<0,05), маркер пролиферативной активности ki-67 – в 3 раза (28,6% в группе с хорошим ответом на терапию против 77,4% в группе с отсутствием ответа на терапию; р<0,03), онкопротеина c-myc - в 2 раза (23,8% против 41,9%; р<0,05, соответственно) и bcl-2 – в 2 раза (42,9% в группе с хорошим ответом на терапию против 71,0% в группе с отсутствием ответа на терапию; р<0,05), также маркер множественной лекарственной устойчивости p-gp – в 2 раза (9,5% против 19,4%; р<0,05, соответственно). Уровень экспрессии рецепторной молекулы CD95 достоверно не различался в зависимости от ответа на терапию и составил (57,1% в группе с хорошим ответом на терапию против 67,7% в группе пациентов, у которых эффект от терапии отсутствовал) (рис.1).
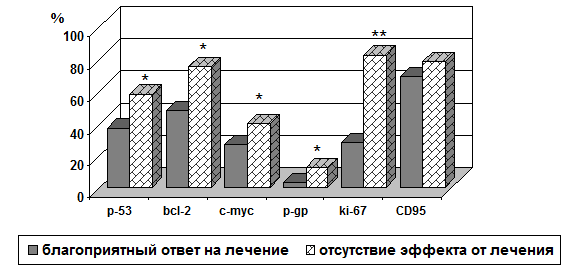
Рис.1. Частота экспрессии регуляторных белков мутантного р-53, bcl-2, c-myc, ki-67, p-gp, CD95 в группах больных лимфомами с различным ответом на химиотерапию
*- р<0,05 и ** - р<0,03 по сравнению с группой больных лимфомами, у которых лечение оказало хороший эффект
Анализ результатов лечения свидетельствует о том, что в группе больных с высоким уровнем экспрессии мутантного р-53, bcl-2, c-myc, ki-67 и p-gp у большинства пациентов наблюдалась резистентность к проводимой терапии и плохой прогноз, безремиссионное течение отмечено у 62,1% обследуемых, а общий ответ на терапию составил 37,9%. Большинство пациентов (68%) демонстрировали мультилинейный (двух-и трехростковый) характер дисмиелопоэза.
В группе больных с низким уровнем или отсутствием экспрессии мутантной формы р-53, bcl-2, c-myc, ki-67, p-gp общий ответ на проводимую терапию составил 60% (полная и частичная ремиссия), что в 2,4 раза выше, чем у пациентов с высоким уровнем экспрессии исследуемых регуляторных белков, безремиссионное течение отмечено у 40% обследованных, что также меньше, чем в предыдущей группе. Изменения морфологии клеток костного мозга у данных больных были минимальными (15,8% - однолинейная и 7,9% - билинейная миелодисплазия).
Анализ полученных результатов свидетельствует о том, что гиперэкспрессия p-gp, ki-67, bcl-2, c-myc и мутантного р-53 у больных лимфомами сочетается с наиболее выраженными морфологическими проявлениями вторичной миелодисплазии, плохим ответом на лечение и неблагоприятным прогнозом. В группе больных с низким уровнем или отсутствием экспрессии изучаемых регуляторных молекул, напротив, диспластические изменения клеток костного мозга были минимальны, общий ответ на проводимую терапию составил 60% (полная и частичная ремиссия), а безремиссионное течение отмечено в данной группе у 40% обследованных, международный прогностический индекс соответствовал группе низкого и низкого/промежуточного риска.
Предпринят математический поиск взаимосвязи между степенью выраженностью миелодисплазии и отдельными маркерами. Для этого использовался корреляционный анализ между переменными по принципу формирования парных значений, которые образуются из рассматриваемых зависимых выборок. Для оценки факта наличия корреляционных связей, их силы и направленности был использован коэффициент корреляции Пирсона. Математический анализ выявил, что корреляционная связь между признаками действительно существует. Выраженность миелодисплазии (процентное отношение дисплазированных элементов костного мозга) хорошо коррелировала с пятью из шести показателей. Наиболее сильная прямая связь индекса была выявлена с p-гликопротеином (коэффициент Пирсона равен (+)0,83) и мутантной формой p53 (+) 0,8. Остальные признаки демонстрировали среднюю и слабую корреляцию: CD95 (+) 0,67, с-myc (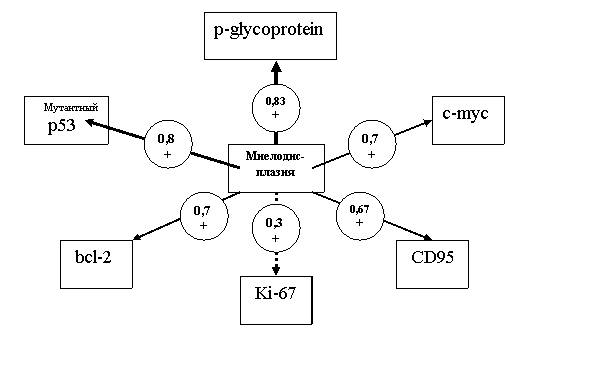 +) 0,7, bcl-2 (+)0,7.
+) 0,7, bcl-2 (+)0,7.
Рис. 2. Схема корреляционных связей между выраженностью миелодисплазии и иммуноморфологическими маркерами у больных НХЗЛ.
Иммуноморфологические маркеры характеризуют злокачественный потенциал опухолевой клетки в его молекулярно-биологическом смысле – способности клетки избегать атак иммунобиологического надзора организма и быть нечувствительной к токсическому воздействию противоопухолевых препаратов. Принимая во внимание, что все цитостатические препараты приводят к гибели опухолевой клетки через повреждение ее генома и запуск программы клеточной смерти, все приобретенные опухолевым клоном на этапах канцерогенеза механизмы блокады апоптоза фактически означают приобретение им резистентности к циторедуктивной терапии. Все вышеизложенные механизмы объясняют полученную взаимосвязь гиперэкспрессии мутантной формы p53, bcl-2 и CD95 с неблагоприятным прогнозом. Морфологически в костном мозге наблюдаются признаки дисплазии, которые, в сущности, отражают процесс программированной клеточной гибели.
Был проведен анализ прогностической ценности маркеров апоптоза и пролиферативной активности в группах с отсутствием и наличием миелодисплазии. В современной литературе часто дискутируется тезис, что клинические проявления опухолевой прогрессии определяются балансом двух противоположно направленных процессов: увеличения клеточной популяции (пролиферации) и элиминации опухолевых клеток (апоптоза). Однако ведущим показателем прогноза выживаемости и лекарственной чувствительности, по мнению большинства авторов, все же следует считать апоптоз (, 2004, H. Kurotaki, 2000). Так и в нашем исследовании высокий уровень прогностической значимости отмечен для маркеров - вcl-2 , мутантного р53, p-gly. Менее выраженной прогностической ценностью обладали c-myc и Ki-67.
АНАЛИЗ ВЫЖИВАЕМОСТИ ПАЦИЕНТОВ С ГЕМОБЛАСТОЗАМИ ПРИ НАЛИЧИИ ИЛИ ОТСУТСТВИИ МИЕЛОДИСПЛАЗИИ
Анализируя выживаемость пациентов, было выделено две группы больных вне зависимости от варианта гемобластоза - без признаков миелодисплазии на этапе диагностики основного заболевания и с наличием диспластических изменений в костном мозге. Построенные кривые выживаемости по Каплан-Мейеру демонстрировали уровень критерия log-rank, верифицирующего достоверность расхождения графиков, равный p=0,00005, что говорит об очень высоком достигнутом уровне значимости отличий. Четырехлетняя выживаемость у больных с признаками миелодисплазии составила 15,5%, без диспластических изменений - 83,0%.
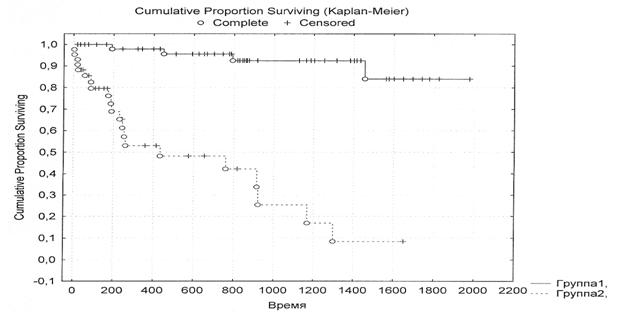
Рис.3. Выживаемость больных гемобластозами за период наблюдения гг. (1 группа –,0%) больных без признаков миелодисплазии на этапе диагностики основного заболевания, 2 группа -,0%) пациентов с наличием диспластических изменений в костном мозге).
Примечание: * каждый период учитывался по последней точке наблюдения
Полученные данные свидетельствуют о том, что у пациентов с диспластическими изменениями в костном мозге из-за выраженных генетических, иммунологических изменений в большом проценте случаев выявляется низкая эффективность ПХТ, частые рецидивы и быстрое приобретение опухолью лекарственной резистентности. В работах ряда авторов показано, что корреляция исследованных нами молекулярно-биологических показателей характеризует общие патологические сдвиги в геноме опухолевой клетки, направленные на приобретение ею химиорезистентности и способности выживать при нарастании агрессии внеклеточных онкосупрессорных факторов (O. M. Howard, J. G. Gribben, D. S. Neuberg et al., 2002, T. A. Davis, A. J. Grillo-Lopez, C. A. White et al., 2000). Эти процессы отражают степень общей генетической нестабильности генома опухолевой клетки как основы ее злокачественного потенциала. Быстрота накопления в субстрате опухоли химиорезистентных клонов отражается на общей выживаемости больных.
Таким образом, обобщая полученные результаты, можно предположить, что возникновение вторичной миелодисплазии при гемобластозах патогенетически связано с возрастанием злокачественности опухоли, усилением опухолевой прогрессии, химиорезистентностью и, как результат, - низкой четырехлетней выживаемостью.
Резюме
На основании проведенного исследования можно заключить, что развитие вторичной миелодисплазии и, как следствие, цитопенического синдрома является серьезной проблемой у больных гемобластозами. Цитопенический, и в том числе анемический синдром ухудшает течение основного заболевания, эффективность проводимой химио- и лучевой терапии и значительно снижает качество жизни пациента.
В основе патогенеза развития цитопении лежит взаимодействие между популяцией опухолевых клеток, иммунной системой и нормальным гемопоэзом, что приводит к снижению пролиферации ранних эритроидных предшественников, развитию диспластических изменений, угнетению продукции эритропоэтина и снижению на поверхности эритроидных клеток рецепторов к эритропоэтину.
Изменения, происходящие в костном мозге у больных лимфомами, можно объяснить не только механической экспансией опухолевого клона с вытеснением нормальных ростков кроветворения, но и дефектом микроокружения в результате воздействия на него опухолевых клеток (качественные и количественные изменения клеток стромы костного мозга с нарушением синтеза цитокинов), что является одним из механизмов развития миелодисплазии, в основе которой лежит усиление программированной клеточной гибели клеток-предшественников гемопоэза (, 2005). Исходя из современных литературных данных и результатов настоящего исследования, становится понятным, что причина возникновения миелодисплазии заключается в активизации проапоптозных механизмов, имеющих целью подавление опухоли, которая способна ускользать от этого воздействия, в результате супрессорное влияние охватывает нормальный гемопоэз. Вследствие этого происходят поломки на генетическом уровне стволовых кроветворных клеток, диспластические изменения клеток костного мозга, а это, в свою очередь, является причиной неэффективного гемопоэза, и в периферической крови пациентов обнаруживается анемия, лейкоцито - и тромбоцитопения.
Важным критерием опухолевой прогрессии и первичной химиорезистентности является повышение экспрессии продуктов ведущих семейств генов – регуляторов апоптоза, пролиферативной активности и лекарственной резистентности на опухолевых клетках гемопоэтической системы. Анализ полученных результатов свидетельствует о том, что гиперэкспрессия p-gly, ki-67, bcl-2, c-myc и мутантной формы р-53 на опухолевых клетках у больных лимфомами сочетается с выраженными диспластическими изменениями клеток костного мозга, с появлением морфологических признаков повышенного апоптоза (наличие апоптозных телец, сморщивание клеточных ядер, появление ядерных фрагментов и т. д.), плохим ответом на лечение и неблагоприятным прогнозом.
Все вышеизложенные механизмы объясняют выявленную взаимосвязь миелодисплазии с неблагоприятным прогнозом при онкогематологических заболеваниях. Выживаемость пациентов вне зависимости от варианта гемобластоза без признаков миелодисплазии значительно превышает показатели выживаемости пациентов с наличием диспластических изменений в костном мозге.
При анализе прогностической ценности маркеров апоптоза и пролиферативной активности в группах с отсутствием и наличием миелодисплазии высокий уровень прогностической значимости отмечен для маркеров - вcl-2 , мутантной формы р53, p-gly. Менее выраженной прогностической ценностью обладали c-myc и Ki-67. Эти данные косвенным образом подтверждают наше предположение о том, что при опухолевой прогрессии неходжкинских злокачественных лимфом реализуется закрепленная генетически программа внутриклеточного подавления апоптоза, что обеспечивает низкую уязвимость опухоли к внешним факторам онкосупрессии и обусловливает прогрессирование опухоли и ее химиорезистентность. Именно поэтому совокупность молекулярно-биологических признаков, отражающих динамику этих нарушений, имеет прямое отношение к прогнозированию клинических проявлений опухолевой прогрессии и общей эффективности циторедуктивной химиотерапии. Быстрота накопления в субстрате опухоли химиорезистентных клонов отражается на общей выживаемости больных.
ВЫВОДЫ
1. Особенностью вторичной миелодисплазии, выявляемой у больных лимфомами до начала терапии основного заболевания, является отсутствие бластных форм, гиперплазии эритрона, макроцитоза зрелых эритроцитов и высоких показателей сидероцитов костного мозга, менее выраженная мегалобластоидность ядер эритрокариоцитов (15,1% при вторичной миелодисплазии, 57,5% - при первичном МДС, p<0,05). Проведение химиотерапии увеличивает степень выраженности цитоморфологических проявлений дисмиелопоэза (64,1% до химиотерапии и 80,6% после, p<0,05).
2. Для больных с вторичной миелодисплазией, в отличие от пациентов без нее, характерно безремиссионное течение заболевания (56,7% и 27,8% соответственно), что в два раза чаще сопровождается анемией и в 4,9 раза - тромбоцитопенией.
3. Анемический синдром у больных лимфомами с признаками миелодисплазии в большинстве случаев обусловлен снижением экспрессии рецепторов к эритропоэтину (у 49,0% обследованных) и числа клеток, экспрессирующих рецепторы (в 27,0% случаев).
4. Цитоморфологические проявления вторичной миелодисплазии обнаруживают высокую прямую корреляцию с гиперэкспрессией опухолевыми клетками белков-регуляторов апоптоза: bcl-2 (r=(+)0,7), c-myc (r=(+)0,7), мутантной формы р-53 (r=(+)0,8) и множественной лекарственной устойчивости - Р-гликопротеина (r=(+)0,83), что сопровождается безремиссионным течением.
5. Наличие миелодисплазии при клиническом дебюте лимфомы является цитоморфологическим критерием неблагоприятного течения заболевания, химиорезистентности опухоли и низкой четырехлетней выживаемости (15,5%) по сравнению с пациентами без диспластических изменений элементов костного мозга (83,0%) (критерий log-rank p=0,00005).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. На этапе первичной диагностики лимфом необходимо выявлять цитоморфологические признаки миелодисплазии, которые являются универсальным критерием вероятности неблагоприятного прогноза течения заболевания.
2. У больных лимфомами с выраженными явлениями вторичной миелодисплазии в качестве иммунофенотипических маркеров неблагоприятного прогноза лимфом целесообразно использовать увеличение в субстрате опухоли неопластических клеток, экспрессирующих bcl-2-протеин, p53, c-myc, p-гликопротеин, для чего рекомендуется ввести моноклональные антитела против этих белков в стандартную диагностическую панель.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Морфологические особенности вторичного миелодиспластического синдрома у больных гемобластозами / , , // Тезисы докладов русско-норвежской конференции гематологов. - Новосибирск, 2003.- С. 68-69.
2. Методология иммуноморфологического диагноза в онкогематологической и онкологической практике / , , // Тезисы докладов русско-норвежской конференции гематологов. - Новосибирск, 2003. - С.74-75.
3. Опыт иммуноморфологической диагностики Т-крупноклеточных анапластических лимфом / , , , // Актуальные вопросы современной медицины: Сборник материалов XIII научно-практической конференции врачей. - Новосибирск, 2003.- С.174-175.
4. , , Ковынев особенности вторичного миелодиспластического синдрома у больных гемобластозами в динамике полихимиотерапии // Журнал экспериментальной и клинической медицины. – 2004 - № 1-2. С. 72-77.
5. Экспрессия белков-регуляторов апоптоза на клетках различных морфологических вариантов злокачественных лимфом / , , , , // Журнал экспериментальной и клинической медицины. – 2004 - № 1-2. С. 52-59.
6. Значение иммуноморфологических маркеров апоптоза при оценке опухолевой прогрессии лимфобластной неходжкинской злокачественной лимфомы / , , , , // Журнал экспериментальной и клинической медицины. – 2004 - № 4. - С.190-192.
7. Молекулярно-биологические и биохимические маркеры прогноза опухолевой прогрессии лимфом / , , // Проблемы гематологии и переливаня крови. – 2004. - № 2. С. 54-55.
8. , , Поспелова и иммуноморфологические маркеры апоптоза у больных различными вариантами миелодиспластического синдрома // Актуальные вопросы современной медицины: Сборник материалов XIV научно-практической конференции врачей. - Новосибирск, 2004.- С.80.
9. Методология иммуноморфологических исследований в онкогематологической практике / , , , , // Актуальные вопросы современной медицины: Сборник материалов XIV научно-практической конференции врачей. - Новосибирск, 2004. - С. 81-82.
10. Клинико-иммуноморфологические особенности злокачественных гистиоцитозов взрослых / , , , , // Актуальные вопросы современной медицины: Сборник материалов XIV научно-практической конференции врачей. - Новосибирск, 2004. - С. 82.
11. Иммуноморфологический анализ экспрессии р-53, bcl-2 и c-myc опухолевыми клетками больных крупноклеточной неходжкинской злокачественной лимфомой / , , , // Клинико-морфологические аспекты общепатологических процессов при социально-значимых заболеваниях: Материалы Всероссийской научно-практической конференции с международным участием, посвященной памяти профессора - Новосибирск, 2004. - С.103-104.
12. Иммуноморфологическая характеристика Т-мелкоклеточных вариантов неходжкинских злокачественных лимфом / , , , // 1 Съезд терапевтов Сибири и Дальнего Востока: Тезисы докладов. – Новосибирск. 2005. – Часть 1. – С. 344-345.
13. Особенности иммунофенотипа опухолевых клеток неходжкинских злокачественных лимфом / , , // Актуальные вопросы современной медицины: Сборник материалов XV научно-практической конференции врачей. - Новосибирск, 2005. - С. 261-262.
14. Иммуноморфологические особенности вторичного миелодиспластического синдрома у больных гемобластозами в динамике полихимиотерапии / , , , // Актуальные вопросы современной медицины: Сборник материалов XV научно-практической конференции врачей. - Новосибирск, 2005. - С. 264-265.
15. Влияние экспрессии Р-53 и BCL-2 на клиническое течение лимфом и эффективность терапии I линии / , , , // Актуальные вопросы современной медицины: Сборник материалов XV научно-практической конференции врачей. - Новосибирск, 2005. - С. 268-269.
16. Миелодисплазия при анемическом синдроме у больных неходжкинскими злокачественными лимфомами / , , // Проблемы гематологии и переливания крови. – 2006. - № 1. – С. 27.
17. , , Иммуноморфологическая структура парапротеинемических гемобластозов // Проблемы гематологии и переливания крови. – 2006. - № 1. – С. 38.
18. Иммуноморфологические варианты лимфобластных неходжкинских лимфом у взрослых и детей / , , // Весник гематологии. – 2006. – Т. 2, № 3. – С. 16-21.
19. Частота и структура неходжкинских лимфом в Новосибирске и Новосибирской области / , , , , , // Х Российский онкологический конгресс: Тезисы докладов. - Москва, 2006. - С.160.
20. Молекулярно-биологические маркеры опухолевой прогрессии неходжкинских злокачественных лимфом / , , , // Интернациональный конгресс «Basic Science for Biotechnology and Medicine». - Новосибирск, 2006. - С. 61-64.
21. Независимое прогностическое влияние коморбидной кардиологической и другой терапевтической патологии на результативность противоопухолевой терапии и выживаемость пациентов с неходжкинской злокачественной лимфомой старшей возрастной группы / , , , // Материалы 1 Национального конгресса терапевтов. - Москва, 2006. - С. 99.
22. Экспрессия молекулярно-биологических маркеров апоптоза и множественной лекарственной резистентности при неходжкинских злокачественных лимфомах / , , , , , // Молекулярно-биологические технологии в медицинской практике. -2007. - № 11. – С. 86-92.
23. , , Дьячкова значение и патогенез анемического синдрома у больных неходжкинскими лимфомами // Гематология и трансфузиология. – 2007. - № 5. – С.10-14.
24. Апоптоз и механизмы опухолевой прогрессии неходжкинских злокачественных лимфом / , , , , , // Бюллетень сибирской медицины. – 2008. – Т. 7. - С. 26-31.
25. Механизмы развития, значение и современные возможности коррекции анемии при неходжкинских лимфомах / , , // Бюллетень сибирской медицины. – 2008. – Т. 7. - С. 70-75.
26. , , Обгольц выживаемости пациентов с лимфопролиферативными заболеваниями при наличии или отсутствии миелодисплазии // Бюллетень сибирской медицины. – 2008. – Т. 7. - С. 97-99.
27. Механизмы развития, клиническое значение и коррекция анемического синдрома у больных неходжкинскими лимфомами / , , // Вестник гематологии. – 2008. – Т. 4. - № 1. – С. 5-10.
Соискатель
СПИСОК СОКРАЩЕНИЙ
ЛХ – лимфома Ходжкина
МДС – миелодиспластический синдром
НХЗЛ - неходжкинская злокачественная лимфома
ПХТ – полихимиотерапия
ОЖСС - общая железосвязывающая способность сыворотки крови
КНТ - коэффициент насыщения трансферрина
МКА – моноклональные антитела
С-ЭПО – сывороточный эритропоэтин
ЭПО – эритропоэтин
ЭПО-Р – рецепторы эритропоэтина
Подписано к печати 24.09.2009
формат - 60х84 1/16, Усл. печ. л. 1
Бумага: офсетная Печать: трафаретная
Тираж: 120 экз. Номер заказа № 000
Типография ООО “ЮГУС-ПРИНТ”, ,

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 |



