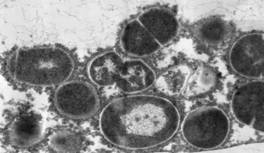
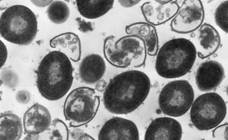
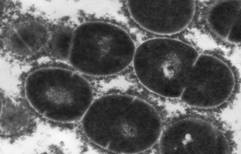
Штамм L. fermentum Z только нарушал характер деления исследуемых стрептококков, вызывая их полиморфизм, образование кокковидных и палочковидных клеток. Это дополняет наши представления о разнообразных механизмах действия LAB, доказывает высокую информативность электронно-микроскопического метода для изучения механизмов их действия.
|
|
|
|
Рис. 1. Влияние метаболитов культур E. faecium L3 и L. fermentum Z на ультраструктуру S. pyogenes 1 (16/49, серотип М4).
Электронная микроскопия, метод ультратонких срезов, увеличение 30000.
S. pyogenes 1, выросшие на поверхности двухслойного агара в присутствии в нижнем слое E. faecium L3 (A), L. fermentum Z (Б) и без LAB (В).
Таблица 1
Антагонистическая активность (МИКА, lg КОЕ/мл) LAB в отношении патогенных микроорганизмов
Штаммы LAB | L. mono- сytogenes EGD | S. aureus ATCC 25923* | S. pyogenes (n=10)** | S. agalactiae (n=10)** | Entero- coccus spp. (n=10)** | E. coli ATCC 25922* | P. aeru- ginosa ATCC 27853* | P. mirabilis E | Kl. pneumoniae E | C. albicans ATCC 665-853 | |
E. faecium L3 | 0,88±0,05 | 3,34±0,22 | 1,07±0,06 |
| 5,28 ± 0,03 | 2,34±0,16 | 0,88±0,67 | 6,3±0,36 | 2,03±0,-4 | 6,31±0,39 | |
E. faecium SF68 | 1,21±0,09 | 3,89±0,19 | 1,21±0,06 | 4,41±0,12 | 6,24±0,26 | 2,89±0,19 | 1,89±0,95 | 4,0±0,24 | 2,89±0,15 | >7 | |
E. faecium M74 | 2,48±0,18 | 4,3±0,03 | 1,58±0,-11 | 4,31±0,13 | 5,05±-0,35 | 3,51±0,07 | 2,74±0,18 | 3,5±0,13 | 2,04±0,12 | >7 | |
L..plantarum 8A-P3 | 0,5±0,03 | 2,5±0,02 | 0,88±0,12 | 3,66±0,02 | 4,17±0,23 | 1,33±0,08 | 0,54±0,12 | 0,25±0,15 | 2,33±0,14 | 3,61±0,18 | |
L. acidophilus EP 312/407 | 1,2±0,06 | 2,37±0,04 | 1,33±0,08 | 4,33±0, 22 | 5,01±0, 45 | 1,76±0,05 | 1,57±0,27 | 2,44±0,15 | 3,76±0,19 | >6,5 | |
L. acidophilus Д № 75 и 76 | 2,5±0,09 | 3,68±0,07 | 1,35±0,08 | 4,88±0, 24 | 5,6±0, 41 | 2,26±0,09 | 1,26±0,06 | 3,4±0,20 | 2,26±0,11 | >7 | |
L. fermentum Z | 1,88±0,04 | 3,53±0,08 | 1,12±0,08 | 4,12±0, 29 | 4,76±0, 32 | 2,50±0,07 | 2,50±0,13 | 3,83±0,23 | 3,53±0,21 | 5,17±0,31 |
Примечания: серым цветом выделены чувствительные культуры LAB ( МИКА <2,5 lg КОЕ/мл), подчеркнуты LAB с умеренной устойчивостью (2,5 <МИКА < 4,5 lg КОЕ/мл), устойчивые бактерии не выделены цветом (МИКА > 4,5 lg КОЕ/мл ).
Использованы штаммы, рекомендованные для определения чувствительности к антибиотикам, соответствующие критериям определения чувствительности бактерий и грибов к антибиотикам Национального комитета по клиническим лабораторным стандартам (NCCLS) 2006 года; ** - приведены средние арифметические данные по результатам исследования 10 штаммов стрептококков и энтерококков.
1.2.2. Антагонистическая активность LAB к стафилококкам
Установлено, что исследованные штаммы LAB обладают неодинаковой способностью влиять на рост и жизнеспособность S. aureus. Наибольшей антагонистической активностью по отношению к этим бактериям обладали штаммы L. acidophilus EP 317/402, L. plantarum 8Р-А3 и E. faecium L3. В меньшей степени ингибировали рост стафилококков штаммы E. faecium SF68 и M74, L. acidophilus Д № 75 и 76, а такж выделенные из влагалища штаммы лактобацилл Z и 62. Не обнаружено антистафилококкового эффекта культур E. faecium V1 и Lactobacillus sp. 64. Показано, что большей чувствительностью обладали штаммы S. aurous 209 и SH1, несколько меньшей - S. aureus ATCC 25923 и SH2 (p< 0,05). Средние МИКА для перечисленных штаммов составляли 4,2; 3,5 и 3,27lg К ОЕ/мл, соответственно. Интерес представляли наблюдения, касающиеся культуральных свойств S. aureus 209. Эти бактерии обладают ярко выраженной способностью вырабатывать золотистый пигмент. При воздействии субингибирующих концентраций (в 5-10 раз меньше МИКА) культур LAB, бактерии вырастали, однако пигментообразование не наблюдалось, в отличие от контрольных проб, в которых стафилококки не испытывали влияния молочнокислых бактерий (в нижний слой не были добавлены культуры антагонистов).
Несмотря на то, что вырабатываемый пигмент не рассматривается как фактор патогенности стафилококков, данный феномен показывает возможность выявления изменений физиологических свойств индикаторных микроорганизмов в результате воздействия метаболитов LAB, в ряде случаев важных с медицинской точки зрения.
1.2.3. Антагонистическая активность LAB к листериям
Используя метод двухслойного агара, были определены значения МИКА, характеризующие антилистериозную активность культур E. faecium SF68, L3 и M71, а также Lactobacillus spp. 8P-A3, EP 317/402, Z, Д № 75 и 76. Все они проявили себя как высокоактивные антагонисты, показатели МИКА которых колебались в пределах 0,5-2,5 lg КОЕ/мл. Несколько менее активны были лактобациллы (р <0,01), в том числе L. fermentum Z.
1.2.4. Антагонистическая активность LAB к грамотрицательным бактериям
Исследованные молочнокислые бактерии обладали высокой антагонистической активностью по отношению к штаммам кишечных палочек. МИКА колебались в пределах 1,3 -3,0 lg КОЕ/мл. В то же время, действие клинических изолятов лактобацилл и энтерококков было менее эффективным (МИКА 4,8-5,0 lg КОЕ/мл). Аналогичные результаты были получены при исследовании штаммов эшерихий, выделенных от детей при колиэнтеритах (10 штаммов) и коров при послеродовых эндометритах (5 штаммов). Анализ чувствительности отдельных штаммов E. coli к действию культур LAB не выявил статистически достоверных штаммовых различий, что может быть связано со сходными механизмами действия молочнокислых бактерий на эшерихии.
Антагонистическая активность LAB к псевдомонадам и клебсиеллам исследовалась на примере типовых штаммов. Значения МИКА молочнокислых бактерий по отношению к клебсиеллам были несколько выше (средние значения этого показателя были выше, p < 0,05). Кроме того, было показано, что максимальной активностью обладали по два пробиотических штамма энтерококков (L3 и M74) и лактобацилл (Д 75 и 76, 8Р-А3).
Все остальные штаммы молочнокислых бактерий обладали промежуточной активностью, за исключением малоэффективно действующих клинических изолятов Lactobacillus spp. 62 и 64. Важно, что практически все культуры пробиотических лактобацилл и энтерококков ингибировали рост P. aeruginosa ATCC 27853. В количестве 0,5-2,5 lg КОЕ/мл. Культуры L. fermentum Z и 62 в отличие от других LAB демонстрировали промежуточную активность (МИКА 3,5 и 3,8 lg КОЕ/мл, соответственно). Остальные клинические изоляты ингибировали рост данной индикаторной культуры только при МИКА выше 5,8 lg КОЕ /мл.
Исследования антагонистической активности LAB по отношению к протеям проводили отдельно от других индикаторных культур, так как бактерии рода Proteus при росте могут распространяться по всей поверхности плотной среды, демонстрируя «ползучий» рост. Показано, что максимальный ингибирующий эффект вызывала культура L. plantarum 8Р-А3, L. acidophilus EP 317/1402, L. fermentum Z , L. acidophilus Д № 75 и 76, значительно в меньшей степени (только при МИКА ≥4,0 lg КОЕ/ мл, р <0,05) ингибировали рост протеев пробиотические энтерококки (SF68, L3 и М74). Особый интерес представляла выявленная общая тенденция – способность влиять на культуральные свойства Proteus sp.. При воздействии на эти бактерии LAB в субингибирующих концентрациях (враз меньше МИКА) культура P. mirabilis утрачивала способность к ползучему росту.
1.2.5. Антагонистическая активность LAB к микоплазмам
Микоплазмы являются одними из самых медленно растущих и требовательных к условиям роста бактерий. Возможно именно поэтому M. hominis 31.P ATCC 15488 оказались самой чувствительной из использованных индикаторных культур. МИКА всех LAB характеризующие их антагонистическую активность в отношении микоплазм колебались в пределах 0-2 lg КОЕ/мл.
При использовании субингибирующих концентраций молочнокислых бактерий существенно изменялась морфология колоний. Они вырастали в виде мелких колоний, не образуя на поверхности среду скопления бактерий, напоминающих яичницу «глазунью».
1.2.6. Антагонистическая активность LAB в отношении грибов
Показано, что практически все исследованные культуры молочнокислых бактерий обладали низкой антимикотической активностью, за исключением L. plantarum 8Р-А3, L. acidophilus EP 317/402 и L. fermentum Z. Индикаторные штаммы грибов проявляли умеренную устойчивость к действию данных LAB (МИКА < 4,5 lg КОЕ/мл). Обращало на себя внимание, что культура Cryptococcus neoformans росла на поверхности двухслойного агара медленнее и оказывалась более чувствительной к действию антагонистов (р <0,05).
В то же время, было отмечено, что добавление в нижний слой агара субингибирующих (в 10 раз меньше МИКА) концентраций антагонистов приводило к изменению характера размножения грибов рода Candida. Они утрачивали способность образовывать псевдомицелий.
В этом разделе работы наряду с LAB была использована контрольная культура антагонистов Saccharomyces boulardii П № 000. Данный пробиотический штамм грибов проявил существенно большую антимикотическую активность (р < 0,01). Его показатели МИКА составляли менее 2,0 lg КОЕ/мл.
1.2.7. Антагонистическая активность молочнокислых бактерий друг к другу
Исследование способности LAB ингибировать рост друг друга позволяло изучать их влияния на микрофлору, в частности, взаимодействие с индигенными LAB в целях создания новых устойчивых консорциумов.
Как видно из данных, представленных в таблице 2, более выраженный антагонизм в отношении энтерококков и лактобацилл, а также собственных культур проявляли штаммы L. plantarum 8Р-А3 и L. acidophilus EP 317/402. Средние арифметические значения их показателей МИКА были 2,3 и 3,3 lg КОЕ/мл, соответственно.
Культура Z отличалась от других LAB сравнительно низкой антагонистической активностью ко всем лактобациллам и энтерококкам (средняя арифметическая МИКА составила 4,4 lg КОЕ/мл).
Таблица 2
Антагонистическая активность (МИКА, lg КОЕ/мл) штаммов LAB друг к другу
Антагонисты | Индикаторные культуры | |||||
E. faecium L3 | E. faecium SF68 | E. faecium M74 | L. plantarum 8Р-A3 | L. acidophilus EP 312/407 | L. fermentum Z | |
E. faecium L3 | 4,34±0,7 | 2,88±0,5 | 0,88±0,054 | 6,03±0,32 | 4,5±0,23 | 5,5±0,282 |
E. faecium SF68 | 2,89±0,15 | 2,89±0,15 | 0,89±0,045 | 5,39±0,27 | 4,89±0,25 | 3,89±0,20 |
E. faecium М74 | 3,31±0,23 | 2,87±0,17 | 0,87±0,044 | 4,89±0,24 | 5,6±0,21 | 4,04±0,24 |
L. plantarum 8Р-А3 | 2,04±0,12 | 1,54±0,10 | 0,54±0,027 | 5,54±0,28 | 3,54±0, 177 | 0,54±0,027 |
L. acidophilus EP 312/407 | 2,37±0,42 | 1,37±0,22 | 2,37±0,12 | 7,37±0,37 | 5±0,30 | 3,54±0, 21 |
L. acidophilus Д № 75 и 76 | 3,91±0,23 | 3,45±0,17 | 2,45±0,12 | 5,59±0,27 | 5±0,25 | 3,45±0,17 |
L. fermentum Z | 5,83±0,35 | 3,9±0,20 | 3,9±0,2 | >6,9 | 4,45±0,22 | 5, 45±0,27 |
Примечания: серым цветом выделены чувствительные культуры LAB (МИКА <2,5 lg КОЕ/мл), подчеркнуты LAB с умеренной устойчивостью (2,5 <МИКА < 4,5 lg КОЕ/мл), устойчивые бактерии не выделены цветом (МИКА > 4,5 lg КОЕ/мл).

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 |




