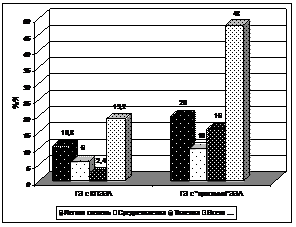
Рис. 12. Частота и степень выраженности ДС у пациентов в отдаленные сроки после ДРЖ в зависимости от метода формирования ГЭА. Статистически значимые отличия от показателей группы с анастомозом по Б-II: *- р<0,05; **-р<0,001.
Только у,5%) пациентов отмечено неполное смыкание кардии, сопровождающееся дистальным рефлюкс-эзофагитом. Культя желудка у этих больных переходит в цилиндрическую трубку протяженностью 5,0–7,0 см, просвет которой представлялся сомкнутым у,5%) пациентов, при этом свободно проходим эндоскопом. Только у 2 обследованных пациентов (3,5%) просвет трубки зиял. При раздувании воздухом диаметр псевдопилорического канала составлял в среднем 2,0 см. Наличие желчи в просвете культи желудка выявлено только у 1 больного. Слизистая оболочка (СО) культи желудка у пациентов после ДРЖ с КПГЭА имела нормальный вид у 43,9% обследованных, очаговая атрофия отмечена у 5,3%, картина поверхностного гастрита – у 47,4%. СО в области непосредственно ГЭА выглядела неизмененной или в части случаев гиперемированной, иногда с лигатурами без паралигатурных зрозий вокруг. Анастомоз всегда был в сомкнутом состоянии, при инсуффляции воздуха и проведении аппарата свободно раскрывался, и затем плотно смыкался на выходе. У пациентов, перенесших резекцию по Б-I и по Б-II статистически значимо чаще выявлялся эзофагит (катаральный у 31,0 и 62,5%, эрозивный - у 16,0 и 37,5 % соответственно), недостаточность кардии. Желчь в просвете культи желудка обнаруживалась в 29,0% и 100% случаев, соответственно. СО культи желудка у этих пациентов с признаками атрофии различной степени выраженности отмечена у 16,0 и 30,8% обследованных после ДРЖ по Б-I и ДРЖ по Б-II соответственно (различия группой с КПГЭА статистически значимы, p<0,05).
При рентгенологическом обследовании пациентов с КПГЭА функциональная недостаточность кардии отмечена только у 7% обследованных, грыжа пищеводного отверстия диафрагмы – у 1,7%, гастроэзофагеальный и энтерогастральный рефлюкс (ГЭР и ЭГР) соответственно у 3,5 и 1,8%. Наиболее часто наблюдался порционно-ритмичный характер эвакуации контрастированной пищи из культи желудка. У большинства пациентов псевдопилорическая трубка сохраняла свою форму и размеры. Отмечена трансформация эвакуаторной деятельности в динамике. В ранние сроки после операции (до 4 недель) наблюдалась преимущественная эвакуация по отводящей петле, однако в более поздние сроки у подавляющего числа пациентов (88%) отмечалась эвакуация как через ДПК, так и через отводящую петлю тощей кишки.
В группах пациентов после ДРЖ по Б-I и Б-II функциональная недостаточность кардии выявлена у 47,4% и 61,5% пациентов, грыжа пищеводного отверстия диафрагмы – у 10,5% и 38,5%, ГЭР– у 28,9% и 61,5% обследованных соответственно. Дуодено(энтеро)гастральный рефлюкс определялся у 39,5% и 76,9% обследованных после ДРЖ по Б-I и по Б-II (различия группой с КПГЭА статистически значимы, р<0,001).
Результаты сравнительного анализа морфологических изменений СО пищевода, культи желудка и зоны анастомоза согласуются с данными эндоскопических и рентгенологических исследований. Частота и степень выраженности морфологических изменений у пациентов после ДРЖ с КПГЭА была значительно меньше, чем у больных после ДРЖ по Б-I и Б-II. По нашему мнению, патогенетической основой реализации данных различий явилось надежное предотвращение дуодено/энтерогастрального и гастроэзофагеального рефлюксов путем создания соответствующих антирефлюксных конструкций на границе между функционально различными отделами пищеварительного тракта. Атрофические изменения СО культи у пациентов после ДРЖ по Б-I и Б-II отмечены у 34,6% и 62,5% случаев соответственно, в группе с формированием КПГЭА этот показатель составил 9,5%. Подобное же соотношение отмечено и для кишечной метаплазии - неполная кишечная метаплазия диагностирована у 30,8% пациентов после ДРЖ по Б-I, у 62,5% пациентов после ДРЖ по Б-II, что статистически значимо превышает показатели в группе больных с КПГЭА – 4,8%.
Изучение синтеза гликопротеидов СО культи желудка в зависимости от типа ГЭА показало, что СО культи после ДРЖ с КПГЭА сохраняют свою функциональную активность в части продукции гликопротеинов, как одного из важнейших защитных факторов, при этом спектр слизеобразования изменяется в сторону более активной продукции нейтральных гликопротеинов, тогда как синтез кислых гликопротеинов не имеет такой тенденции. После ДРЖ по Бильрот−II отмечается более глубокие дистрофические и атрофические процессы в слизистой оболочке культи желудка, снижение синтеза нейтральных гликопротеидов и компенсаторное увеличение продукции кислых гликопротеинов, что обусловлено постоянным воздействием агрессивного доуденального/энтерального содержимого.
Манометрическая оценка пищеводно-желудочного перехода показала, что в группе пациентов после ДРЖ с КПГЭА, технология которой предусматривает низведения нижнего пищеводного сфинктера (НПС) в брюшную полость и формирование фундопликационной манжеты, показатели протяженности и тонуса пищеводно-желудочного клапана приближаются к показателям здоровых лиц. Восстановление абдоминальной позиции НПС и устранение ГПОД, которые входят как компонент хирургической технологии, приводят к полному отсутствию плато давления и двойной реверсии дыхания эзофагокардиоманометрических кривых.
При изучении моторной функции верхних отделов ЖКТ у пациентов после ДРЖ отмечено увеличение отношения времени активности к продолжительности покоя, а также укорочение III фазы мигрирующего моторного комплекса (ММК). Такая перестройка связана с децентрализацией иннервации желудка и тонкой кишки после ДРЖ и активацией автономных механизмов интрамуральной нервной системы, осуществляющих процессы сокращения. Вследствие пересечения нервных путей после резекции нарушается рефлекторное взаимодействие частей пищеварительной трубки, одним из проявлений этого является увеличение доли ретроградных волн в составе ММК. Ретроградные волны у пациентов после ДРЖ по Б-I составили 46,0%, у пациентов после Б-II - 59,0% от всех волн, против 14,0% в группе после ДРЖ с КПГЭА (р<0,05). У 36,4% больных после ДРЖ по Б-I и у 62,5% после Б-II регистрировались моменты прохождения ММК по отводящей петле, во время которого повышение базального давления в ней распространялось и в полость культи желудка, что указывает на отсутствие анатомического и физиологического разобщения культи желудка и нижележащих отделов ЖКТ. Эти факты косвенно подтверждают наличие систематического заброса дуоденального содержимого в полость культи желудка с нарушением гастроэнтерального эвакуаторного процесса.
У 82% пациентов после ДРЖ с КПГЭА отмечалась трансформация моторной активности псевдопилорического канала культи желудка в виде увеличения амплитуды и частоты сокращений. Возникновение этого феномена, как компенсаторно-приспособительной реакции оперированного желудка, мы связываем с увеличением пропульсивной активности фундального отдела, необходимой для постепенного порционного продвижения пищевых масс в тонкую кишку через искусственно созданный привратник – желудочную трубку с КПГЭА, моделирующим функцию пилорического сфинктера. Изучение миграции ритмической активности из желудка через анастомоз в ДПК и тонкую кишку показало, что в сроки более 1 года после операции III фаза или активность, подобная III фазе, возникала в тощей кишке согласованно с ритмичной активностью культи желудка у 72% обследованных после ДРЖ с КПГЭА, тогда как после ДРЖ по Б-I – у 29% (р<0,05). У остальных пациентов культя желудка, ДПК и тонкая кишка функционировали изолированно друг от друга. Восстановление координации желудка, ДПК и тонкой кишки возможно в результате достаточной регенерации интрамуральных нервных сетей в области гастроэнтероанастомоза и отсутствия грубых повреждений в стенках органов.
Оценка качества жизни (КЖ) с помощью опросника SF-36 показала, что у пациентов после ДРЖ по Б-I показатели «болевой симптом», «общее здоровье», «суммарные измерения физического здоровья», «социальное функционирование», «ролевое эмоциональное функционирование», «суммарные измерения психологического здоровья» статистически значимо отличались от здоровых лиц, а такие показатели, как «физическое функционирование» и «ролевое физическое функционирование» отличались как от здоровых лиц, так и от пациентов после ДРЖ с КПГЭА. У пациентов после ДРЖ с КПГЭА показатели «социальное функционирование», «ролевое эмоциональное функционирование» отличались в сторону снижения от здоровых лиц (р<0,05), по остальным шкалам наблюдается снижение показателей, не достигающее при этом статистической значимости. У больных после ДРЖ по Б-II отмечено статистически значимое снижение показателей КЖ по шкалам: «физическое функционирование», «ролевое физическое функционирование», «болевой симптом», «общее здоровье», «суммарные измерения физического здоровья», по сравнению с пациентами после ДРЖ с КПГЭА, что связано, по нашему мнению, с более выраженными морфо-функциональными нарушениями гастродуоденального комплекса. Остальные параметры КЖ не имели различий в обеих группах.
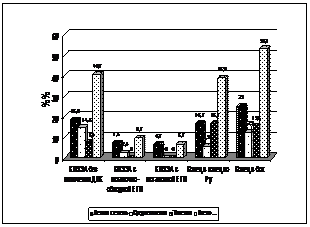
При клинической оценке отдаленных результатов ГЭ проявления рефлюкс-эзофагита обнаружены у 6,0% обследованных с КПЭЭА, при этом у большинства из них в легкой степени. В группе больных с традиционными анастомозами данное осложнение отмечено у 80,7% обследованных, у значительной части в тяжелой и средне-тяжелой формах. ДС наблюдался у 30,1% обследованных с КПЭЭА и у 52,2% – с простыми анастомозами. Включение в пассаж пищи ДПК при концево-петлевой еюногастропластике, так же как и при ДРЖ, способствовало уменьшению частоты развития среднетяжелых и тяжелых форм ДС (рис. 13).
|
|
Рис. 13. Частота и тяжесть ДС после ГЭ в зависимости от типа пищеводно-кишечного анастомоза и варианта восстановления непрерывности ЖКТ |
Клинические данные согласуются также с результатами эндоскопического, морфологического и рентгенологического исследований. СО нижней трети пищевода у больных с КПЭЭА у 91,6% была визуально без патологических изменений, явления эзофагита выявлены в у 7 пациентов (8,2%), причем у 5 из них (6,0%) носили характер катарального. В большинстве случаев (92,6%) КПЭЭА был сомкнут, при инсуффляции воздуха приоткрывался и свободно пропускал тубус эндоскопа. В группе пациентов с традицинонными ЭЭА неизмененная СО пищевода наблюдалась только у 52,0% обследованных, преобладали эрозивные изменения (28,0%), у 4,0% обследованных отмечено язвенное поражение. Наиболее выраженные изменения СО выявлены в группе больных с анастомозом конец в бок: эрозивный эзофагит имел место в 37,5% случаев, катаральный – в 18,8%, язвенный – в 6,3% исследований. У 50% больных просвет анастомоза зиял, неполное смыкание отмечено еще в 26,0% случаев. Через просвет анастомоза в группе больных с боковым соустьем отмечалось поступление окрашенного желчью кишечного сока. Только у 20,0% пациентов слизистая анастомоза выглядела неизмененной, у остальных имели место воспалительные явления различной степени – гиперемия, отек, гиперпластические разрастания слизистой, эрозии, паралигатурные изъязвления.
Жалобы на дисфагию предъявляли 22% обследованных больных с традиционными соустьями, что было обусловлено снижением проходимости анастомоза, в основном связанным с рубцовыми процессами на фоне длительно существующего рефлюкса. У 6 больных отмечалась регургитация (срыгивание). Рубцовый стеноз ЭЭА подтверждался при эндоскопическом и рентгенологическом исследованиях.
Морфологическое исследование биоптатов СО нижней трети пищевода позволило констатировать значительно большую частоту и выраженность морфологических маркеров хронического эзофагита у больных с простыми ЭЭА. Морфологические критерии острого воспалительного процесса в целом по группе присутствовали в трети исследованных препаратов, в 5 случаях (26,3%) обнаружена морфологическая картина эрозии, в 2 биоптатах (10,5%) – хронической язвы пищевода. В 21,1% бипотатов выявлены атрофические процессы в слизистой оболочке пищевода. В 2 (10,5%) препаратов имелись фиброзные изменения. Паракератоз и папилломатоз обнаружены в 5,3% биоптатов, в 3 (15,8%) имела место метаплазия.
При рентгенологическом изучении частоты рефлюкса контрастной взвеси в пищевод в положении Тренделенбурга рефлюкс умеренной степени выявлен только у 2 обследованных больных (2,41%) с КПЭЭА. Среди пациентов контрольной группы рефлюкс выявлен у,0%) (р<0,001), при этом у двух третей обследованных степень выраженности заброса была значительной.
Таким образом, полученные нами данные убедительно свидетельствуют о том, что применение функционально адекватных пищеводных анастомозов при ГЭ сопровождается значительно более низкой частотой и степенью развития рефлюксных осложнений со стороны анастомоза, чем традиционных методов.
Основной функциональной особенностью КПЭЭА, отличающей его от других конструкций, является свободная проходимость для пищевого комка только в одном направлении и клапанное закрытие анастомоза, предупреждающее обратный транзит пищи. Изучение рентгенологических данных показало наличие следующих механизмов функционирования анастомоза: 1) диафрагмальный компонент, обусловленный сокращением диафрагмального мышечного жома, восстановленного швами-вязками; 2) пищеводный компонент – сокращение мышечных слоев пищевода в зоне нижнего пищеводного сфинктера; 3) кишечный компонент, обусловленный перистальтикой охватывающей пищевод петли тонкой кишки; 4) клапанный компонент, обусловленный газовым пузырем созданного кишечного резервуара.
При манометрическом исследовании в области КПЭЭА регистрируется подъем давления, достигающий 12,8±3,1 мм. рт. ст. и указывающий на наличие тонуса искусственной кардии, протяженность зоны повышенного давления составляет 25 – 50 мм (в среднем 41,7±6,1 мм). Изучение манометрических показателей позволило нам уточнить некоторые механизмы антирефлюксной активности концево-петлевого ЭЭА. Эти механизмы включают: спонтанное волнообразное действие мускулатуры тонкой кишки на стенку пищевода, действие ее при рефлекторном усилении мышечной активности кишки после раздражения кишечной слизистой водой или пищей, действие мускулатуры диафрагмы, а также действие собственной мускулатуры терминальных отделов пищевода.
У всех пациентов после ГЭ констатировано снижение всех показателей КЖ в сравнении с контрольной группой, наиболее выраженное в группе больных с простыми конструкциями анастомозов.
При оценке клинико-функциональных результатов ПРЖ худшие показатели имели место среди пациентов с I вариантом соустья. В этой группе клинически отмечались наибольшая частота и степень выраженности симптома изжоги (21,4% против 8,3 и 0% в группах II и III, p<0,05), дисфагии (10,6%), регургитации (6,4%). Клинические данные четко корелировали и данными инструментальных методов исследования. У больных I группы эндоскопические признаки эзофагита зарегистрированы у 15 обследованных пациентов (31,9%): у 3 (6,4%) катаральный, у,5%) – эрозивный, у трети больных этой группы отмечено наличие слизи, жидкости и примеси пищи в просвете пищевода, что свидетельствовало о нарушении проходимости анастомоза, а также о наличии гастро-эзофагеального рефлюкса. В группах II и III частота и выраженность рефлюкс-эзофагита было статистически значимо меньше (p<0,05), в частности, эрозивных поражений СО пищевода не отмечено ни в одном случае. Помимо большей частоты и степени выраженности эзофагита у 6 больных I группы (12,8%) была нарушена проходимость анастомоза, у 2 из них отмечался выраженный стеноз соустья, что проявлялось дисфагией умеренной и выраженной степеней. У,5%) I группы отмечено неполное смыкание соустья, у 1 больного (2,1%) анастомоз зиял. У 34,0% обследованных пациентов I группы отмечались те или иные изменения со стороны непосредственно анастомоза - гиперемия, отечность, паралигатурные эрозии. Морфологические критерии эзофагита выявлены приблизительно у 25% пациентов I группы, у 20,8% из них морфологически подтверждено эрозивное поражение слизистой, в то время как в биоптатах пациентов III группы эрозии не обнаружены ни в одном случае, во II группе – только в одном биоптате. При рентгенологическом исследовании гастроэзофагеальный рефлюкс зафиксирован у,7%) пациентов после ПРЖ: у 6 больных с I вариантом концевого пищеводно-желудочного анастомоза он был выраженный, у 3 умеренной степени. Во II группе рефлюкс умеренной степени отмечен только у 1 пациента.
Сопоставляя полученные морфофункциональные результаты с особенностями выполненной операции следует констатировать, что у пациентов II и III групп ПЖА формировался при наличии достаточной длины культи абдоминального отдела пищевода – не менее 4,0 см, что позволяло сформировать полноценный инвагинационный клапан или концево-петлевой ЭЭА при еюногастропластике. У 15 обследованных пациентов I группы была выполнена резекция абдоминальной части пищевода и ПЖА формировался на уровне или выше уровня диафрагмы в условиях сагиттальной диафрагмокруротомии. При резекции абдоминального отдела пищевода создать полноценную клапанную конструкцию без фиксации клапана к диафрагме практически не представляется возможным. Отсутствие фиксации пищевода к диафрагме в условиях полного разрушения естественного связочного аппарата создает условия для миграции соустья в средостение вследствие развивающегося укорочения пищевода. Этим фактом объясняются сравнительно худшие морфофункциональные результаты у пациентов I группы.
При изучении манометрических характеристик пищевода в сроки 1 год и более обнаружились различия между группами больных в зависимости от типа анастомоза. В группе пациентов с 1 типом анастомоза изменения моторики пищевода выражались в снижении амплитуды и увеличении продолжительности перистальтических волн. Подобная картина сократительной активности пищевода свидетельствуют о развитии воспалительных изменений в пищеводе и ухудшении его опорожнения, что характерно для эзофагита. У пациентов II и III групп подобные изменения были выражены в меньшей степени. Протяженность и тонус сформированного инвагинационного клапана была наибольшей у пациентов с II типом анастомоза, у больных с концевым инвагинационным анастомозом протяженность клапана была существенно меньше. У больных III группы показатели протяженности и тонуса пищеводно-кишечного соустья были сопоставимы с аналогичными показателями у пациентов после ГЭ.
Пациенты, перенесшие экономную проксимальную резекцию желудка с инвагинационным ПЖА и проксимальную резекцию желудка с еюногастропластикой с концево-петлевым эзофагоэнтероанастомозом характеризовались более высокими показателями КЖ по шкалам физического и психического здоровья.
Анализ механизмов реализации арефлюксной функции концевых инвагинационных пищеводно-желудочных анастомозов показал наличие нескольких компонентов. Как и в концево-петлевом пищеводном соустье, одна из основных ролей принадлежит диафрагмальному компоненту, включающему мышечный диафрагмальный жом и искусственный связочный аппарат. Активный мышечный компонент в инвагинационных конструкцииях играет меньшую роль, чем в концево-петлевых анастомозах, тем не менее, мышечная «петля» из стенки желудка при прохождении перистальтических и антиперистальтических волн способствует полному перекрытию просвета анастомоза. Относительно большее значение в инвагинационных конструкциях имеет клапанный компонент: подвижный клапан, сформированный из слизисто-подслизистого слоя с избыточной складчатостью смыкается за счет газового пузыря культи желудка при повышении внутрипросветного давления в культе в процессе заполнения ее пищей.
ВЫВОДЫ
1. Хирургическая технология формирования кишечной раны однорядным серозно-мышечно-подслизистым швом с расширенным сопоставлением подслизистых слоев при формировании концевых анастомозов на тонкой и толстой кишке позволяет осуществлять адекватный визуальный контроль за сохранностью сосудистой сети подслизистой основы, обеспечивает точное сопоставление одноименных слоев кишечной стенки и создает оптимальные условия регенерации кишечной раны, что в сравнении с другими прецизионными однорядными швами в эксперименте обеспечивает более быструю эпителизацию соустья и значительно меньший объем рубцовой ткани на уровне мышечного и подслизистого слоев.
2. Желудочно-кишечный анастомоз концево-петлевой конструкции (в условиях эксперимента) при пропускании через него жидкости с постоянными скоростями, а также при моделировании кратковременных ритмичных подъемов давления в условиях эксперимента, функционирует как единый механизм с псевдопилорическим каналом культи желудка и выполняет функции дозированного постепенного опорожнения культи желудка и препятствия рефлюксу из отводящей петли в культю желудка. Пищеводно-кишечный анастомоз концево-петлевой конструкции в аналогичных условиях обеспечивает беспрепятственный антеградный пассаж через пищевод и соустье и проявляет выраженные антирефлюксные свойства при ретроградном направлении движения жидкости.
3. Концево-петлевой ГЭА в условиях хронического эксперимента функционирует согласованно с культей желудка и обеспечивает разобщение полостей желудка и тонкой кишки. Это способствует более полной компенсации моторной функции верхних отделов ЖКТ, сохранению функциональной активности СО культи желудка в части продукции гликопротеидов, незначительной степени выраженности атрофических процессов в СО культи желудка.
4. В группах пациентов с пластическими функционально адекватными анастомозами при ГЭ, дистальной и проксимальной резекции желудка госпитальная летальность, частота и тяжесть осложнений раннего послеоперационного периода ниже, чем в группах с традиционными соустьями.
5. Дистальная резекция желудка с концево-петлевым гастроэнтероанастомозом в отдаленном периоде имеет преимущества перед резекцией желудка по способам Бильрот I и II, выражающиеся более низкой частотой и степенью диспепсического синдрома, демпинг-синдрома, рефлюкс-эзофагита и гастрита, меньшей частотой и активностью атрофических и диспластических процессов в слизистой оболочке культи желудка, более высокими параметрами качества жизни пациентов. Концево-петлевой анастомоз, проявляя себя как функционирующая структура, обеспечивает восстановление периодичности и координации моторной деятельности культи желудка, порционность эвакуации пищи, препятствует рефлюксу дуоденального/энтерального содержимого в культю желудка, предупреждает развитие постгастрорезекционных синдромов.
6. Концево-петлевой эзофагоэнтероанастомоз у большинства больных в отдаленном послеоперационном периоде после ГЭ сохраняет все свои структурные элементы и функциональные возможности, обеспечивает свободную и порционную эвакуацию и адекватно замещает разобщающую функцию утраченной кардии, что предупреждает развитие рефлюкс-эзофагита и других поздних послеоперационных осложнений. Отсутствие клапанных устройств в простых концевых и концево-боковых анастомозах лишает их арефлюксной функции и приводит к развитию у большинства пациентов регургитационных синдромов. Варианты реконструкции после ГЭ, предусматривающие включение в пассаж пищи ДПК имеют преимущества перед выключающими ДПК схемами в плане частоты и тяжести течения демпинг-синдрома.
7. Пластические арефлюксные пищеводно-желудочные анастомозы при ПРЖ обеспечивают хорошие отдаленные клинические и функциональные результаты у большинства пациентов в отдаленном периоде. Частота и степень выраженности рефлюкс-эзофагита после ПРЖ зависит от объема резекции желудка и абдоминального отдела пищевода и от конструкции пищеводно-желудочного анастомоза: наибольшая она после ПРЖ с концевым инвагинационным анастомозом, наименьшая – после ПРЖ с еюногастропластикой с концево-петлевым эзофаго-энтероанастомозом.
8. В реализации антирефлюксной функции пищеводно-кишечного анастомоза концево-петлевой конструкции принимают участие активные функциональные механизмы, включающие двигательную активность самого пищевода, движения диафрагмы, спонтанное волнообразное действие мускулатуры тонкой кишки на стенку пищевода, а также действие кишечной петли при рефлекторном усилении мышечной активности в результате раздражении ее слизистой оболочки поступающей через анастомоз пищей.
9. В функционировании концевых инвагинационных пищеводно-желудочных анастомозов при ПРЖ одна из основных ролей принадлежит диафрагмальному компоненту, включающему мышечный диафрагмальный жом и искусственный связочный аппарат. Активный мышечный компонент при прохождении перистальтических и антиперистальтических волн создает зону повышенного давления на границе пищевода и культи желудка, в которой кроме постоянного тонического компонента присутствуют и фазовые колебания.
СПИСОК ОСНОВНЫХ НАУЧНЫХ РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. , , Каушанский результаты гастрэктомии у больных раком желудка // Паллиативная медицина и реабилитация. – 1999.– № 3. – С. 11 – 15.
2. , , Ш, , Лютов лечение кардиоэзофагеального рака // Вестник Российского онкологического научного центра имени РАМН. – 2003. - №1- С. 89 – 90.
3. , , Шатов функциональная оценка концево-петлевого и концево-бокового гастроэнтероанастомозов в эксперименте // Кубанский научный медицинский вестник№ 5 – 6. – С. 107 – 111.
4. , , Шатов -петлевой пищеводно-кишечный анастомоз в свете отдаленных функциональных результатов // Кубанский научный медицинский вестник - 2004. - № 5 – 6. – С. 80 – 84.
5. , , Самородский арефлюксные пищеводно-желудочные анастомозы при проксимальной резекции желудка: хирургические технологии и функциональные результаты // Кубанский научный медицинский вестник - 2004. - № 5 – 6. – С. 84 – 88.
6. , , Оноприев хирургические технологии восстановления непрерывности кишечника у больных колоректальным раком пожилого и старческого возраста // Кубанский научный медицинский вестник. – 2005. - № 5–6 (78 – 79). – С. 125 – 129.
7. , , Оноприев обоснование оптимального способа шва пищеводно-кишечного анастомоза // Кубанский научный медицинский вестник– 2005. - № 5–6 (78 – 79). – С. 129 – 133.
8. , Уваров с концево-петлевой еюногастропластикой при раке желудка // Хирургия. – 2004. - № 9, с. 32 – 36.
9. , , Гоголев гидродинамических характеристик гастроэнтероанастомоза концево-петлевой конструкции в эксперименте // Экспериментальная и клиническая гастроэнтерология. – 2004. - №4 – С. 62 – 66.
10. , , Лютов оценка прецизионного однорядного серозно-мышечно-подслизистого шва на модели тонко-тонкокишечных и желудочно-тонкокишечных анастомозов в эксперименте // Кубанский научный медицинский вестник. – 2004 - № 2 – 3 (69 – 70) С. 60 – 64
11. , , Лютов особенности регенерации дуоденальной раны в условиях прецизионного однорядного шва. Типы дуоденальных анастомозов // Кубанский научный медицинский вестник. – 2006 - № 7 – 8 (88 – 89) - С.
12. , , Марков патоморфология желудочных язв и технология радикальной гастропластики // Кубанский научный медицинский вестник. – 2006 - № 7 – 8 (88 – 89) - С. 126 – 132.
13. , , Пахилин патоморфология (гистотопография) перфоративных язв и технологические особенности радикальной дуоденопластики // Кубанский научный медицинский вестник. – 2006 - № 7 – 8 (88 – 89) - С. 74 – 78.
14. , , Медникова и технологии противорецидивных операций после изолированной радикальной дуоденопластики // Кубанский научный медицинский вестник. – 2006 - № 7 – 8 (88 – 89) - С. 154 – 158.
15. , , Оноприев однорядный шов двенадцатиперстной кишки в эксперименте // Бюллетень экспериментальной биологии и медицины. – 2007. – Приложение 3. – С. 40 – 44.
16. , , Оноприев верхних отделов желудочно-кишечного тракта после дистальной резекции желудка по Бильрот-II и еюногастропластики с формированием концево-петлевого анастомоза в эксперименте // Бюллетень экспериментальной биологии и медицины. – 2007. – Приложение 3. – С. 63 – 67.
17. , , Оноприев еюногастропластика с концево-петлевым гастроэнтероанастомозом и включением двенадцатиперстной кишки при дистальной резекции желудка (хирургическая технология и функциональные результаты) // Вестник хирургии им. . – 2008. – Т. 167, № 1. – С. 37 – 42.
18. , , Оноприев с сохранением блуждающих нервов и формированием искусственного желудка из петли тощей кишки при болезни Менетрие // Экспериментальная и клиническая гастроэнтерология. – 2008. - № 3– С. 50 – 52.
19. , , Рожнов хирургического лечения рака проксимального отдела желудка. Патент на изобретение № 000 РФ (9 стр.). – Приоритет от 01.01.2001. Опубл. 20.11.2001 г. БИ № 32.
20. , Уваров субтотальной проксимальной резекции желудка. Патент на изобретение № 000 РФ (10 стр.). – Приоритет от 01.01.2001. Опубл. 10.08.2003. БИ № 22.
21. , , Самородский проксимальной резекции желудка. Патент на изобретение № 000 РФ (18 стр.). – Приоритет от 01.01.2001. Опубл. 27.11.2003. БИ № 33.
22. , , Самородский назогастральный зонд. Патент на изобретение № 000 РФ (4 стр.). - Приоритет от 01.01.2001. Опубл. 10.01.2005. БИ № 2.
23. , , Лютов тонкокишечной гастропластики после гастрэктомии. Патент на изобретение № 000 РФ. (16 стр.). - Приоритет от 01.01.2001. Опубл. 27.10.2005. БИ № 30.
24. , , Котелевский формирования илеотрансверзоанастомоза. Патент на изобретение РФ № 000 РФ (13 стр.). – Приоритет 05.07.2004. Опубл. 27.03.2006. БИ № 9.
25. , , Лютов толстокишечной гастропластики после гастрэктомии. Патент на изобретение № 000 РФ (18 стр.). – Приоритет от 01.01.2001. Опубл. 27.06.2006. БИ № 18.
26. , , Уваров хирургического лечения синдрома Золлингера – Эллисона и язв кардиального отдела желудка. Патент на изобретение № 000 РФ (8 стр.). – Приоритет от 01.01.2001. Опубл. 20.12.1999 г. БИ № 35.
27. , , А, Гоголев для моделирования анастомозов и оценки их функциональных характеристик. Патент № 000 РФ (5 стр.). – Приоритет от 01.01.2001. Опубл. 20.12.2006. БИ № 35.
28. , , А, Шатов дистальной резекции желудка. Патент № 000 РФ (18 стр.). – Приоритет от 01.01.2001. Опубл. 10.01.2007. БИ № 1.
29. , , А, . Способ восстановления непрерывности одноименных отделов кишки. Патент № 000 РФ (12 стр.). – Приоритет от 01.01.2001. Опубл. 10.07.2008. БИ № 19.
30. , , А, . Способ формирования арефлюксного пищеводно-кишечного анастомоза после гастрэктомии. Патент № 000 РФ (16 стр.). – Приоритет от 01.01.2001. Опубл. 27.06.2008. БИ № 18.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 |