Бензины с высоким октановым числом (92 и выше) содержат 25-35% алкенов и 30-40% ароматических углеводородов.
Бензины каталитического крекинга и каталитического риформинга отличаются по своим детонационным свойствам. Часто бензины производятся из смеси компонентов каталитического крекинга и риформинга.
Для повышения октанового числа бензинов применяется тетраэтилсвинец (антидетонатор), но в настоящее время он запрещен во всех развитых странах, и недалеко то время, когда и в России не будет производства этилированных бензинов. Известны и другие антидетонаторы (марганцевый антидетьнатор, метилтретбутиловый эфир МТБЭ или его смесь с трет-бутанолом, ароматические амины). Детонационную стойкость повышают также некоторые эфиры, спирты, металлорганические соединения.
По ГОСТу 2084-77 в России производится несколько марок автомобильных бензинов: А-72, А-76 неэтилированный и этилированный, АИ-91, А-92 неэтилированный и этилированный, АИ-95 и АИ-98. Каждая марка
Дизельное топливо
Дизельное топливо представляет собой смесь углеводородов с температурой начала и конца выкипания 180 и 360°С соответственно. Это топливо применяется в дизельных двигателях внутреннего сгорания, в которых оно загорается путем самовоспламенения при сжатии топливовоздушной смеси. В отличие от бензиновых двигателей, в дизельных отсутствует система зажигания. Поэтому, в противоположность бензинам, дизельное топливо должно легко самовоспламеняться. Это свойство характеризуется цетановым числом, которое связано с периодом задержки и температурой самовоспламенения. Чем они меньше, тем выше цетановое число. Происходит этот термин от названия углеводорода цетан - С16Н34, который имеет цетановое число 100. Высокой способностью к самовоспламенению обладают линейные углеводороды с большим числом групп СН2, а также ароматические и циклические углеводороды с длинными боковыми парафиновыми цепями.
Для получения дизельного топлива достаточно перегонки нефти.
Содержание серы по ГОСТ 305-82 не должно превышать 0,2%. По своим свойствам дизельное топливо делится на летнее, зимнее и арктическое. Учитываются такие характеристики, как вязкость, температура застывания и помутнения. В летнем виде топлива содержится много парафиновых углеводородов, которые уже при -5°С могут выделиться в твердом виде и вызвать засорение топливной системы. Начало выделения парафиновых углеводородов называется температурой помутнения. Для летнего топлива она равна -5°С, для зимнего -25°С, а для арктического не нормируется. Температура застывания для летнего равна -10°С, для зимнего -35°С, а для арктического -55°С.
Для снижения выбросов дыма с дизельное топливо добавляют антидымные присадки, которые снижают не только дымность, но и токсичность отработавших газов на 30-50%.
Керосин
Керосин представляет собой смесь углеводородов, преимущественно С9 – С16. Они выкипают в пределах °С. Кроме углеводородов керосин содержит сернистые, азотистые и кислородные соединения. Содержит в основном алифатические углеводороды (20-60% в зависимости от способа переработки нефти), нафтеновые (20-50%), бициклические ароматические (5-25%) и ненасыщенные (до 2%). Получают керосин перегонкой нефти, а при необходимости используют гидрирование и очистку.
В настоящее время керосин применяют как реактивное топливо (авиационный керосин). В двигателях летательных аппаратов он одновременно выполняет роль смазки. Керосин также является компонентом ракетного топлива. Окислителем является жидкий кислород или азотная кислота. Технический керосин применяется в промышленности при обжиге стеклянных и фарфоровых изделий, для резки металлов. В бытовых целях в качестве топлива осветительный керосин потерял свое значение.
Керосин также является ценным химическим сырьем для получения этилена, пропилена и ароматических углеводородов, а также растворителем в лакокрасочной промышленности.
Мазут
Мазут широко применяется для отопления паровых котлов и промышленных печей, в судовых двигателях, в газовых турбинах, в мартеновских печах. Он отличается повышенным содержанием серы (до 3,2%) и асфальтенов. Известно около 10 марок мазута (флотский, топочный, крекинг-мазут и др.), каждый из которых имеет свои особенности состава и свойств.
Газообразное топливо
Природный газ
Любопытно, что двигатель, работающий на газе, был изобретен раньше бензинового, и запатентован в тридцатые годы 19 столетия. В то время бензин еще не был известен. Первый двигатель на бензине создан Даймлером спустя почти 50 лет. Тем не менее, пока наибольшее применение на автомобильном транспорте имеет жидкое топливо.
Природный газ является важнейшим видом топлива, имеющим огромные преимущества перед жидким, и тем более перед твердым топливом:
· при сгорании он не образует золы, дыма и сажи;
· легко добывается и транспортируется;
· себестоимость добычи значительно ниже, чему других видов топлива;
· производительность труда при добыче газа примерно в 5 раз выше, чем при добыче нефти, и в 30 раз выше, чем при добыче угля;
· практически не содержит балласта;
· не требует сложной переработки и подготовки;
· при необходимости легко очищается от примесей сернистых соединений;
· имеет высокую теплоту сгорания;
· не содержит серы;
· процесс горения легко регулируется;
· установки для сжигания природного газа имеют простое устройство и высокий КПД;
· использование природного газа позволяет значительно интенсифицировать работу топок, печей и котлов и соответственно снизить стоимость оборудования и уменьшить его габариты;
· природный газ имеет высокую жаропроизводительность, что позволяет эффективно применять его в качестве технологического и энергетического топлива;
· достаточно просто резервируется в подземных газохранилищах.
· Кроме этого, природный газ является ценным сырьем для производства целого ряда важных продуктов, таких как сажи, водорода, метанола и других спиртов, формальдегида, ацетилена и многих других.
В некоторых странах, в том числе США, природный газ является одним из основных видов топлива. Начиная с начала прошлого века, когда доля газового топлива в общем балансе достигала менее 1%, его роль постоянно возрастает.
Мировые разведанные запасы превышают 140 трлн м3. Только в России имеется несколько сотен месторождений природного газа, и геологические запасы оцениваются в 100 трлн т. Наиболее крупные запасы сосредоточены в Тюменской области. Встречаются месторождения и в Сибири, и в европейской части России.
Природный газ большинства месторождений не содержит сернистых соединений, но в некоторых месторождениях может содержаться до 5% сероводорода.
Большинство добываемого газа содержит в качестве балласта азот и углекислый газ (до 5% каждого, но обычно меньше).
Углеводородный состав природного газа зависит от того, на какой глубине расположено газовое месторождение. При глубине метров содержание метана может достигать 99%, этана 0,5%, а содержание более тяжелых алканов составляет доли процента. Такие газы называют сухими природными газами. На такие газы приходится более половины всего добываемого природного газа.
Газы, добываемые с больших глубин, также в основном состоят из метана, однако они содержат значительно большее количество его гомологов (от этана до гексана) и даже более тяжелых алканов. Пропан, бутан, пентан, гексан и более тяжелые жидкие углеводороды отделяются от метана в виде конденсата. Содержание газового конденсата может составлять до 20% от объема природного газа с больших глубин. Из полученного конденсата вырабатывают сжиженные газы (пропан и бутан), и выделяют другие углеводороды. Месторождения такого типа называют газоконденсатными. После отделения конденсата природный газ несколько отличается от сухих природных газов более высоким содержанием гомологов метана и соответственно несколько более высокой теплотой сгорания.
Применение природного газа на автомобильном транспорте не представляет большого интереса. Он может быть использован в сжатом виде (до 200-250 атм), но его концентрация в сжатом состоянии примерно на порядок меньше, чем концентрация жидкого топлива (бензина или сжиженного газа). Поэтому для заправки природным газом, которой хватило бы на то же расстояние, что и при заправке бензином, требуется в несколько раз больше (по объему) сжатого природного газа, чем бензина. При этом сжатый газ должен храниться в толстостенных тяжелых баллонах, что существенно увеличивает вес автомобиля. Более перспективным для этих целей является сжиженный газ.
Попутный нефтяной газ
Как и природный газ, попутный нефтяной газ в основном состоит из метана и его гомологов. Однако он содержит значительно больше этана, пропана, бутана и пентана. Поэтому имеет значительно более высокую теплоту сгорания, чем природный газ. Попутный нефтяной газ содержит также азот, небольшое количество углекислого газа, а из месторождений с сернистой нефтью газ содержит и сероводород.
В настоящее время из-за нерентабельности добычи большая часть нефтяного газа сжигается непосредственно на месторождениях нефти. В России ежегодно добывается более 25 млрд м3 нефтяного газа. По некоторым данным, до 6 млрд м3 его сжигается в факелах. Затраты на его добычу в несколько раз выше, чем затраты на добычу природного газа. Поэтому из-за его низкой закупочной цены в настоящее время его производство убыточно. Например, убытки только компании "Лукойл" в Западной Сибири в 2000 г составили более 400 млн. рублей. Тем не менее, более 80% добываемого попутного нефтяного газа утилизируется на разные нужды. Остальной газ сжигается на месторождениях.
ГЛАВА 6
ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ
Из более чем 200 загрязнителей воздуха, на которые установлены нормы предельно допустимых концентраций (ПДК), следует выделить пять основных, связанных с горением топлива:
1. Твердые частицы
2. Оксиды серы SO2
3. Оксиды азота NO, NO2
4. Оксид углерода СО
5. Оксид углерода СО2
6. Углеводороды
Эти вещества определяют до 90-98% валовых выбросов вредных веществ в крупных городах и промышленных регионах. Для большинства регионов характерно следующее весовое соотношение этих веществ в атмосферу: оксид углерода около 50%, оксиды серы около 20%, твердые частицы 16-20%, оксиды азота 6-8% и углеводороды 2-5%.
К очень опасным веществам следует отнести также и бенз(а)пирен, который в выбрасывается в очень незначительном количестве по сравнению с перечисленными веществами, но является крайне токсичным веществом.
6.1. Токсическое воздействие загрязняющих веществ
Оксид углерода. Он воздействует на нервную и сердечно-сосудистую системы, вызывает удушье (соединяется с гемоглобином крови, который становится неспособным переносить кислород к тканям). Оксид углерода не имеет запаха, и это делает его особенно опасным. Первичные симптомы (боли в голове) возникают при концентрациях 200-220 мг/м3 при воздействии в течение несколько часов. При больших концентрациях СО появляется ощущение пульса в висках, головокружение.
Недавнее открытие ученых Великобритании подтвердило известный высказывания Парацельса, смысл которого - "лекарство от яда отличается только дозировкой" (имеется в виду одно и тоже вещество). Установлено, что присутствие небольших количеств оксида углерода в растворенном состоянии поддерживает жизнь органов и снижает риск их отторжения. Разработана методика лечения сердечных приступов и уменьшения риска отторжения органов после операций по трансплантации с помощью оксида углерода. В присутствии этого вещества быстрее восстанавливаются органы, пострадавшие от длительного отсутствия кислорода, например после сердечных приступов.
Оксиды азота NO и NO2. Не имеют цвета и запаха. Очень ядовиты, действуют раздражающе на органы дыхания. При высоких концентрациях вызывают кашель, рвоту, головную боль. Обостряют астму, легочные и сердечные заболевания. Усиливают действие СО. Ослабляют иммунитет организма ко многим заболеваниям.
В крупных городах выбросы оксидов азота от автомобильного транспорта совместно с углеводородами образуют смог – фотохимический туман.,
Снижают урожайность в сельском хозяйстве, уничтожают леса. Разрушают ряд материалов самостоятельно, а также в виде кислых дождей.
Оксиды серы. Прежде всего, выбрасывается диоксид серы SO2 (сернистый ангидрид). Это бесцветный газ с резким запахом; уже в малых концентрациях (20-30мг/м3) создает неприятные ощущения во рту и раздражает слизистые оболочки глаз и дыхательные пути. Порог запаха составляет 3-6 мг/м3. Вызывает заболевания дыхательных путей, легочные и сердечные заболевания, обострение астмы.
В растительном мире к SO2 наиболее чувствительны хвойные и лиственные леса, так как этот оксид накапливается в хвое и листве. При содержании в воздухе от 0,23 до 0,32 мг/м3 SO2 происходит усыхание сосны за 2-3 года в результате нарушения фотосинтеза и дыхания. Аналогичные изменения лиственных деревьев происходят при концентрации SO2 около 0,5-1,0 мг/м3.
Сернистый ангидрид вызывает разрушение металлов и некоторых материалов, выпадая на землю в виде кислых дождей.
Углеводороды. Представляют собой несгоревшие компоненты топлива. Особенно большие выбросы наблюдаются на автомобильном транспорте при неправильной регулировке двигателей. Вызывают тошноту, сонливость, головные боли, некоторые из них - ароматические - канцерогенны.
Бенз(а)пирен. Очень сильный канцероген – вещество, вызывающее раковые заболевания. Является мутагеном, вызывающим генетические мутации организмов при развитии плода. Оказывает также тератогенное воздействие (рождение уродов). Обладает способность накапливаться (аккумулироваться) в организме.
Твердые частицы. Представляют собой высокодисперсные частички пыли, золы и сажи, выделяющиеся в аэрозольном состоянии в атмосферу. Вызывают раздражение верхних дыхательных путей, обострение астматических, легочных и сердечно-сосудистых заболеваний.
Снижают солнечное освещение, стимулируют образование смога в крупных городах. Особенно опасна сажа, так как она сорбирует бенз(а)пирен и становится канцерогенной.
6.2. Предельно допустимые концентрации (ПДК) примесей
В таблице 8 приведены значения ПДК для наиболее вредных примесей в атмосфере. Кроме величин ПДК, для них используется т. н. класс опасности вещества. Чем меньше значение класса опасности, тем более вредным для организма является данное вещество.
Т а б л и ц а 8
ПДК некоторых вредных примесей в атмосфере на территории России
Вещество | Класс опасности | ПДК, мг/м3 | |
Максимальная разовая | Среднесуточная | ||
СО | 4 | 3,0 | 1,0 |
SO2 | 3 | 0.5 | 0.05 |
Сажа | 3 | 0,15 | 0,05 |
NO и NO2 | 2 | 0.085 | 0.085 |
Бен(а)пирен | 1 | 0,1мкг/100м3 |
Следует отметить, что топливо представляет собой опасность для окружающей среды и человека не только вследствие сжигания и образования вредных веществ. Вредное воздействие начинается уже на стадии его добычи и транспортировки.
Твердые частицы
Твердые частицы делятся на пыль, дым (золу) и сажу.
Пыль представляет собой само горючее вещество или другое, не являющееся топливом (например, цемент).
Дым образуется при сжигании топлива и представляет собой золу. Зола – это несгоревшие минеральные (неорганические) примеси топлива. Зола образуется только от сжигания твердого топлива, и ее выбросы зависят от содержания балласта в топливе. Размеры частиц в дыме значительно меньше, чем в пыли и могут достигать величин от 5 мкм до менее чем 0,1 мкм. Частицы таких размеров образуют довольно устойчивые к оседанию аэрозоли, распространяющиеся на очень большие расстояния.
Сажа является продуктом неполного сгорания углеводородного топлива и представляет собой углерод в высокодисперсном состоянии.
Основными источниками выбросов твердых частиц являются электростанции, промышленные и отопительные котельные, металлургические и цементные заводы, рудообогатительные и углеобогатительные предприятия.
Природными источниками выбросов твердых частиц являются вулканические извержения, пылевые бури, лесные пожары, испарения морской соли.
Около 60% всех аэрозолей при сжигания угля составляют твердые частицы, в основном зола и пыль. В меньших количествах образуется сажа и канцерогенные вещества. Выброс золы зависит от содержания минеральной части в топливе, конструкции топочного устройства и эффективности системы улавливания твердых частиц.
Основным видом твердых частиц при сжигании жидкого топлива является сажа. Ее содержание в выбросах зависит от конструкции и регулировки топочного устройства или двигателя, а также от коэффициента избытка воздуха. Последний представляет собой отношение количества воздуха, подаваемого на сгорание топлива, к его стехиометрическому количеству. Автомобильный транспорт – основной источник загрязнения твердыми частицами в крупных городах. Крупные предприятия, перечисленные выше как основные загрязнители, обычно выведены за пределы жилых зон. В городской зоне часто расположены крупные котельные и ТЭЦ, которые также являются основными источниками загрязнения городов.
Выбросы сажи при сжигании газового топлива на несколько порядков ниже, чем при сжигании жидкого топлива.
6.3. Кислотные дожди
Как уже отмечалось выше в характеристике вредного воздействия оксидов серы, они вызывают легочные и сердечные заболевания, а также оказывают угнетающее влияние на растительность. Но не менее вредное влияние оказывают т. н. кислые дожди. К ним относятся атмосферные осадки (дождь, снег), которые имеют повышенную кислотность из-за растворенных в них кислот. Прежде всего, это H2SO4, HNO2, HNO3 и в меньшей степени H2SO3 и HCl. В северной Америке на долю серной кислоты приходится примерно 65%, на долю соляной кислоты 5% и на долю азотной и азотистой кислот приходится примерно поровну остальная часть кислых дождей.
Кислоты образуются при взаимодействии оксидов серы и азота с атмосферной влагой. Обычно атмосферные незагрязненные осадки имеют рН=5,65 (слабокислая среда из-за растворенного диоксида углерода). На значительных территориях США, Канады и Западе Европы среднегодовые значения рН колеблются в районе 4,0-4,5.
От выпадения кислотных дождей страдает растительность, особенно хвойные. Происходит дефолиация (сброс) хвои и листвы. Попадая в водоемы, кислые дожди вызывают гибель рыбы, моллюсков, бактерий, водорослей.
Кислотные выпадения негативно воздействуют на все континентальные экосистемы. Особенно сильные изменения произошли в пресноводных водоемах некоторых регионов Европы и Америки. В некоторых регионах США есть сотни озер, в которых из-за кислых дождей погибла вся рыба. Есть такие районы в Норвегии и в Швеции. Например, в Норвегии до конца 1940-х гг. практически не было озер с рН воды менее 5, но к 1972 г. такие значения рН имели уже более чем 25% озер, а еще через 8 лет их доля превысила 30%. В Швеции в начале 1980 гг. величина рН менее 5,0 регистрировалась в 5000 крупных озер.
В Северной Европе область выпадения сильнокислых дождей охватывает практически все прибрежные районы Северного и Балтийского морей – территорию Нидерландов и Дании, север Германии и Польши, южные районы Норвегии и Швеции.
Кислотные дожди – проблема интернациональная, так как в отличие от свободного SO2 они могут перемещаться на большие расстояния от места образования SO2. Из-за трансграничного переноса из Западной и Центральной Европы кислые дожди попадали на западные границы стран бывшего СССР.
Кислотные дожди оказывают неблагоприятное воздействие на почву. Происходит нарушение естественного для природы соотношения содержания элементов в обменной и водорастворимой форме. Некоторые элементы, такие как алюминий, марганец, железо и цинк в кислой среде больше переходят в водорастворимое состояние, а некоторые из-за связывания серной кислотой, наоборот, переходят в малорастворимую форму, и оказываются менее доступными, как, например, кальций, который связывается в CaSO4. В Скандинавии из-за очень тонкого почвенного слоя почва не способна обеспечить высокую сопротивляемость закислению от кислых дождей.
Увеличение кислотности почвы снижает количество бактериальных клеток и нарушает отлаженный природой конвейер разложения мертвого органического материала и восстановление естественного плодородия почв.

По расчетам, общие потери продукции растениеводства
в Западной и Центральной Европе в годовом исчислении составляют около 1,1 млн. т., а потери древесины – около 600 тыс. м3. Причем около половины этих потерь приходятся на области с умеренным загрязнением SO2 - не выше 10 мкг/м3.
Кроме того, кислые дожди разрушают сооружения из мрамора и бетона, памятники, скульптуры и металлоконструкции. Например, в промышленных районах сталь корродирует в 10 раз, а алюминий в 100 раз быстрее, чем в сельской местности.
6.4. Канцерогенные вещества
Из органических веществ канцерогенной активностью обладают некоторые ароматические и, особенно, полициклические углеводороды, т. е. состоящие из нескольких бензольных колец. Из них наиболее опасным является бенз(а)пирен (синонимы – бензпирен, 3,4-бензпирен). Он может образовываться при пиролизе угля и углеводородного топлива при температурах свыше 600°С. Бенз(а)пирен присутствует в саже, в дымовых газах, выхлопах автомобилей, является продуктом крекинга нефтяных фракций и получения кокса. Он активнее всего образуется при сгорании топлива при недостатке воздуха. Большая концентрация бензпирена может образовываться в установках по сжиганию органических бытовых и производственных отходов, особенно при их неполном сжигании. Бензпирен содержится также в табачном дыме.
Бензпирен в настоящее время является одним из наиболее распространенных и опасных в канцерогенном отношении соединений. Только в США ежегодно в атмосферу выпускается до 1300 т. бензпирена. Между тем, достаточно лишь 3-5 мг этого вещества, чтобы вызвать рак легкого или кожи человека. Особенностью воздействия бензпирена на организм является длительный период (до 10 лет) между воздействием его на организм и выявлением опухолевого процесса.
Попадая в атмосферу, бенз(а)пирен сорбируется на поверхности твердых частиц продуктов сгорания топлива, прежде всего на частичках сажи размером менее 200 мкм, которая также является продуктом неполного сгорания. Поэтому признаком повышенной концентрации бенз(а)пирена в выхлопах автомобилей или дымовых газах котлов является образование сажи. Частички такого размера способны легко проникать в дыхательные пути человека.
Формула бенз(а)пирена С20Н12. Его структурная формула:
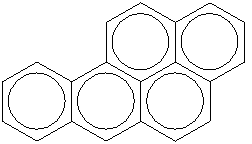
Рис. 6. Структурная формула бен(а)пирена
По некоторым данным, его образование протекает с участием ацетилена, который образуется при крекинге или пиролизе углеводородов. Сначала ацетилен димеризуется в дивинил, а затем последний полимеризуется до бенз(а)пирена:
2НС≡СН + Н2 = Н2С=СН—СН=СН2 (69)
5Н2С=СН—СН=СН2 = С20Н12 + 9Н2 (70)
Возможен вариант непосредственной полимеризации ацетилена в бенз(а)пирен, минуя стадию образования дивинила:
10НС≡СН = С20Н12 + 4Н2 (71)
Как сообщалось выше, ПДК бенз(а)пирена очень низкая. Факторы, влияющие на его образование в топках котлов при сжигании газа или жидкого топлива, вытекают как из их конструктивных особенностей, так и из режимных параметров:
· Содержание кислорода в топочной камере;
· Нагрузка котла;
· Доля рециркуляции дымовых газов в топку;
· Организация ступенчатого сжигания топлива;
· Впрыск пара или воды в топочный объем.
Снижение содержания кислорода в топочной камере приводит к увеличению концентрации бенз(а)пирена в дымовых газах. Поэтому важным способом снижения выбросов бенз(а)пирена является поддержание правильного значения коэффициента избытка воздуха, соответствующего конструкции данной установки.
Нагрузка котла имеет существенное влияние на содержание бенз(а)пирена. С ее уменьшением концентрация бенз(а)пирена возрастает. Это объясняется главным образом снижением температуры в топочной камере – увеличением протяженности доли пиролиза и выгорания топлива. Например, при 50%-й нагрузке котла выбросы бенз(а)пирена оказываются в 1,2 раза больше, чем при полной нагрузке.
Ввод влаги в топку уменьшает концентрацию бенз(а)пирена во всех случаях в зависимости от способа ввода в топку пара или воды. Наиболее эффективным является вод влаги в факел.
Существенного снижения выброса бенз(а)пирена можно путем совершенствования горелочных устройств и установки более современных форсунок.
Особенного внимания заслуживают методы отряхивания поверхности нагрева мазутных котлов от отложений сажи и золы, в момент которого в атмосферу поступают залповые выбросы бенз(а)пирена. Для предотвращения этих выбросов должны использоваться специальные системы очистки поверхностей нагрева.
Содержание бенз(а)пирена в дымовых газах котлов в значительной степени зависит от вида сжигаемого топлива. Наименьшее количество образуется при сжигании газа. Например, при сжигании природного газа содержание бенз(а)пирена в дымовых газах котлов достигает 1,2-5мкг/100м3. Паровой котел электростанции производительностью 1000 т. пара в час выбрасывает около 0,05г/час бенз(а)пирена.
При сжигании мазута эта величина в 5– 10 раз выше, а угольной пыли – в 20-50 раз выше.
Особенно высокие концентрации бенз(а)пирена наблюдаются в районе размещения металлургических, коксохимических и нефтеперерабатывающих предприятий. При очень плохой организации горения концентрация бенз(а)пирена может достигать колоссальных величин. Например, при отоплении прокатных печей коксовым газом были отмечены концентрации бенз(а)пирена в дымовых газах до 880 мкг/м3!!! Обычная концентрация бенз(а)пирена в коксохимических и агломерационных производствах составляет 80-220мкг/100м3.
Даже на расстоянии около 1000 м. концентрация бенз(а)пирена может доходить до очень высоких величин: до 2мкг/100м3 для коксохимических предприятий, до 0,2мкг/100м3 для нефтеперерабатывающих заводов и до 5мкг/100м3 для металлургических предприятий. Это объясняет, почему в районах сосредоточения таких производств очень высока заболеваемость раком легкого, а также другими легочными болезнями.
Очень высокими могут быть концентрации бенз(а)пирена при слоевом сжигании угля в мелких котельных с неподвижной колосниковой решеткой. Из-за низкого качества горения эти концентрации могут в тысячи раз превышать концентрации бенз(а)пирена в дымовых газах современных крупных котельных и ТЭЦ, сжигающих уголь в пылевидном состоянии. Например, в США, где очень распространены индивидуальные котельные в частных домах, более 80% загрязнения атмосферы бенз(а)пиреном приходится на них, более 4% - на автотранспорт, около 4% - на нефтехимию
, и около 0,1% - на ТЭЦ.
В автомобильных двигателях увеличение концентрации бенз(а)пирена в выхлопах связано с ухудшением качества горения и обычно сопровождается увеличением концентрации сажи и СО. Выход этих веществ одновременно можно снизить путем регулировки карбюраторов и других топливных систем, а также применением нейтрализаторов.
6.5. Образование оксидов азота при сжигании топлива
В ряду основных загрязнителей атмосферы оксиды азота занимают особое место из-за высокой токсичности. В валовом выбросе всех токсичных веществ на них приходится 6-8%, но по токсичности их доля оценивается в ~35%. Даже концентрация 150-200 мг/м3 при кратковременном вдыхании способна вызвать отек легких. Оксиды азота, как и СО, способны соединяться с гемоглобином крови. Они могут вызывать изменение состава крови. В сочетании с оксидами серы их действие усиливается.
Важнейшими оксидами азота являются монооксид NO и диоксид NO2, которые объединяются общей формулой NOx. Остальные известные оксиды азота не являются биологически значимыми.
Причиной образования оксидов азота является окисление азота воздуха в факеле. Образование NO происходит непосредственно в зоне горения, и наиболее интенсивно идет в зоне самых высоких температур факела.
Реакция образования NO является цепной радикальной реакцией. Механизм включает в себя реакции атомарных кислорода и азота:
Зарождение цепи:
O2 + M* = O: + O: + M + 494 кДж/моль (72)
Продолжение цепи:
O: + N2 = NO + N: + 314 кДж/моль (73)
N: + O2 = NO + O: – 134 кДж/моль (74)
Обрыв цепи:
O: + O: + M* = O2 + M – 494 кДж/моль (75)
Уравнение брутто-процесса выглядит так:
N2 + O2 = 2 NO + 180 кДж/моль (76)
Эндотермическая реакция (73) является лимитирующей.
Оксиды азота, образующиеся в результате окисления азота воздуха, называются термическими оксидами.
У реакции окисления азота очень высокая энергия активации, поэтому, в соответствии с законами термодинамики, равновесная концентрация монооксида азота сильно зависит от температуры. Ниже приведена температурная зависимость равновесной концентрации NO:
Т а б л и ц а 9.
Равновесная концентрация NO в воздухе в зависимости от температуры
Температура, К | 300 | 700 | 800 | 1800 | 2500 |
Равновесная концентрация NO, мг/м3 | 0,00127 | 0,38 | 2,54 | 4700 | 31700 |
Существует расчетное уравнение для определения равновесной концентрации NO в воздухе:
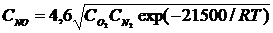 (77)
(77)
Обычно в топочных камерах температура достигает К. Поэтому синтез монооксида азота идет весьма активно и равновесная концентрация NO может достигать больших величин от 0,2 до 1,5 г/м3 (т. е. в тысячи и десятки тысяч больше, чем ПДК).
Однако на достижимость равновесной концентрации влияет скорость и время реакции. Чем больше время нахождения смеси в зоне высоких температур, тем более достижима равновесная концентрация NO. Для топок применяется понятие "темп охлаждения", которое характеризует скорость охлаждения топочных газов. Для больших топок характерен более медленный темп охлаждения, чем для малых, поэтому в них может быть более высокие концентрации NO. Концентрация NO в больших топках может достигать величин 0,8-1,8 г/м3, а в малых 0,1-0,2 г/м3.
В автомобильных двигателях время нахождения смеси в горячей зоне невелико, поэтому концентрация монооксида азота в выхлопе далека от равновесной.
Диоксид азота может образовываться непосредственно в дымовых газах по реакции:
2NO + O2 = 2NO2 (80)
Однако при высоких температурах, которые наблюдаются в факеле, он неустойчив и разлагается на атомарный кислород и монооксид азота.
Основным процессом образования NO2 считается его окисление атмосферным озоном:
NO + O3 = NO2 + O2 (81)
Озон всегда присутствует в атмосфере в виде т. н. фоновых концентраций.
Эта реакция имеет очень высокую константу скорости. Она приводит к быстрому превращению монооксида в диоксид азота и расходованию атмосферного озона, играющего важную роль в поглощении солнечного ультрафиолетового излучения (УФ излучения).
Под действием УФ излучения молекула диоксида азота разлагается на монооксид и атомарный кислород, и снова реагирует с озоном. Одна молекула NO путем такой цепочки превращений NO-NO2-NO-NO2 и т. д. способна уничтожить большое количество молекул озона. По некоторым расчетам, при выбросе около 50 млн. т/год оксида азота потеря озона в приземном слое атмосферы составляет 60-70 млн. т/год.
Благодаря тому, что молекулы диоксида азота и образуются и распадаются, в дневное время устанавливается равновесие между этими двумя реакциями.
В ночное же время, когда нет УФ излучения, происходит накопление диоксида азота.
Другой реакцией, приводящей к образованию диоксида азота, является реакция монооксида с пероксидным радикалом:
NO + HOO. = NO2 + .OH (82)
Эта реакция имеет высокую константу скорости. Пероксидные радикалы являются промежуточными активными частицами при горении топлива.
Эта реакция наиболее эффективно протекает в зоне факела, в которой продукты сгорания достаточно охлаждены (менее 980К). При более высоких температурах диоксид успевает разложиться. Поэтому особенно высокая концентрация диоксида азота в дымовых газах образуется тогда, когда дымовые газы резко охлаждаются (например, в малых отопительных котлах). В остальных случаях концентрация диоксида азота мала и в основном он образуется позднее взаимодействием с атмосферным озоном.
Монооксид азота способен окисляться по реакции (82) и в атмосфере. Под действием УФ излучения Солнца молекулы воды распадаются на радикалы Н. и HO. .
Гидроксил-радикалы взаимодействуют с углеводородами, которые всегда есть в атмосфере, и в результате цепочки превращений образуют пероксид-радикалы. Кроме них, происходит образование органических пероксид-радикалов ROO. Они также вызывают окисление монооксида азота до диоксида, отдавая свой атом кислорода.
Образующийся NO2 на поверхности твердых частиц атмосферы превращается в азотную кислоту по трем направлениям:
2 NO2 + Н2О = HNO3 + HNO2 (83)
4 NO2 + 2H2O + O2 = 4HNO3 (84)
NO2 + HO. = HNO3 (85)
Эти реакции являются окислительно-восстановительными. Образующиеся азотная и азотистая кислоты выпадают на землю в виде кислотных дождей.
В ночное время с прекращением фотохимического генерирования радикалов азотная кислота образуется в результате следующей цепочки превращений:
NO2 + O3 = NO3 + O2 (86)
NO2 + NO3 = N2O5 (87)
N2O5 + Н2О = 2HNO3 (88)
Литература
1. Горение. Физические и химические аспекты, моделирование, эксперименты, образование загрязняющих веществ /Пер. с англ. . Под ред. . – М.: ФИЗМАТЛИТ, 2006. – 352 с.
2. , , и др. Основы практической теории горения. Л. Энергоатомиздат.19с.
3. Теория горения и взрыва (сборник работ). Под ред. . 19с.
4. Химия горения. Под. Ред. У. Гарднера. М. Мир.19с.
5. Хитрин горения и взрыва. М. Изд. МГУ.19с.
6. , Частухин и теория горения. М. Энергоатомиздат. 19с.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 |



