Скорость выгорания жидкостей
С температурой кипения связана такая характеристика жидкостей, как скорость выгорания. Под этим термином понимается линейная скорость уменьшения высоты слоя жидкости при ее горении со свободной поверхности в единицу времени. Скорость выгорания зависит от температуры, диаметра резервуара, уровня жидкости в резервуаре, скорости ветра и т. п.
Для резервуаров малого диаметра скорость выгорания сравнительно велика. При увеличении диаметра она сначала уменьшается, потом снова возрастает, пока не достигнет постоянной величины. Такая сложная зависимость связана с влиянием разных факторов на скорость выгорания. В резервуарах малого диаметра горячие стенки нагревают жидкость и увеличивают скорость испарения и горения. При увеличении диаметра влияние нагретых стенок снижается, так как стенки контактируют с уменьшающейся частью жидкости. С другой стороны, при увеличении диаметра наблюдается переход горения от ламинарного к турбулентному. При этом уменьшается полнота сгорания, увеличивается количество образующейся сажи. Возрастание степени черноты пламени способствует увеличению теплового потока от пламени. Поверхность жидкости нагревается сильнее, и происходит увеличение скорости испарения и горения.
В резервуарах диаметром более 2 метров скорость выгорания жидкостей практически одинакова (горение со свободной поверхности).
Сильный ветер способствует более эффективному смешиванию паров с воздухом, повышению температуры пламени и увеличению нагрева поверхности жидкости. В результате этого скорость выгорания увеличивается.
По мере снижения уровня жидкости в резервуаре увеличивается расстояние от пламени до поверхности жидкости, поэтому уменьшается приток тепла к жидкости. Скорость выгорания постепенно уменьшается, и при некотором критическом расстоянии поверхности жидкости от борта резервуара горение может прекратиться. Это расстояние называется критической высотой. Для больших резервуаров, в которых критическая высота всегда больше высоты резервуара, самотушение не происходит. Расчеты показывают, что критическая высота резервуара диметром 23м равна 1 км, в то время как его обычная высота равна 12м.
В табл. 3 приведены значения скорости выгорания некоторых жидкостей при комнатной температуре.
Т а б л и ц а 3.
Скорость выгорания некоторых жидкостей со свободной поверхности при комнатной температуре
Жидкость | Скорость выгорания, мм/мин |
Ацетон | 1,4 |
Автомобильный бензин | 1,75 |
Бензол | 3,15 |
Керосин | 1,1 |
Метиловый спирт | 1,2 |
Диэтиловый эфир | 2,93 |
Самовоспламенение гомогенных смесей
Есть еще один способ зажигания горючей смеси. Он не требует наличия источника зажигания и называется самовоспламенением. Самовоспламенение – явление быстрого нарастания скорости горения без соприкосновения с источником зажигания. Условиями самовоспламенения могут быть резкое повышение температуры или давления, а также введение смеси в нагретый сосуд. Необходимо, чтобы при этом смесь находилась в концентрационных пределах воспламенения и была достигнута температура самовоспламенения, характерная для данной горючей смеси и конструкции конкретного устройства.
Самовоспламенение характерно и для жидких гетерогенных смесей. Отличие гомогенного от гетерогенного самовоспламенение следующее. Для гомогенного это чисто химический процесс, а для гетерогенного состоит из двух стадий – физической и химической. Например, в дизельном двигателе последовательно проходят следующие процессы – впрыск, распыление топлива на туман, испарение капель, диффузия (смешивание паров топлива с воздухом), самовоспламенение, сгорание. Последние две стадии – химические, остальные – физические. Физические стадии наиболее медленные и являются лимитирующими при работе дизельных двигателей. Отличительная особенность самовоспламенения – загорание всей смеси сразу. В этом его отличие от воспламенения. Для того, чтобы самовоспламенение произошло, требуется достижение определенной температуры – температуры самовоспламенения. Примечание: значения температуры самовоспламенения зависят от методики и для разных методик могут отличаться, иногда значительно. На нее влияет также общее давление, наличие посторонних примесей в смеси, конструктивные особенности установки для сжигания и др. В табл. 4 приведены усредненные значения температуры самовоспламенения.
Т а б л и ц а 4.
Температура самовоспламенения некоторых веществ в смеси с воздухом
Вещество | Температура самовоспламенения, °С |
Ацетон | ~500 |
Бензол | ~540 |
Бензин | ≥230 |
Керосин | ~300 |
Масло растительное | ≥350 |
Этанол | ~400 |
Ацетилен | ~335 |
Водород | ~510 |
Пропан | ~510 |
Диэтиловый эфир | 164 |
СО | ~610 |
2.3. Теория теплового воспламенения
Часто самовоспламенение газовых смесей горючего и окислителя при повышении температуры приводит к взрыву. Теория теплового воспламенения или взрыва разработана русским ученым, лауреатом Нобелевской премии, академиком .
Рассмотрим тепловое воспламенение на примере элементарной бимолекулярной реакции:
А + В ® продукты реакции; DН [кДж]
Скорость реакции
u = k×CАСВ = k0×![]() ×CАСВ (1)
×CАСВ (1)
Скорость тепловыделения
Q1 = DН×u = DН× k0×![]() ×CАСВ (2)
×CАСВ (2)
Воспользуемся уравнением идеального газа рV = nRT и мольными долями реагентов NА + NВ = 1 для преобразования уравнения (2).
pi V = ni RT или pi = RT или pi = СiRT, отсюда Сi = ![]() (3)
(3)
Парциальные давления реагентов рА и рВ выразим через общее давление системы р = рА + рВ:
рА = рNА (4)
рВ = р (1 – NА) (5)
Выразим CА и СВ через общее давление и мольные доли реагентов:
CА = ![]() , CB =
, CB = 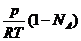
и подставим в уравнение (2):
Q1 = ![]() NA×(1 – NA)р2
NA×(1 – NA)р2![]() (6)
(6)
Обозначим выражение ![]() = D. По сравнению экспоненциальным выражением
= D. По сравнению экспоненциальным выражением ![]() значение D можно принять за постоянную величину, т. к. при изменении температуры D изменяется незначительно по сравнению с
значение D можно принять за постоянную величину, т. к. при изменении температуры D изменяется незначительно по сравнению с ![]() . Тепловыделение, обусловленное химической реакцией примет вид:
. Тепловыделение, обусловленное химической реакцией примет вид:
Q1 = D NA×(1 – NA)р2![]() (7)
(7)
Теплоотдача реактора, в котором происходит химическое превращение, определяется уравнением:
Q2 = æ×(Т – Т0) (8),
где æ – коэффициент теплопередачи, зависящий от конфигурации реактора, площади поверхности его стенок, Т – температура газообразной реакционной смеси, Т0 – температура стенки сосуда, через которую энергия в форме теплоты Q2 передается в окружающую среду.
На рис. 2 представлены зависимости скоростей тепловыделения и теплоотдачи.
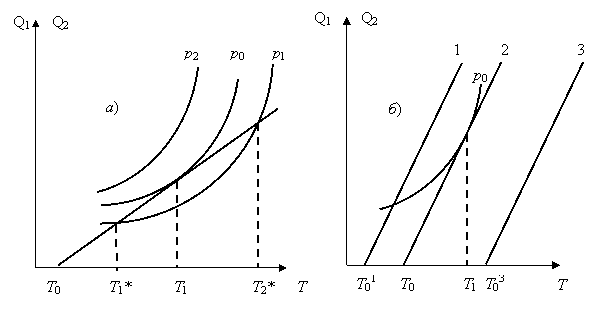

Рис. 2. Зависимость скорости тепловыделения Q1 и скорости теплоотдачи Q2 от температуры: а) при различных давлениях р1 > р0 > р2; б) при различных температурах стенки
При данной температуре стенки Т0 зависимость теплопередачи Q2 от температуры выражается прямой линией (рис. 2, а). Если эту прямую сопоставить с кривой р2, то станет очевидной невозможность стационарного процесса. Скорость тепловыделения Q1 везде выше скорости теплопередачи: Q1 > Q2.
При более низком давлении р1 и температуре стенки Т0 смесь сначала разогревается до температуры Т1*. Разогрев прекращается при достижении температуры Т1*, т. к. скорости тепловыделения и теплопередачи становятся одинаковыми Q1 = Q2 и химический процесс становится стационарным.
При давлении р0 и температуре стенки Т0 разогревание реактора происходит до температуры Т1 и прекращается. Процесс становится стационарным. Самовоспламенение возможно, если по каким-то причинам температура Т1 повысится хотя бы ненамного, тогда Q1 станет больше Q2.
На рис. 2, а показано влияние температуры стенки при заданном давлении р0. Повышение температуры стенки ведет к уменьшению скорости теплоотдачи и созданию ситуации, когда процесс приведет к тепловому взрыву.
Расчеты показывают [см. . Основы химической кинетики в газах и растворах, М.: изд. МГУ, 1971, С. 248], что для заданного давления р0 температура стенки и температура воспламенения практически совпадают:
Т1 @ Т0
Иными словами, тепловое воспламенение в своем начале может быть почти изотермическим, что объясняется сильной зависимостью скорости реакции от температуры и ведет к затруднениям при экспериментальном определении природы воспламенения.
В разнообразных случаях при давлениях выше р0 воспламенение происходит без существенной задержки (период индукции меньше одной секунды). Однако во многих случаях самовоспламенение происходит со значительным запозданием, исчисляемым секундами и минутами.
Таким образом, в зависимости от условий проведения реакции горения (температуры окружающей среды и смеси, энтальпии реакции и др. параметров системы), реакция горения может идти по разному: стационарно (редкое сочетание условий), с самоохлаждением, или со взрывом. Начиная с критической температуры окружающей среды процесс всегда приводит к самовоспламенению из-за прогрессирующего самоускорения.
Теория самовоспламенения (теплового взрыва) играет огромную роль в изучении таких процессов, как взрывы в шахтах и на производствах с органическими пылевидными продуктами, в теории двигателей внутреннего сгорания, авиационных и ракетных двигателях, и других процессах.
2.4. Основы теории цепных реакций
Многие специфические особенности реакций горения и взрыва объясняются особым – цепным механизмом этих процессов. В обычных - не цепных реакциях - взаимодействие происходит путем столкновения между реагирующими молекулами. При столкновении молекулы сдвигаются до такого расстояния, при котором электроны и атомы одной молекулы попадают в сферу действия электрических сил другой молекулы. При столкновении происходят переходы электронов от одного атома к другому и перегруппировки атомов, в результате которых образуются новые молекулы. Чтобы эти процессы произошли, требуется минимально необходимый запас энергии у сталкивающихся молекул. Далеко не каждое столкновение приводит к реакции. Обычно их доля от общего числа столкновений составляет величину от 10-15 до 10-20. Столкновения, приводящие к реакции, называются активными столкновениями, а молекулы – активными молекулами.
В некоторых реакциях, к которым относятся реакции горения и взрыва, большую роль играют различные свободных радикалов (осколков молекул) и атомов с ненасыщенной валентностью, получающихся по тем или иным причинам. Такие образования, называющиеся промежуточными активными частицами, имеют неспаренные электроны и обладают очень высокой реакционной способностью. Они стремятся любым способом присоединить к себе другие атомы или активные частицы, чтобы реализовать свои валентные возможности. Часто их реакции с обычными молекулами имеют очень низкую энергию активации, поэтому доля эффективных столкновений очень высока (близка к 1). Поэтому при первых же столкновениях с другими молекулами они вызывают протекание химических реакций между собой. Время жизни таких молекул очень мало. Если учесть, что в газе при давлении 1 атм. каждая молекула претерпевает около 1*1010 столкновений, то время жизни активных частиц составляет ~10-10 с. Ниже вы познакомитесь с механизмами некоторых цепных реакций горения, в которых реакции активных частиц имеют достаточно высокую энергию активации (десятки кДж/моль). Для них доля эффективных столкновений на несколько порядков меньше 1 и далеко не каждое столкновение заканчивается результативно. Например, при температуре 300К доля эффективных столкновений для реакций с энергией активации 5, 10, 15, 20 и 50 кДж/моль приблизительно равна соответственно 10-1, 10-2, 10-3, 10-4 и 10-9.
Особенностью взаимодействия свободных радикалов или атомов заключается в том, что при их взаимодействии с обычными молекулами всегда образуются новые активные частицы. Активные частицы не могут исчезнуть путем столкновения и взаимодействия с насыщенными частицами. Поэтому пока существует свободный радикал или атом, происходит непрерывный процесс создания новых активных частиц. Исчезнуть активные частицы могут либо путем столкновения с другой активной частицей либо со стенкой сосуда.
Цепными называются реакции, в которых появление одной активной частицы вызывает большое число превращений неактивных частиц вследствие регенерации активной частицы в каждом элементарном акте реакции.
В создании теории цепных реакций основную роль сыграл советский ученый академик Н. Н Семенов. Он показал, что цепные реакции являются весьма распространенными и играют важную роль во многих практически важных процессах органической химии, например, при горении топлива, при крекинге, полимеризации, бромировании, хлорировании, реакциях термораспада и др.
ГЛАВА 3
МЕХАНИЗМ ГОРЕНИЯ
3.1. Механизм горения водорода в кислороде
Стехиометрическое уравнение реакции записывается в виде:
2Н2 + О2 = 2Н2О.
Прямое взаимодействие молекул водорода и кислорода не происходит, и механизм процесса носит цепной характер.
Реакция зарождения цепи.
Возможны три варианта реакции зарождения цепи:
Разложение молекул водорода при столкновении с возбужденной молекулой:
Н2 + М* = Н×. + ×Н. + М (12)
Столкновение возбужденных молекул водорода и кислорода:
Н2* + О2* + 2×ОН. (13)
В газообразной смеси, как правило, содержатся пары воды:
М* + Н2О = Н×. + ×ОН. + М (14)
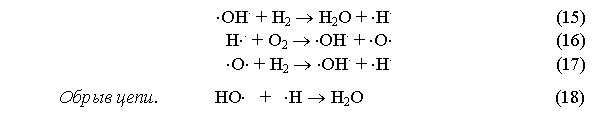
![]()
 Низкая энергия связи Н–O в молекулах Н2О по сравнению с энергиями связи Н–Н и О=О в молекулах Н2 и О2 делает реакцию (14) основной реакцией зарождения цепи.
Низкая энергия связи Н–O в молекулах Н2О по сравнению с энергиями связи Н–Н и О=О в молекулах Н2 и О2 делает реакцию (14) основной реакцией зарождения цепи.
Если сложить реакции (15) – (18) получим брутто-реакцию:
2Н2 + О2 = 2Н2О.
В реакции (16) образуется частица с двумя неспаренными электронами – бирадикал. В этой реакции одна активная частица образует две новых, поэтому реакция (16) является реакцией разветвления цепи.
Реакции (15-17) имеют разные энергии активации – соответственно 22, 71 и 41 кДж/моль. Так как наибольший энергетический барьер имеет реакция (16), то она наиболее медленная и является лимитирующей.
Благодаря разветвлению происходит утроение числа активных частиц после каждой пары реакций (16) и (17). Число активных частиц увеличивается лавинообразно. После n пар реакций (16) и (17) разветвления их число становится равным 3n. Например, всего лишь после 50 пар реакций разветвления число активных частиц становится равным ~1*1024. Это огромное число. Каждая новая активная частица начинает новую цепь. После каждой пары реакций (16) и (17) одна цепь разветвляется на три. Потому правильнее было бы говорить об увеличении количества цепей в результате разветвления, то есть о лавинообразном ускорении реакции горения.
По такой же схеме развивается ядерный взрыв – один образующийся нейтрон поглощается ядром урана и вызывает его распад с образованием двух нейтронов, и т. д. Через мгновение число нейтронов достигает колоссальных величин, и происходит взрыв.
Схематически цепная реакция горения водорода представлена на рис. 3:
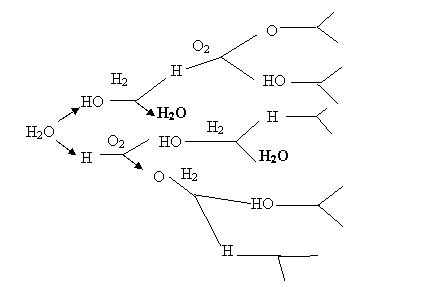

Рис. 3. Механизм горения водорода в кислороде
Пределы воспламенения. Полуостров воспламенения.
Для разветвленных цепных реакций существует зависимость способности гомогенной смеси к воспламенению от температуры и давления смеси. Эта зависимость называется полуостровом воспламенения. Типичный график зависимости выглядит так:
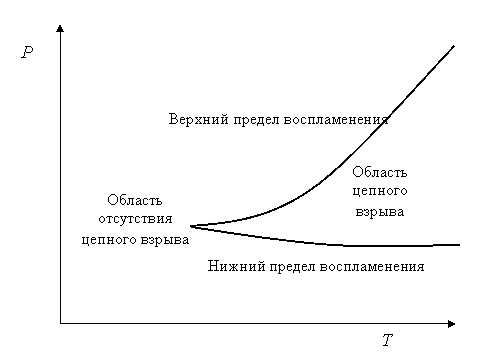

Рис. 5. Полуостров воспламенения водорода в кислороде
Верхняя и нижняя кривая образуют верхний и нижний пределы воспламенения. При условиях выше верхнего предела или ниже нижнего предела воспламенение невозможно.
Объяснение существования пределов воспламенения связано с соотношением скорости разветвления и скорости обрыва цепи. Если первая больше второй, то воспламенение произойдет. В противном случае при постоянно действующем источнике зажигания реакция переходит в стационарный режим.
Существование нижнего предела связано с тем, что при снижении давления скорость реакции разветвления уменьшается, так как она пропорциональна концентрации веществ. В то же время скорость обрыва цепи на стенках увеличивается из-за снижения концентрации молекул и числа столкновений, препятствующих достижению стенок активными частицами. Увеличивается длина свободного пробега активных частиц. Все большая доля активных частиц может достигнуть стенок сосуда. При некотором давлении скорость обрыва цепей на стенке окажется больше скорости разветвления цепей, и реакция перейдет в стационарный режим.
Существование верхнего предела связано с тем, что с ростом давления скорость обрыва цепи в объеме, которая пропорциональна квадрату давления (см. реакцию 21, в которой участвуют 2 обычных молекулы), начинает преобладать над скоростью разветвления, которая пропорциональна первой степени давления. Реакция в условиях выше верхнего предела также переходит в стационарный режим, при котором скорость обычно очень мала.
Конкретные значения величин давления и температуры отличаются для разных систем. Например, точка, в которой соединяются верхняя и нижняя кривая (мыс полуострова воспламенения), для смеси водорода и кислорода, соответствует давлению 5 мм рт. ст. и температуре 385°С, а конец верхней кривой соответствует давлению 400 мм рт. ст. и температуре 580°С.
Верхний предел значительно зависит от температуры. На него оказывает также сильное влияние природа и количество примесей, играющих роль третьей частицы при обрыве. На него мало влияет форма и размер сосуда.
Напротив, на нижний предел оказывает влияние форма сосуда, его диаметр и материал его стенок. Влияние температуры на нижний предел незначительно.
Поэтому каждому составу смеси и каждому реакционному сосуду отвечает своя область воспламенения. При постоянном общем давлении горючего и окислителя изменение их соотношения также приводит к изменению пределов воспламенения. При снижении концентрации горючего (при сохранении постоянным общего давления) весь график смещается вправо параллельно оси температуры. При добавлении в горючую смесь инертного газа пределы воспламенения также будут изменяться. Например, нижний предел будет снижаться. Смесь, которая могла находиться вне пределов воспламенения, при добавлении инертного газа может попасть внутрь полуострова и воспламениться.
3.2. Механизм горения оксида углерода (II)
Оксид углерода СО является одним из важнейших и широко применяемых в промышленности видов газообразного топлива. Он применяется в металлургии, где получается при коксовании углей. Он является основным компонентом горючей газовой смеси при газификации углей (превращении углей в газообразное топливо).
Особенностью реакции является то, что она идет очень медленно, если в смеси отсутствуют пары воды. Константа скорости горения сухого и влажного СО отличается на шесть порядков. Объясняется это тем, что молекула СО имеет очень прочную химическую связь, и не распадается при обычных условиях зажигания. Выше сообщалось, что молекула кислорода также очень прочная и не может служить источником радикалов. Поэтому процесс резко ускоряется в присутствии паров воды.
Зарождение цепи.
М* + Н2О = ОН. + Н. (24)
Продолжение цепи.
Н. + О2 = ОН. + О: (25)
ОН. + СО = СО2 + Н. (26)
Реакция (26) является основной реакцией образования конечного продукта горения оксида углерода СО2.
На первый взгляд, реакция (25) является реакцией разветвления цепи. Однако особенность механизма горения СО заключается в том, что бирадикал кислорода улавливается оксидом углерода и далее не дает никаких активных частиц:
О: + СО = СО2 (27)
Поэтому реакция горения, несмотря на наличие стадии разветвления цепи, не считается разветвленной цепной реакцией.
Обрыв цепи.
Реакции обрыва цепи идентичны описанным для горения водорода. К ним относятся реакции обрыва в объеме радикалов водорода, кислорода и ОН. . Обрыв на стенке проходит по реакциям (21) – (23).
Экспериментально полученная зависимость скорости горения СО выглядит так:
![]() (28)
(28)
Важная роль воды для реакции горения СО подтверждается тем, что ее концентрация входит в кинетическое уравнение реакции.
Энергия активации реакции равна 28,3кДж/моль.
3.3. Механизм горения метана
Метан является простейшим насыщенным углеводородом и важнейшим газообразным топливом. Брутто-процесс записывается простой реакцией:
СН4 + 2О2 = СО2 + 2Н2О (29)
Однако механизм этой реакции очень сложный. В реакции зарождения цепи важную роль играют пары воды. При их отсутствии радикалы образуются при распаде молекулы метана, а в присутствие воды – при более быстрой реакции разложения молекул воды.
Зарождение цепи.
СН4 + М* = .СН3 + Н. + М (30)
М* + Н2О = ОН. + Н. (31)
Продолжение цепи.
Н. + О2 = ОН. + О: (32)
Эта реакция является реакцией разветвления цепи.
Далее молекулы СН4 участвуют в двух параллельных реакциях, образуя метильный радикал:
СН4 + ОН. = .СН3 + Н2О (33)
СН4 + О: = .СН3 + ОН. (34)
В свою очередь, метильный радикал также участвует в двух реакциях:
.СН3 + ОН. = :СН2 + Н2О (35)
.СН3 + О2 = Н2СО + ОН. (36)
В первой из этих реакций образуется метиленовый бирадикал (карбен), а во второй – формальдегид.
Формальдегид является одним из продуктов реакций разветвления метана и других углевородов. Поэтому он присутствует в автомобильных выхлопах и приводит к загрязнению окружающей среды.
Формальдегид образуется и из карбена:
:СН2 + О2 = Н2СО + О: (37)
Формальдегид принимает участие в двух реакциях продолжения цепи:
Н2СО + О: = СО + Н2О (38)
Н2СО + ОН. = НСО. + Н2О (39)
а радикал НСО. дает еще одну реакцию разветвления:
НСО. + О2 = СО + О: + ОН. (40)
Оксид углерода реагирует по двум параллельным реакциям с образованием конечного продукта окисления углерода:
О: + СО = СО2 (41)
ОН. + СО = СО2 + Н. (42)
Таким образом, в процессе протекания реакций продолжения цепи происходит последовательная потеря углеродов атомов водорода и превращения метана по цепочке: СН4 → .СН3 → :СН2 → НСО. → СО → СО2.
Обрыв цепи.
Реакции обрыва аналогичны тем, что были рассмотрены ранее для горения водорода и СО.
Нетрудно представить, насколько усложняется механизм горения еще более сложных углеводородов, чем метан. А для бензинов, состоящих из сотен насыщенных, ненасыщенных и ароматических углеводородов, знание механизма горения является просто нереальной задачей.
3.4. Механизм горения углерода
Углерод является важнейшим твердым видом топлива, широко применяемым в котельных, промышленных теплогенерирующих установках и на теплоэлектростанциях. Его горение является гетерогенным процессом и имеет свои особенности. Брутто-процесс очень прост:
С + О2 + СО2 (43)
Однако механизм горения более сложен. В зависимости от стадии горения различают два механизма.
На начальной стадии, когда происходит разгорание вещества и температура невысокая (до 1000°С), механизм следующий:
Зарождение цепи.
В реакции зарождения цепи, как уже было в механизме горения водорода и СО, участвует вода:
М* + Н2О = ОН. + Н. (44)
Продолжение цепи. Н. + О2 = ОН. + О: (45)
Эта реакция также нам знакома по механизмам горения водорода и СО.
Далее активные частицы реагируют на поверхности с углеродом. Углерод представляет собой природный полимер (обозначим его Сх), в котором каждый атом С соединен четырьмя химическими связями с другими атомами С. При взаимодействии с активной частицей две из этих химических связей разрушаются и к атому углерода присоединяется атом кислорода. Образуется т. н. углеродно-кислородный комплекс - частично окисленный полимер углерода:
Сх + ОН. = Сх-1СО + Н. (46)
Этот комплекс может либо разрушаться при температуре горения, либо реагировать с бирадикалом кислорода:
Сх-1СО = Сх-1 + СО↑ (47)
2Сх-1СО + О: = 2Сх-1 + СО↑ + СО2↑ (48)
Углерод может реагировать и с бирадикалом кислорода:
Сх + О: = Сх-1СО (49)
Образование бирадикала кислорода, как и в реакции горения СО, не является реакцией разветвления цепи, так как он в дальнейшем поглощается и не дает новых радикалов.
Одновременно с разобранным механизмом на него накладывается механизм горения СО, который мы изучали выше.
Обрыв цепи аналогичен рассмотренному для реакций горения СО и водорода.
При повышении температуры в процессе горения углерод может окисляться не только кислородом, но и с помощью СО2:
Сх + СО2 = Сх-1СО + СО↑ (50)
Чем выше температура, тем более эффективным становится этот способ окисления углерода. При температурах около 1500°С и выше углерод практически полностью окисляется с помощью СО2. На этой стадии механизм выглядит следующим образом. Углерод окисляется по реакции (50). Все рассмотренные выше процессы продолжения цепи не играют существенной роли. В газовой фазе у поверхности углерода происходит горение СО по изученному выше механизму. Этот процесс полностью использует диффундирующий в пламя кислород, который не доходит до поверхности углерода. Таким образом, кислород непосредственно вообще не участвует в реакции окисления углерода.
Такой механизм носит название двойного горящего слоя, где первый из них – слой горящего а атмосфере СО2 углерода, а второй – горящего в атмосфере кислорода СО.
Скорость горения углерода в основном определяется площадью поверхности. Для интенсификации процесса в промышленных установках уголь перед использованием измельчается до пылевидного состояния и спрыскивается в сопло в виде аэрозоля. Процесс горения такого угля хорошо регулируется.
В домашних котельных уголь обычно используется в виде достаточно крупных кусков.
ГЛАВА 4
ВЗРЫВЧАТЫЕ ВЕЩЕСТВА
При взрыве развивается крайне высокая мощность выделения энергии химической реакции. Если процесс происходит в небольшом объеме, то выделяющиеся газообразные продукты реакции создают огромное давление, которое вызывает сильные разрушения окружающих материалов. Например, взрыв тонны взрывчатого вещества (ВВ) может за время ~10-4 с создать давление порядка сотен тысяч атмосфер и вызвать образование мощной ударной волны. Поэтому взрыв нашел широкое применение в военной области для разрушения сооружений, коммуникаций и военной техники, а также для поражения людей.
Широко встречаются случаи, когда взрыв является нежелательным процессом. Практически любая газовая смесь горючего с воздухом может взрываться при определенных условиях (например, при утечке природного газа в квартирах). Практически любой горючий материал, взвешенный в воздухе в тонко измельченном виде, может дать при поджигании в определенных условиях т. н. пылевой взрыв. Известны взрывы, в которых в виде пылей участвовали такие материалы, как уголь, сажа, древесина, бумага, пробка, отруби, солод, крахмал, сахар, мука, шерсть, пакля, алюминий, магний, смола, сера, нафталин и др.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 |



