
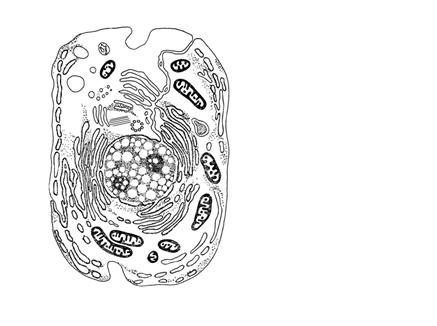
![]() Аппарат Гольджи Секреторные гранулы Лизосомы
Аппарат Гольджи Секреторные гранулы Лизосомы
 |

![]()
Пероксисома
 |

![]()

![]() Центриоли
Центриоли
Митохондрия
 |
 |
Гладкий эндоплазматический
![]() ретикулум
ретикулум

![]()
 Ядерная оболочка
Ядерная оболочка

Шероховатый эндоплазматический
![]() ретикулум
ретикулум

 Липидные включения
Липидные включения
Плазмолемма Гликоген
Ядрышко
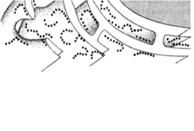
Рис.2 Схема строения клетки
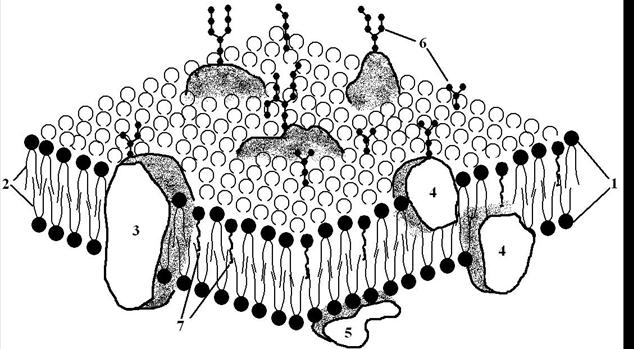
Рис. 3. Жидкостно мозаичная модель мембраны клетки.
Мембрана состоит из двойного слоя липидов, гидрофильные части которых («головка»-1) расположены на поверхности мембраны (внутрений и наружной), а гидрофобные части («хвост»-2) – внутри мембраны. В липидном слое, в зависимости от расположения, различают – трансмембранные (3), интегральные (4) и периферические белки (5). Многие липиды и белки (на внешней поверхности мембраны) имеют олигосахаридные цепи (6). 7 – холестерин
Белки, в зависимости от локализации в мембране, подразделяются на:
· интегральные белки, глубоко встроены в липидный слой – 4, рис. 3 (белки адгезии, мембранные рецепторы);
· трансмембранные белки, пронизывают всю толщу мембраны и выступают на наружной и внутренней ее поверхности – 3, рис. 3 (ионные каналы, переносчики, некоторые рецепторы и др.);
· периферические белки, связанны лишь с одной из поверхностей мембраны – 5, рис. 3 (рецепторы, белки адгезии, ферменты, белки цитоскелета и др.).
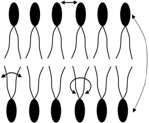
Функции белков, да и всей клеточной мембраны в целом, в значительной степени зависят от ее липидного компонента, его характеристик. Такие важные свойства бислоя липидов как латеральная диффузия, вращение, изгибание, «флип-флоп» (рис. 4) определяют текучесть (жидкостность) плазмолеммы. Они способствуют перемещение молекул жиров и белков относительно друг друга. Это очень важно для белков, особенно белков-ферментов. Жидкостность (сменяемость типов липидов) возле данных белков, обеспечивает их энзимную активность (аллостерическая активация липидами биослоя), оптимальные условия для ферментных реакций. Другим фактором, влияющим на текучесть мембраны, является холестерин – 7, рис. 3. Молекулы холестерина, встраиваясь между двумя гидрофильными частями (головками) фосфолипинов, уменьшают ее текучесть. Помимо этого, как полагают, холестерин увеличивает механическую прочность бислоя липидов.
Более текучий Менее текучий Латеральная диффузия

«Флип-Флоп»
перескоки
происходят
очень редко.
Изгибание Вращение
Ненасыщенные Насыщенные
углеводородные прямые углеводородные
цепи цепи
Рис. 4. Свойства липидов мембраны (подвижность, текучесть).
Кроме белков и липидов на мембранах многих клеток обнаруживаются и углеводы (6, рис. 3). Они не являются самостоятельными компонентами и входят в состав соответствующих липидов (гликолипиды) и белков (гликопротеиды). Углеводы чаще всего представлены олигосахаридными цепями и на поверхности клетки образуют гликокаликс. Он выполняет ряд функций, в частности, от него зависит способность клеток к адгезии, фагоцитозу, защищает белок от протеолиза. Некоторые гликопротеиды обладают ферментативными свойствами, формируют специфические поверхностные сигналы. Последние находятся под строгим генетическим контролем и используются иммунной системой для разделения всех клеток на «свои» и не «свои».
Нарушения плазмолеммы могут быть врожденными и приобретенными. Клинико-патофизиологическая характеристика врожденной патологии плазмолеммы.
В качестве примера приведем болезнь Ниманна-Пика (умственная отсталость, гепатоспленомегалия). Ее развитие является следствием наследственного дефицита фермента сфингомиелиназы, обеспечивающего обмен липидов из класса сфинголипидов - цереброзидов. Много данного вида жиров содержится в мембранах нейронов ЦНС, эпителиальных клетках. Другой пример, генетический дефект спектрина (периферический, подмембранный белок). Он в норме образует сеть филаментов на внутренней поверхности мембран, например эритроцитов, что придает им двоякую вогнутость. При недостатке спектрина клетки красной крови приобретают форму сфероцита, уменьшается их осмотическая активность и они быстро гемолизируются (болезнь Минковского-Шоффара, наследственный микросфероцитоз).
Приобретенная патология. Вне зависимости от вида (типа) этиологического фактора, повреждения мембраны клетки может быть результатом:
· интенсификации свободнорадикального окисления;
· активации мембранносвязанных фосфолипаз;
· механо-осмотического растяжения и разрыва мембраны;
· адсорбции на мембране полиэлектролитов.
Интенсификация свободнорадикального окисления. В процессе нормальной жизнедеятельности организма постоянно образуются активные (свободные) радикалы-окислители (СР). Радикалы имеют нечетное количество электронов (свободная валентность) и легко вступают в различные химические реакции. Отнимая электроны у различных органических молекул (белков, жиров, углеводов), они тем самым, изменяют их свойства. К наиболее широко известным соединениям этого вида относятся активные кислородсодержащие радикалы (АКР).
АКР – это физиологические метаболиты (сильные окислители). Их образование является необходимым звеном таких жизненно важных процессов как транспорт электронов в цепи дыхательных ферментов, синтез простогландинов и лейкотриенов, метаболизм катехоламинов, пролиферации и деффиринцировки клеток, фагоцитоза и др. Инициируемое ими свободнорадикальное перекисное окисление жиров (см. ниже) регулирует состав бислоя липидов плазмолеммы (изменяется ее жидкостность), и, как следствие этого, изменяется активность мембранносвязанных белков-ферментов, ее проницаемость к различным ионам и веществам и др. Метаболические процессы и вещества (витамины А, Д, липоевая кислота и др.) инициирующие появление СР, обеспечивают работу так называемой прооксидантной (от греч. – oxydation окисление) системы клетки.
К наиболее известным активным формам кислорода относят:
· О˙2 – супероксидный анион (радикал);
· Н2О2 – перекись водорода (пероксид водорода);
· 'О2 – синглентный кислород;
· ОН˙ - гидроксильный радикал.
Выше указанное полезное назначение активных радикалов кислорода утрачивается при длительном и значительном увеличении их продукции с активацией перекисного окисления липидов (ПОЛ). АКР и продукты ПОЛ, образовавшиеся в большом количестве, оказывают токсическое действие на клетку, что может даже завершиться ее гибелью. Данное состояние иногда обозначается как «стресс окислительный» или «оксидативный стресс»
Основными повреждающими воздействиями АКР, в пределах плазмолеммы (как впрочем, и для остальных мембран клетки), являются:
· перекрестное окисление АКР (СР) сульфгидрильных групп белков и липидов: это часто происходит при реакции SН-групп с СР; формируются «сшивки» между белками и фосфолипидами, приводящие к изменению физико-химических свойств мембраны (рис. 5).

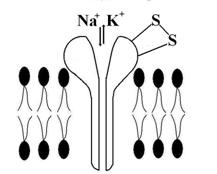
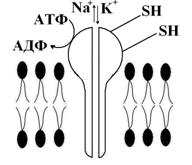
Рис. 5. Нарушение работы Na+/К+ насоса при окислении его белковых сульфгидрильных групп (SH) свободными радикалами (СР).
«Срезаются» или меняют свою локализацию концевых участки трансмембранных гликопротеидов (в том числе и клеточных рецепторов). Работа клеточных рецепторов нарушается, изменяется функция ионных насосов, повышается проницаемость плазмолеммы для катионов и анионов, других соединений. Из-за «поломки» Nа-К-насоса, Nа+ начинает накапливаться в клетке, К+ из нее выходит – сглаживается натрий-калиевый градиент, уменьшается потенциал покоя, т. е. нарушается градиентсоздающая система клетки. Изменяется и работа Са++ АТФ-фазы, что приводит к увеличению концентрации кальция в клетке. Необходимо отметить – связывать сульфгидрильные, а так же карбоксильные, фосфатные и другие группы веществ мембраны, могут и другие агенты, например ионы металлов (особенно тяжелых). Так, ртуть нарушает транспорт Nа+ и К+ (связывает SН-группы), свинец, таллий блокируя фосфатные группы изменяют транспорт К+, а уран, инактивируя фосфатные и карбоксильные соединения, нарушает транспорт глюкозы и галактозы через клеточную мембрану;
· перекисное окисление липидов мембраны (ПОЛ). Данный токсический эффект наиболее опасный для клетки, так при этом изменяется не только бислой липидов, но и тесно с ним связанные белковые и углеводные составляющие плазмолеммы. Наиболее патогенно ПОЛ для мембранных ненасыщенных жирных кислот. ПОЛ – цепные реакции, сопровождающиеся расширенным воспроизводством свободных радикалов, которые инициируют дальнейшее распространение перекисного окисления.
Данную реакцию можно представить следующим образом. Начинает реакцию ПОЛ чаще всего гидроксильный радикал (ОН˙). Он отнимает водород от СН2 – групп ненасыщенных жирных кислот (LН) – образуется липидный радикал (L˙). Это стадия инициации:
1) LН + ОН˙ = Н2О + L˙
Далее следует стадия развития цепи. К липидному радикалу присоединяется кислород, что приводит к образованию пероксилипида (липоперекиси) LОО˙:
2) L˙ + О2 = LОО˙
Липоперекись взаимодействует с соседней молекулой ненасыщенной жирной кислоты, вследствие чего возникает гидроперекись липида (LООН) и новый липидный радикал:
3) LОО˙ + LН = LООН + L˙
Вновь образовавшийся радикал липида (L˙) соединяется с кислородом и, все неоднократно повторяется. Следовательно, ПОЛ – это свободнорадикальные цепные реакции, где каждый вновь образовавшийся радикал способствует появлению других.
Находящееся в клетке двухвалентное железо может усилить данную реакцию путем превращения гидроперекиси липида в два свободных радикала: Fе2+ + LООН = ОН˙ + Fе3+ + LО˙.
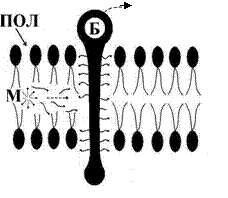
Реакция разветвляется на два радикалобразующих пути. ПОЛ значительно усиливает повреждающий эффект АКР (см. выше). В гидрофобной сердцевине бислоя жиров появляются гидрофильные зоны (за счет увеличения концентрации гидроперекисей липидов). Туда поступает вода, происходит расслоение мембраны («отек плазмолеммы»). Отмечаются разрывы наружного или внутреннего ее краев, а при тяжелых повреждениях – их обоих (рис. 6). Кроме того, наблюдается образование мицелл (от лат. mica, micelle – крошка, крупица). Это «компактная» упаковка амфифильных липидов имеющих один гидрофобный «хвост» («остаток» ненасыщенной жирной кислоты после взаимодействия с липоперекисями). Мицеллы обладают детергентным свойством (от лат. detergentis очищающих, моющий). Эта способность объясняется их высокой поверхностной активностью. Они, образуясь в большом количестве, и наделенные таким свойством, соединяются со структурными компонентами мембраны клетки, например, белками и удаляют их из мембраны (рис. 7). Происходит своеобразное «очищение», «мылоподобный» эффект, вследствие чего в плазмолемме образуются дефекты вплоть до формирование «кластеров» (простейших каналов). Детергентное повреждение может быть спровоцировано и мембраной фосфолипазой А, и рядом экзогенных веществ (см. ниже).
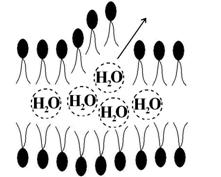

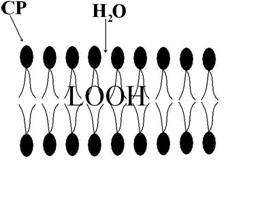
Рис. 6. Расслоение липидного слоя плазмолеммы и разрыв ее наружного края вследствие гидрофильных свойств гидроперекисей (LООН)

 |
 |
Рис. 7. Схема формирования «кластеров» в мембране клетки. М – мицелла, Б – мембранный белок, КЛ – «кластер» (объяснение в тексте).
Данные изменения приводят к патологии клетки: нарушаются рецепция и пострецепторные процессы, трансмембранный перенос ионов и различных химических соединений, течение всех обменных процессов. Они могут приобретать частично необратимый характер, т. е. клетка войдет в стадию некробиоза (рис. 1) свободно-радикального вида (его механизмы мы только что рассмотрели) и закончиться ее гибелью (некрозом).
Так как в организме постоянно образуются свободные радикалы (эффект работы прооксидантной системы). Поэтому существует и так называемая антиоксидантная система, регулирующая степень активности («агресивности») СР. Её основное назначение – сведение до минимума негативных последствий СР и ПОЛ.
К антиоксидантной системе относят:
· ферменты;
· витамины;
· хелатирующие вещества.
Ферментная группа включает в себя энзимы, в активный центр которых входят микроэлементы (металлы):
· супероксиддисмутаза (СОД), в зависимости от локализации в клетке (митохондрии, цитоплазма) содержит марганец (Мn), цинк (Zn) либо медь (Сu). Наиболее активна в печени, надпочечниках и почках, под ее влиянием супероксидные анионы превращаются в перекись водорода (менее агрессивные соединения из АКР);
· каталаза, железосодержащий фермент, находится в основном в пероксисомах, инактивируют Н2О2;
· фосфолипидглутотионпероксидаза, глутатион-пероксидаза, селенсодержащие энзимы. Нарушают образование перекиси водорода и липоперекисей.
Успешная работа ферментной группы антиоксидантной системы возможна только при наличии необходимого количества антиоксидантных субстратов. Наиболее важными компонентами данных субстратов служат тиоловые соединения – глутатион, цистеин и Д-пеницилламин. Отмечена значительная роль глутамина в защите от окисления мембран эритроцитов при гемолизе, нейронов при инсульте, для кардиомиоцитов при миокардиодистрофиях и др.
К веществам тиолового происхождения относят и белки протоплазмы, богатые сульфгидрильными группами (тиоредоксин), белки плазмы крови. Последние вырабатываются макрофагами и гепатоцитами в ответ на любое повреждение (белки острофазного ответа, см. гл. «Воспаление»). Например, белок из этой группы церуллоплазмин (феррооксидаза) окисляет двухвалентное железо до трехвалентного без образования свободных радикалов.
Группа витаминов:
· витамин Е (α-токоферол), наиболее распространенный и сильнодействующий природный антиоксидант, особенно эффективен для мембран клеток. Он способен инактивировать свободные радикалы непосредственно в гидрофобном слое липидов, тем самым предотвращать дальнейшее развитие цепи перекисного окисления;
· витамин С (аскорбиновая кислота), сильный восстановитель, взаимодействуя с супероксидным анионом, перекисью водорода и гидроксильным радикалом, значительно снижает их активность. Кроме того, он восстанавливает окисленную форму витамина Е. Антиоксидантным эффектом витамин С обладает при нормальных или повышенных концентрациях в организме. Однако, малые дозы аскорбиновой кислоты могут усиливать свободнорадикальное окисление за счет восстановления железа;
· витамин А и, в особенности его предшественники – каротиноиды (β-каротин) способны замедлять ПОЛ, хотя и в меньшей степени, чем α-токоферол.
Группа хелатирующих агентов. Сюда входят вещества связывающие железо и ряд других металлов, катализирующих и разветвляющих цепные свободнорадикальные реакции. Это такие вещества как десферол, унитол.
Компоненты антиоксидантной системы действуют в комплексе – восстанавливают и усиливают эффект друг друга. Например, для восстановления глютатиона необходим витамин С и возможно витамины РР, Е, В2. Тесное взаимодействие между селеном и токоферолом усиливает разрушение липоперекисей. Немаловажное значение в сдерживании активности свободно-радикального окисления имеют и полифенолы (биофлавоноиды, витамин Р, α-липоевая кислота и др).
Большое количество веществ антиоксидантной природы находятся в пищевых продуктах, поэтому, рациональное питание (по антиоксидантным инградиентам) необходимое условие в борьбе с окислительными процессами, для поддержания антиокислительного набора клетки.
Таким образом, выше изложенное позволяет нам выделить два основных механизма агрессивности СР и ПОЛ, обуславливающих повреждение мембраны клетки:
1. Избыточное образование СР и ПОЛ. В данной ситуации, чрезмерное образование свободных радикалов и активность перекисного окисления липидов превышают возможности нормальной антиоксидазной системы клетки их инактивировать. Это наблюдается при:
· воздействии на клетку ультрафиолетовых лучей и ионизирующей радиации;
· длительных стрессовых воздействий (образование СР при метаболизме значительного количества катехоламинов);
· гипервитаминозах Д, К, А, чрезмерном метаболизме простогландинов;
· гипероксии (образование СР при гипербарической оксигинации);
· гипоксии. Перекисное окисление липидов активируется в тканях, подвергшихся в начале ишемии, а затем быстрому восстановлению кровотока. Например, после ликвидации тромба в коронарных сосудах может расшириться зона инфаркта миокарда. Механизм – реперфузионная (кислородзависимая) интенсификация ПОЛ;
· злокачественных новообразованиях.
2. Ослабление работы антиоксидантной системы клеток. При этом механизме, СР и ПОЛ (количество и активность) соответствуют норме, но ввиду различных дефектов в антиоксидантной системе их обезвреживание снижено.
Указанный механизм может иметь место при:
· наследственных и приобретенных нарушениях синтеза и активности антиоксидантных ферментов (супероксиддисмутазы, глутатионпероксидазы и др.). В старости, по мнению ряда исследователей, активность некоторых из них снижается;
· дефиците в пище железа, марганца, селена и цинка (мы отмечали, данные ферменты – металлосодержащие). В Китае например, в провинции Женьсу (эндемичной по селену) регестрируется заболевание Кишен – особая форма миокардиодистрофии;
· гиповитаминозах Е, С, А, РР, В2;
· нарушениях в цикле Кребса (недостаточность образование НАДФН и НАДН). Они обеспечивают восстановление различных антиоксидантов;
· воздействии на клетку (ее мембраны) детергентов (см. ниже).
Активация мембраносвязанных фосфолипаз. Вторым, по значимости механизмом, обеспечивающим регуляцию состояния бислоя плазмолеммы в норме является фосфолипазы, и в частности, фосфолипаза А2. Она осуществляет гидролитическое отщепление ненасыщенных жирных кислот – одного из двух гидрофобных «хвостов» молекулы фосфолипидов бислоя мембраны. Освободившиеся при этом арахидоновая, пептановая и др. кислоты идут на синтез эйкозаноидов – простогландинов, тромбоксанов и лейкотриенов. Оставшаяся часть молекулы фосфолипида (лизофосфолипид) является водорастворимым амфифилом. В физиологических условиях (низкие концентрации) они существуют как мономеры, способные встраиваться в гидрофобный слой липидного отдела плазмолеммы, тем самым, изменяя его физико-химические константы. Этим достигается мембраностабилизирующий эффект, снижается ее проницаемость. Это нормальный механизм регуляции барьерной функции плазмолеммы.
При усилении активности фосфолипазы А2, концентрация свободных жирных кислот (лизофосфолипидов) значительно возрастает, они формируют мицеллы, обладающих сильным детергентным эффектом на мембраны клеток (см. выше). Соответственно повышается и концентрация эйкозаноидов (это один из механизмов формирования воспаления в районе повреждения клеток).
Главным фактором, повышающим активность фосфолипазы А2 является кальций. Его концентрация в клетке увеличивается из-за потери барьерной функции ее мембраны вследствие свободно-радикальных процессов, а так же при нарушениях механизмов удаления Са++ из цитоплазмы (см. выше).
Помимо повышенного освобождения свободных жирных кислот из бислоя липидов мембраны (увеличение их концентрации) в результате активации ПОЛ и фосфолипазы А2, имеются и другие источники увеличения их количества. Можно выделить несколько механизмов повышения содержания данных веществ в клетке:
· усиленное поступление свободных жирных кислот в клетку при гиперлипоцидемии, что отмечается при активации липолиза в жировой ткани (стресс, сахарный диабет);
· усиленное освобождение жирных кислот в лизосомах из триглицеридной части липопротеидов, поступающих в клетку на фоне гиперлипопротеинемии, например, при развитии атеросклероза;
· накопление жирных кислот из-за нарушения их использования в качестве энергитического субстрата митохондриями – например при гипоксии, уменьшении активности ферментов β-окисления жиров, цикла Кребса и др.
Все они, независимо о происхождения, амфифильны, обладают способностью к мицеллообразованию и детергентными свойствами (см. выше). Внедряясь в большом количестве в мембраны, формируют в них значительное количество кластеров. Кстати, к веществам с детергентыми свойствами и способных образовывать мицеллы, помимо ненасыщенных жирных кислот, относят желчные кислоты, билирубин и др.
Механо-осмотическое растяжение и разрыв мембраны. Немаловажную роль во вторичном (как правило) нарушении функции мембран играют процессы ее перерастяжения и разрыва вследствие гипергидратации клетки. Они развиваются вследствие увеличения концентрации осмотически активных веществ и ионов в цитоплазме клетки. Главная причина гипергидратации – значительное повышение содержания Nа+ и Са++ в пострадавшей клетке, вследствие:
· структурных изменений в плазмолемме, образование дополнительных каналов (кластеров) для вхождения в цитоплазму данных ионов (см. выше);
· нарушения работы Nа+, К+-АТФазы, Са++-АТФазы (ионных насосов).
Накопление Nа+ и Са++ в клетке способствует возрастанию в них осмотического давления и по закону осмоса – вода устремляется в зону его наибольших значений. Клетки вследствие этого набухают, объем их увеличивается, что может послужить причиной растяжения и микроразрывов цитолеммы.
Адсорбция на мембране клетки полиэлектролитов. Это последний из четырех рассматриваемых нами общих механизмов повреждения плазмолеммы. Фиксация полиэлектролитов на липидном слое клеточной мембраны способствует образованию в ней дополнительных каналов. Так, под влиянием антибиотика валиномицина, формируются селективные каналы для К+, стафилококковый α-токсин создает кластеры для Са++. Возможно, что подобным механизмом обладают и антитела. Необходимо отметить, что адгезия полиэлектролитов на плазмолемме инициируется и значительно облегчается ПОЛ и активацией мембранных фосфолипаз.
Выше мы отмечали положительную роль мембранного холестерина. Он является важным регулятором физико-химических свойств липидного бислоя, его мощным стабилизатором. Не вполне заслуженно холестерин представлен в виде «символа зла и патологии» (, , 1999). Данное химическое соединение увеличивает резистентность плазматических мембран к электропробою и дезинтеграции. Однако, повышая устойчивость к ряду повреждений, избыточное его присутствие в плазмолемме, может заставить некоторые клетки (клетки сосудов) вступать в атерогенез.
Насыщенная холестерином мембрана эритроцитов отличается большой устойчивостью к механическим повреждениям, но при этом снижаются ее эластические характеристики. Красные кровяные клетки испытывают затруднение в прохождении через капилляры, что способствует развитию ишемических нарушений микроциркуляции. Пример с холестерином еще раз подтверждает, рассмотренное раннее положение – относительной патогенности защитных реакций, их «погрешимость».
Таким образом, первичное повреждение плазматической мембраны (практически вне зависимости от конкретного механизма) характеризуется вполне определенными последствиями:
· недостаточностью мембранного рецепторного аппарата;
· недостаточностью натрий-калиевого насоса и функции других ионных каналов;
· утратой физиологических трансмембранных ионных градиентов;
· избыточным входом натрия и воды в клетку;
· набуханием (гипергидратацией) клетки;
· избыточным входом в клетку кальция;
· активацией мембранных фосфолипаз;
· освобождением и превращениями арахидоновой кислоты (синтез липидных медиаторов повреждения – эйкозаноидов);
· выходом из клетки цитоплазматических ферментов, микроэлементов (различных АТФаз, железа и др.).
Увеличение концентрации эйкозаноидов в межклеточном пространстве, выход из клетки различных ферментов, особенно гидролитических (повреждение мембран лизосом), нарушают локальную микроциркуляцию и способствует формированию очага воспаления (вторичная альтерация, см. раздел «Воспаление»). Выраженность данных изменений, их клиническое проявление определяется агрессивностью причинного фактора, состоянием защитно-приспособительных реакций и локализацией повреждения. При очень многих заболеваниях повреждения мембран клеток является одним из ведущих звеньев их патогенеза.
Другим, не менее важным звеном в патогенезе повреждения клетки, являются структурно-функциональные изменения ее органелл.
4. ПАТОЛОГИЯ КЛЕТОЧНЫХ ОРГАНЕЛЛ.
4.1. Патология ядра.
Основные функции ядра следующие:
· хранение генетической информации в ДНК;
· воспроизведение генетического материала ДНК (репликация ДНК) и передачу его дочерним клеткам в процессе деления;
· регуляция пластических и обменных внутриклеточных процессов.
Стандартным ответом ядра клетки на слабый раздражитель или стимуляцию является:
· активация синтеза различных видов РНК с последующим биосинтезом белка;
· активация репликации ДНК и стимуляция митотической активности клетки.
Можно выделить два основных вида повреждения ядерного аппарата клетки, проявляющиеся различными последствиями:
1. Повреждение мембраны ядра, характеризуется:
· нарушениями пространственной ориентации и фиксации молекул ДНК в ядре;
· нарушениями передачи сигнала генетическому аппарату клетки;
· выходом из ядра в цитоплазму разных видов РНК, информосом и др.;
· поступлением в ядро ионов, гормонов, медиаторов, индукторов и репрессоров, гистонов и др.
2. Повреждение ядра. Вся деятельность клетки, в том числе и ее реактивность определяется набором различных программ. Они генетически детерменированы и передаются из поколения в поколение. Действие различных патогенных факторов на место их хранения в клетке (ядро, ДНК), что получило название мутации (от лат. mutatio изменение, перемена), может вызвать искажение их записи и развитие патологии.
В зависимости от локализации различают половые и соматические мутации. Мутации половых клеток приводят к развитию наследственной патологии (см. раздел «Наследственная патология»). Соматические мутации нарушают генетическую информацию в неполовых клетках и, при митозе, передают ее своим дочерним клеткам – то есть клону. Они не передаются потомству организма, но имеют большое медицинское значение – являются основой клональных заболеваний. К ним относят доброкачественные и злокачественные опухоли, гемобластозы, макроглобулинемия Вальденстрема и др.
Основными следствиями соматических мутаций могут быть:
· активация механизмов канцерогенеза;
· прекращение синтеза или синтез измененного клеточного белка;
· стимуляция процессов клеточного старения;
· изменения антигенной структуры клетки;
· активация механизмов апоптоза клетки (см. ниже).
Степень повреждающего действия патогенного фактора на геном и белковый синтез в клетке зависит от фаз клеточного цикла. В фазу покоя обычно значительно преобладают нарушения синтеза белка и ферментов, необходимых для жизнедеятельности и роста клетки, межклеточных взаимодействий. В клетках, находящихся в митотическом цикле (особенно в фазах G1, G2) доминирующую роль играет степень изменения структуры и функции хромосом. , (2001), в связи с этим, различают поражение «генетического» ядра (преобладание генетических нарушений) и «соматического» ядра (преобладание нарушений управления синтезом белков и ферментов). Последнее может осуществляться:
· путем воздействие на ДНК, например, цитостатики из группы аналогов пуриновых и пиримидиновых оснований изменяют структуру оснований ДНК;
· путем воздействия на ферменты, участвующих в транскрипции. Например, альфа-аманитин (токсический продукт из гриба Amanita phaloides), рифамицин связывают РНК-полимеразу, тем самым препятствуют транскрипции.
4.2. Патология митохондрий.
Органические вещества, поступающие в организм, обладают определенным запасом внутренней энергии. Часть этой энергии используется организмом для своих нужд. Такую энергию называют «свободной». В митохондриях и происходит «освобождение» основного количества свободной энергии и аккумуляция ее в форме АТФ на заключительном этапе катаболизма.
Катаболизм – трехступенчатый процесс, на каждом из этапов которого, происходит освобождение энергии, часть из которой идет на нагрев тела (первично рассеянное тепло).
Первый этап (гидролитический) катаболизма происходит в желудочно-кишечном тракте и лизосомах без участия кислорода и освобождает до 1% всей энергии субстратов. Она не запасается и полностью входит в первично рассеянно тепло.
Второй этап – безкислородное цитоплазматическое расщепление – гликолиз и распад липидов. Вследствие этого получается универсальный катаболит – ацетил-коэнзим А (ацетил-КоА). На втором этапе освобождается не менее 30% всего энергосодержания субстратов, запасается из них около 45%, остальная часть тоже рассеивается.
Третий этап. Он осуществляется в условиях доступности кислорода в митохондриях. Продукт 2-го этапа катаболизма (ацетил-КоА) вовлекаются в митохондриальное окисление (цикл Кребса, тканевые дыхательные ферменты). При этом освобождается до 70% всей химической энергии субстратов и образуются конечные продукты метаболизма – углекислый газ и вода. Следовательно, наиболее эффективный этап образования энергии – митохондриальный. Он дает возможность, в зависимости от степени сопряжения окисления и фосфорилирования, запасать энергию в виде макроэргов до 55% от всей энергии субстратов. Окисление 1 моля глюкозы дает до 38 молей АТФ (686000 калорий энергии освобождается при полном окислении 1 моля глюкозы).
Мы не будем останавливаться на строении и функции митохондрии, работе цикла Кребса и цепи дыхательных ферментов – это подробно рассматривалось на курсах гистологии и биохимии. Затронем лишь те положения, которые нам необходимы в процессе изложения учебного материала.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 |



