ДЕНИТРИФИКАЦИЯ ВОДЫ ЭЛЕКТРОВОССТАНОВЛЕНИЕМ НА КОМБИНИРОВАННЫХ КАТОДАХ, СОДЕРЖАЩИХ Ni И УГЛЕГРАФИТОВЫЙ ВОЛОКНИСТЫЙ МАТЕРИАЛ
,
Физико-химический НИИ им. , Москва, Россия
, Москва, Россия
НИИ неорганических материалов им. , Москва, Россия
Введение
Одной из ключевых проблем в области защиты здоровья человека и охраны окружающей среды в настоящее время является проблема водоочистки и водоподготовки. Очистка сточных вод по биогенным элементам (азоту, фосфору) пока не соответствует требованиям действующих стандартов в России. Приоритетной задачей является совершенствование схем очистки воды, повышение качества очистки по азоту до требований ПДК (содержания в воде азота нитратов на уровне 7-9 мг/л и аммонийного азота 0,5 мг/л) без применения химикатов, влияющих на состав очищаемой воды. В работе [1] приведены сведения о достоинствах и недостатках методов удаления нитратов из природной питьевой воды (ионный обмен, обратный осмос, электродиализ, биологическая денитрификация) и такие перспективные направления как нано - и ультрафильтрация, каталитическое и электрохимическое восстановление нитратов, которые еще не нашли широкого промышленного применения. По мнению авторов, универсальных методов очистки воды от нитратов не существует. Традиционная технология денитрификации, наиболее часто используемая в схемах очистки, имеет существенные недостатки. При подготовке питьевой воды возникает проблема присутствия биомассы, поскольку при отстаивании она удаляется не полностью, и требуется значительное время (до трех недель) для проведения денитрификации [1]. Другим недостатком является необходимость последующей обязательной химической очистки воды для удаления болезнетворных бактерий (обычно хлорированием, озонированием, УФ-дезинфекцией, электролизом, ультразвуком и пр.). В экстремальных условиях временной фактор особенно важен.
Электрохимическое восстановление нитратов позволяет достигнуть значительного удаления нитратов. Однако, при электрохимическом восстановлении нитратов кроме свободного N2 образуются и другие азотные соединения [1].
В свете сказанного очевидно, что проблема электровосстановления нитрат-иона до экологически безопасного (безвредного) продукта - N2 весьма актуальна. Процесс электровосстановления нитрат-ионов привлекал внимание многих ученых. Ранние исследования [2-3] процесса электровосстановления нитрат-ионов были выполнены на металлических электродах в различных растворах (разбавленная HNO3, NaOH + HNO3 и др.). Показано, что в этом случае электровосстановление NO3- происходит до аммиака (NH3).
В последних работах [4-6] основное внимание уделяется влиянию модифицированной поверхности электродов на кинетику, селективность электровосстановления нитрат-ионов. В работе [4] исследовано электровосстановление нитрат-ионов в сернокислых растворах на Pt/Pt в присутствии в растворе ионов Sn+2 и на электродах, предварительно модифицированных адатомами олова. Обнаружено, что в обоих случаях можно наблюдать увеличение активности платины в электровосстановлении NO3- в широкой области потенциалов почти на два порядка, что существенно превышает эффекты, найденные нами ранее в присутствии адатомов германия. Основным продуктом электровосстановления при этом оказывается гидроксиламин. Обнаружено постепенное уменьшение активности поверхности модифицированных оловом электродов в ходе их поляризации в определенном интервале потенциалов в растворах, содержащих NO3-. Показано, что существуют отличия в поведении электродов, предварительно модифицированных оловом, и электродов в контакте с раствором, который содержит ионы Sn2+ и NO3- .
В работе [5] показано, что в растворе 0,5 M NaNO3 электрокаталитическая активность модифицированного тиомочевиной электрода выше, чем чистого Au. На электродах, модифицированных иодид- и сульфид-ионами электрокаталитическая активность ниже, чем на чистом Au. Основными продуктами электровосстановления нитрат-ионов на этих электродах являются: NH3, NO2-, H2.
В работе [6] для получения тонкого композитного слоя проводили последовательное субмонослойное осаждение (u. p.d.) серебра и свинца на Au(III). Ag осаждали u. p.d. в 1 mM Ag2SO4 и 0,1M H2SO4 при 0,4 и 0,01В (относительно Ag проволоки). Данные ЦВА, полученные на этом Ag/Au (III) электроде в Pb2+ электролите с 0,1М HClO4, показали вклады и Au и Ag. Согласно in-situ СТМ, u. p.d. на Ag/Au (III) приводит к необычной мультислойной морфологии. Метод ЦВА был использован для демонстрации стабильности и присутствия Ag –адслоя в Рв2+ электролите. В присутствии нитрата натрия эта композитная система показала каталитическое действие на восстановление нитрата, которого не наблюдалось для Au (III), Ag/Au(III), Pd/Au(III), Ag(III), Pb/Ag (III). Сделан вывод, что система Ag-Pb/Au (III) оказывает наибольшее каталитическое влияние на восстановление нитратов.
Использование в качестве катодов восстановления NO3- золота, серебра, платины, олова, Pb и др. металлов не обеспечивает высокого качества, экологической безопасности, низкой стоимости технологии водоподготовки. Перспективными, по нашему мнению, для электровосстановления нитрат-ионов могут быть гибкие углеродные материалы.
Химическое строение поверхностных групп углеродных материалов является определяющим в электрокаталитических явлениях. Целенаправленное изменение химии поверхности УГВМ путем электрохимического и химического модифицирования позволит изменить их электрохимические и адсорбционные свойства и широко использовать их в качестве катодов-катализаторов и адсорбентов для глубокой очистки воды от экотоксикантов.
Основная часть
Ранее [7] нами было показано, что продуктами электровосстановления нитрат–ионов на исследованном катоде-катализаторе Ni+УГВМ являются H2, N2 и OH--ионы, а их относительные скорости образования (выход по току) зависят от токовой нагрузки.
При низких токовых нагрузках единственной электродной реакцией является восстановление нитрат-ионов, а при токовой нагрузке выше 0,2 А начинает протекать параллельная реакция выделение молекулярного водорода в результате электролиза воды.
Данные хроматографического анализа катодных газов показали, что в газовой фазе присутствует только азот. С ростом токовой нагрузки в газовой фазе фиксируется и водород. Спектральный анализ раствора 0,1 N KNO3 после электролиза не установил присутствия нитрит-ионов (промежуточных продуктов восстановления).
В развитие наших исследований [7] была изучена кинетика электровосстановления нитрат-ионов, влияние условий модифицирования поверхности УГВМ на эффективность и селективность электровосстановления нитрат-ионов, возможность регенерации УГВМ на месте обработки воды. Эксперименты проводили на катодах, содержащих Ni и углеграфитовый волокнистый материал (УГВМ) в лабораторных ячейках с анодным и катодным пространствами, разделенными ионообменной мембраной МФ-4СК, в статическом режиме электролиза при комнатной температуре. Электродную поляризацию в гальваностатическом режиме проводили от источника постоянного напряжения. Измерение потенциала комбинированного катода осуществляли стандартным электродом сравнения (хлор-серебряным). Количественное определение продуктов электровосстановления нитрат-ионов проводили УФ-спектроскопией, ион-селективными электродами на нитрат-ионы и катион аммония. Объемным анализом определяли гидроксил-ионы. Состав катодных газов определяли газохроматографическим и волюметрическим методами.
На рис.1 представлена кинетика электровосстановления нитрат-ионов на комбинированном катоде в 0,1 M KNO3 при токовой нагрузке –0,1 А.
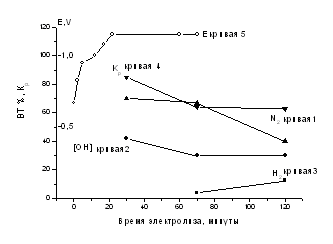
Рис.1. Кинетика электровосстановления нитрат-ионов на комбинированном катоде в 0,1 N KNO3 при токовой нагрузке –0,1 А. Кривая 1 – выход по току N2, кривая 2- выход по току OH-, кривая 3 – выход по току H2, кривая 4 – степень разложения NO3- , кривая 5 – изменение потенциала комбинированного катода.
Видим, что эффективность и селективность электродных реакций изменяется с увеличением времени электролиза. Следует обратить внимание, что при малых временах электролиза (30 минут) степень разложения нитрат-иона самая высокая (85%) в данных условиях эксперимента. При этом наблюдается рост потенциала катода от потенциала погружения до значений = -1,0-1,2 В. При временах электролиза 90 минут относительная скорость восстановления нитрат-ионов тормозится (ВТ% = 65-67% , Кр= 57%) и выделяется водород с заметными скоростями, а потенциал комбинированного катода не изменяется.
Таким образом, установлены режимно-технологические параметры электровосстановления нитрат-ионов на комбинированных катодах Ni + УГВМ до молекулярного азота и гидроксил-ионов: процесс денитрификации необходимо осуществлять при низких токовых нагрузках в интервале потенциалов погружения от –(0,2В – 0,5В) до -(1,0В – 1,2В) в динамическом режиме, время воздействия не более 30-40 минут. Таким образом, в экстремальных условиях (недостаток времени) для удаления нитратов из сточных вод может быть успешно использовано электровосстановление на комбинированных катодах Ni + УГВМ.
При данных условиях экспериментов, также как и ранее [7], не установлено наличия в католите катионов аммония (по измерениям ион-селективным электродом NH4+=1,4.10-4N–10-5 N) и в газовой фазе нет аммиака, как установлено газохроматографическим анализом. Волюметрический анализ газовой фазы также подтверждает отсутствие аммиака (рН воды после прохождения катодных газов не изменяется).
Спектральный анализ растворов нитрата калия и нитрата аммония после электровосстановления на комбинированном катоде при потенциале –1,0В подтвердил отсутствие нитрит-ионов в растворе после восстановления.
Таким образом, продуктами электровосстановления являются только азот и гидроксил-ионы.
Проводились эксперименты по выяснению возможности ускорения реакции электровосстановления нитрат-ионов на исследуемых катодах Ni+УГВМ путем модифицирования поверхности УГВМ катодной поляризацией в растворе 0,1 NH4NO3.
На рис.2 изображена зависимость потенциала катода и состава продуктов электровосстановления нитрат-ионов при токе –0,05А в 0,1 N KNO3 в зависимости от времени электролиза.
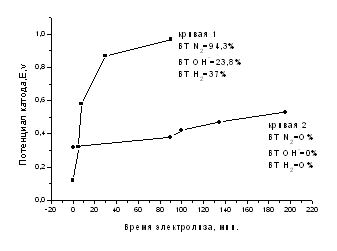
Рис.2. Зависимость потенциала катода и состава продуктов электровосстановления нитрат-ионов при токе –0,05А в 0,1 N KNO3 от времени электролиза. Кривая 1 – катод после длительного электровосстановления в 0,1 N KNO3, кривая 2- электровосстановление нитрат-ионов после предварительной катодной поляризации в 0,1 N NH4NO3.
Как видим, электрокаталитическая активность длительно работающего катода низка - относительная скорость (выход по току ВТ) восстановления нитрат-ионов равна 0% (кривая 2), а на электрохимически модифицированном катоде относительная скорость восстановления нитрат-ионов равна 94% (кривая 1).
Известно, что электрохимическая обработка УГВМ приводит к изменению химии поверхности, пористости. Возможно, что в процессе катодной поляризации УГВМ в децинормальном нитрате аммония образуются нанокомпозитные слои, катализирующие восстановление нитратов. Другое возможное объяснение столь резкому увеличению относительной скорости электровосстановления нитрат-ионов после предварительной катодной поляризации в растворе 0,1 N NH4NO3 связано как с увеличением основных групп УГВМ, так и со специфической адсорбцией катионов аммония, что способствует более эффективной адсорбции нитрат-ионов в двойном электрическом слое и перераспределению потенциала.
На рис.3 изображена зависимость потенциала комбинированного катода Ni + УГВМ (кривые 1,2) и выхода по току N2 при электровосстановлении NO3- при токовой нагрузке + 0,01А.
Последовательность измерений в данной серии экспериментов была следующей: на длительно работающем комбинированном катоде Ni + УГВМ сначала проводили электровосстановление NO3- в течение 148 минут (кривая 1), затем отключали полрязицацию, сливали раствор католита на анализ. Далее комбинированный катод Ni + УГВМ промывали дистиллированной водой и заливали раствор 0,1 N KNO3 и снова включали полярязацию ( кривая 2 ).
Сравнивая кривые 1,2 видим, что кажущейся выход по току N2 при электровосстановлении NO3- в области потенциалов от –0,3В до+0,13В (кривая 1) равен 274%, а в области потен-циала электрода от +0,2В до -0,3В наблюдается рост выхода по току N2 до 590%.
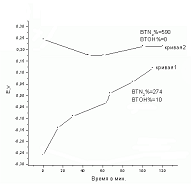
Рис.3. Зависимость потенциала комбинированного катода Ni + УГВМ (кривые 1,2) и выхода по току N2 при электровосстановлении NO3- при токовой нагрузке + 0,01А.
Эти экспериментальные данные указывают, что на комбинированных катодах параллельно процессу электровосстановления NO3- протекает электрохимически управляемая сорбция NO3-. Известно, что трудности удаления нитратов из воды связаны с их хорошей растворимостью и низкой способностью к адсорбции. Таким образом, впервые установлена значительная адсорбция нитрат-ионов на комбинированных катодах Ni + УГВМ, управляемая потенциалом. На комбинированных катодах Ni+УГВМ обеспечивается глубокая очистка сточных вод от нитратов в результате сочетания электрохимически управляемой сорбции NO3- и их электровосстановления.
На рис.4 представлена кинетика накопления нитрат-ионов в промывной воде в процессе очистки катода Ni + УГВМ анодной поляризацией. Как видим, оптическая плотность поглощения свежепромывного раствора на длине волны 300 нм, характерной для NO3- ионов, растет с количеством пропущенного электричества и потенциалом. При достижении таких малых количеств электричества, как 200-250 Кл и потенциала + 0,2 В, процесс очистки поверхности УГВМ завершается.
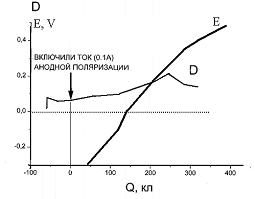
Рис.4 Кинетика накопления нитрат-ионов в промывной воде в процессе очистки катода анодной поляризацией (кривая D – оптическая плотность, кривая E – потенциал катода)
Таким образом, анодная поляризация - эффективный способ регенерации поверхности УГВМ катода-электрокаталиазтора от адсорбированных NO3- ионов. Разработанный способ регенерации УГВМ в воде не требует затрат реагентов, экологически чист и малоэнергоемок.
Следует обратить внимание на то обстоятельство, что разрабатываемая нами озон-пероксидно-электрохимическая технология водоподготовки позволяет в одном цикле осуществлять реакцию окисления аммонийного азота до нитрат-ионов в результате рецикла озон-кислородной смеси, образующейся на аноде, и последующее электровосстановление нитрат-ионов до N2 на комбинированных катодах-электрокаталиазторах Ni + УГВМ.
Таким образом, полученные результаты показывают, что разрабатываемая нами озон-пероксидно-электрохимическая технология обеспечивает высокое качество очистки, низкую стоимость, экологическую безопасность, позволяет повысить качество денитрификации воды, интенсифицировать процесс, значительно снизить расходы реактивов и электроэнергии.
Выводы
В экстремальных (чрезвычайных) ситуациях для денитрификации вод может быть успешно применен разработанный нами малозатратный высокотехнологичный способ.
Электровосстановление нитрат-ионов на комбинированных катодах Ni-УГВМ протекает до экологически чистых продуктов - азота и гидроксил-ионов при малых токовых нагрузках в интервале потенциалов от потенциала погружения –(0,2–0,5)В до –(1,0–1,2)В в динамическом режиме за 30-40 мин.
Денитрификация вод на комбинированных катодах Ni+УГВМ есть сочетание одновременно протекающих процессов электровосстановления нитрат-ионов и электрохимически управляемой сорбции NO3 – ионов.
Электрокаталитическая активность длительно работающего комбинированного катода Ni+УГВМ может быть восстановлена путем модифицирования поверхности УГВМ в децинормальном растворе NH4NO3 катодной поляризацией на месте применения.
Разработан способ регенерации поверхности комбинированного катода Ni+УГВМ анодной поляризацией его в воде на месте применения без затрат реагентов.
СПИСОК ЛИТЕРАТУРЫ
1. , . Методы удаления нитратов из природных и питьевых вод. // Химия и технология воды 2006, Т.28, №3. с.256-273.
2. , , . Восстановление NO3- на свинцовом катоде // Электрохимия 1970, Т.6, №4, с.612.
3. , , . О катодном процессе в разбавленной азотной кислоте. // Электрохимия 1974,10, №1, с.100.
4. , . Влияние ионов олова на электровосстановление итрат-ионов на платинированном платиновом электроде.// Электрохимия 1998, 34, №11, С..
5. El-Deab Mohamed S. Electrochemical reduction of nitrate to ammonia at modified gold electrode. // Electrochemica acta 2004, V.49, N.9-10, P.
6. H. Seongpil, L. Joohan, K. Juhyoun. Nitrate reduction catalyzed by nanocomposite layer of Ag and Pb on Au (III). // J. Electroanalyt. Chem. 2005, V.579, N 1, P.143-152.
7. , , . Применение озон-пероксидной электрохимической технологии обезвреживания экотоксикантов для денитрификации воды. Сб. тезисов Международного конгресса Вода: экология и технология, ECWATECH 2002, Москва, май 2002 г.



