1.Мельчайшей, химически неделимой частицей вещества является атом.
2.Многообразие веществ обусловлено различным сочетанием атомов.
3. При соединении атомов могут образовываться вещества молекулярного
(мельчайшей частицей которых являются молекулы) и немолекулярного (состоящие из атомов и ионов) строения.
4. Молекулы и атомы находятся в непрерывном движении.
5. Атомы одного вида отличаются от атомов других видов массой, разме-
рами, свойствами.
6.При химических реакциях атомы сохраняются, происходит их перегруп-
пировка в другие вещества, с иными свойствами.
На этом этапе изучения веществ ведущим остаются эмпирические методы познания, но усиливаются элементы теоретического познания. Одним из приемов изучения веществ является их описание по развернутому плану.
План изучения элементов и простых веществ:
1. Химический знак и характеристика элемента.
2. Относительная атомная масса.
3. Химический состав простого вещества.
4. Формула и относительная молекулярная масса.
5. Физические свойства.
6. Растворимость.
7. Химические свойства.
8. Физиологическое действие.
9. Круговорот в природе.
10. Получение.
11. Применение (кислород, водород).
12. Зависимость: состав—свойства — применение.
На примере изучения кислорода покажем цели изучения, содержание и графическое обобщение изучаемого материала.
Урок по теме: «Кислород — химический элемент и простое вещество».
Цель урока: развить у учащихся понятия о химическом элементе и простом веществе (на примере кислорода); выделить закономерности их познания: состав — строение — свойства — применение.
Основной метод: экспериментальное изучение свойств кислорода и графическое обобщение в процессе проблемной беседы.
На основе наблюдения опытов, обобщения изложенного учителем и дополненного учащимися в ходе беседы составляется схема-конспект урока.
При изучении кислорода, водорода, воды и их производных — оксидов, кислот, солей, оснований внимание учащихся следует сосредоточить на усвоении зависимостей «состав — свойства», «состав— свойства — получение», «свойства—применение» в процессе выполнения следующих заданий:
1. Охарактеризуйте зависимость применения кислорода от его свойств.
2. Установите и объясните закономерную связь между составом, свойства
ми и способами получения водорода.
3. На примере любого вещества раскройте следующую зависимость:
Состав_____ свойства______ получение, применение
Важно также научить учащихся анализировать и истолковывать символические обозначения, и прежде всего химические формулы, используя для этого ориентировочные основы действий (план, алгоритм).
кислород
Химический элемент | Простое вещество |
состав | |
Химический знак –О m а (О)=16 а. е.м. А r (О)=16 Валентность в соединениях : 2 | Химическая формула-О2 m м (О2)=16 а. е.м.*2=32 а. е.м. М r(О2)= 32 Молекулярное вещество. Физические свойства: газ, без цвета, вкуса и запаха |
строение | |
Формы существования: а) как простое вещество (например в воздухе) б) в составе сложных веществ: (в воде) | P=101 кПа, T пл=183 *С |
свойства | |
В воде, органических веществах, минералах и горных породах Всего : 49 % от массы атомов всех элементов | Химические свойства (проявляются в химических реакциях) В составе сложных веществ кислород - химический элемент. |
выводы | |
| О - самый распространенный на Земле химический элемент О - химический элемент, из-за высокой химической активности не существует в природе в виде отдельных атомов | О2- одно из самых активных веществ |
План анализа химической формулы:
1. Химическое соединение, обозначаемое формулой, и его описание.
2. Признаки и отношения, выделяемые формулой, их качественное и коли
чественное выражение.
3. Законы, которым подчиняется и которые отражает данная формула.
4. Определение по формуле класса, к которому принадлежит вещество.
5. Предсказание по формуле свойств вещества и способов получения.
6. Познавательные действия и расчеты на основе данной формулы.
7. Оценка роли химической формулы в познании веществ.
Изучение приведенных выше веществ и таких их классов, как кислоты, соли, основания, можно существенно сократить во времени в 3—5 раз, если раскрыть их концентрированно, крупным блоком, используя коллективный способ обучения. Приведем схему, отражающую связь данного материала и логику его раскрытия при таком способе изучения.
Изучение двух и более разделов, тем на основе коллективного способа обучения широко практикуют учителя школ.
Ориентацию учащихся на содержание темы (раздела) перед их самообучением учитель осуществляет разными способами (вводная лекция, схема-конспект, обобщающая весь материал, инструкция по его изучению и др.). Самообучение организуется в динамических парах учащихся путем работы с текстом учебника и выполнения предложенных заданий. Завершаются такие уроки коллективным обсуждением результатов или обобщающей лекцией, приводящих в систему весь изученный материал.
Обобщение знаний об основных классах неорганических соединений имеет целью привести в систему первоначальные сведения об оксидах, кислотах, основаниях и солях, углубив их новыми признаками этих веществ и знаниями их взаимосвязей. Основная идея обобщения — зависимость свойств от состава вещества. Весьма важным в понимании периодического закона является урок на тему «Взаимосвязи между неорганическими веществами».
Цель урока: систематизация полученных знаний о неорганических веществах и их классах, установление между ними генетических связей и взаимосвязей, образование системы понятий об основных классах неорганических соединений.
Урок начинается с актуализации сделанных ранее обобщений о классах соединений и умений оперировать этими знаниями. Она проводится в форме вопросов, упражнений, выполнения экспериментальных задач. Учащиеся выполняют следующие упражнения:
1. Какие вещества называются оксидами? Каков их состав, на какие группы и по каким признакам делятся оксиды? Приведите примеры.
2. Экспериментально докажите принадлежность оксида фосфора (V) и ок
сида кальция к определенным группам оксидов.
3. Установите взаимосвязь состава, свойств и применения оксидов.
(Подобные типы заданий предлагаются и по другим классам соединений.)
Основная часть урока отводится обобщению и систематизации знаний на основе ведущих идей курса, составлению схемы классификации и установления взаимосвязи веществ разных классов.
Специфические (особенные) свойства каждого класса рассматриваются со всеобщими признаками (состав, строение, свойства) и учетом индивидуальных признаков их представителей.
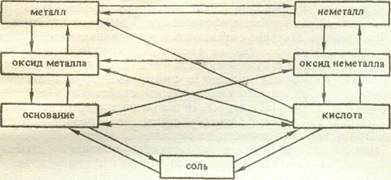
По анализу состава как классификационного признака вещества делятся на простые и сложные. Учащиеся приводят определения, примеры и описания простых и сложных веществ. Сложные вещества разделяются на классы. Учащиеся дают их характеристику, указывают признаки деления, приводят доказательства принадлежности тех или иных веществ к определенному классу соединений, раскрывают общие свойства класса, противопоставляют свойства веществ, относящихся к одному классу, но разным его группам. Итогом систематизации этих знаний является схема классификации неорганических веществ.
Следующая часть урока отводится установлению взаимосвязи между соединениями разных классов. Сначала проблемно устанавливаются генетические связи, затем проводится постановка проблемы: можно ли с помощью химических реакций перейти от простых веществ к сложным и от одного класса соединения к другим? Учащиеся высказывают предположения о возможности таких переходов, составляют схемы превращений, конкретизируют их уравнениями реальных реакций, подтверждают некоторые из них опытами, устанавливают генетические связи веществ. Пример схемы превращений: Ca->CaO-Ca(OH)2—CaSО4.
Цепь этих превращений показывается экспериментально. Аналогично исследуются возможности подобных превращений неметаллов на примере серы или фосфора. С помощью конкретных и общих схем генетических связей соединяют цепи превращения металлов и неметаллов между собой:
Ca->CaO->-Ca(OH)2 . Me-*-MeO-*Me(OH)s
S -»• SO2 -> H2SO3 ‘ HeMe-* неМеО--> НхНеМеОу
Важно использовать не только прямые переходы от простых веществ к сложным, но и обратные, от сложных к простым:
Cu(OH)2-»-CuO->Cu.
Необходимо также раскрыть взаимосвязь между веществам: разных классов.
Учащимся задается вопрос: могут ли существовать связи между веществами, разными по составу и свойствам? Учащиеся приводят примеры, доказывающие наличие таких связей На основе схем генетических связей составляют схему взаимосвязи веществ разных классов, записывают уравнения, подтверждающие их. Делают общий вывод: между различными элементами и их соединениями существует взаимосвязь. Она проявляется в процессе взаимодействия веществ и активно используется в практической деятельности человека.
При выполнении упражнений следует широко использовать диалектический принцип «оборачиваемости метода». В данном случае он проявляется в том, что свойства одного вещества или целого класса одновременно рассматриваются и как основа применения этого вещества, и как способ получения других веществ.
Приведем примеры подобных упражнений:
Используя оксид кальция, раскройте общие признаки этой группы веществ и установите взаимосвязи его состава, свойств и применения.
Напишите уравнения реакций, с помощью которых можно осуществить
следующие превращения:
Ва -> ВаО -> Ва(ОН)2 -»• ВаС12.
Укажите условия их протекания.
3. С какими из перечисленных веществ: CaO, Р2О5, MgO, CO2, Ва(ОН)2 —
будут реагировать: а) вода, б) гидроксид натрия, в) соляная кислота? Запиши
те уравнения возможных реакций и дайте объяснение указанным взаимодействиям.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 |




