при различных температурах
Температура, °С | Ионное произведение воды Кw | рН |
0 | 0,11 · 10–14 | 7,48 |
20 | 0,69 · 10–14 | |
25 | 1,00 · 10–14 | 7,00 |
40 | 2,95 · 10–14 | |
60 | 9,55 · 10–14 | |
80 | 25,10 · 10–14 | |
100 | 55,00 · 10–14 | 6,13 |
Степень гидролиза солей в 0,1 М растворах при 25 °С
Соль | Степень гидролиза, % | Соль | Степень гидролиза, % |
NH4Cl | 0,007 | NaH2PO4 | 0,0004 |
NH4CH3COO | 0,5 | Na2CO3 | 4,0 |
(NH4)2S | 99,0 | NaHCO3 | 0,005 |
NH4HS | 7,0 | Na2S | 99,0 |
Na2B4O7 | 0,5 | NaHS | 0,10 |
Na2SO3 | 0,13 | NaClO | 0,18 |
Na | 0,0002 | KCN | 1,2 |
NaCH3COO | 0,007 | Al2(SO4)3 | 3,5 |
Na3PO4 | 34,0 | Al(CH3COO)3 | 40,0 |
Na2HPO4 | 0,13 | Fe(CH3COO)3 | 32,0 |
Общие константы устойчивости комплексных ионов 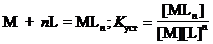
Комплексный ион | Куст | lg Куст |
Аммиачные | ||
Ag(NH3)2+ | 1,74 × 107 | 7,24 |
Cd(NH3)42+ | 3,63 × 106 | 6,56 |
Co(NH3)62+ | 2,45 × 104 | 4,39 |
Co(NH3)63+ | 1,99 × 1035 | 35,2 |
Cu(NH3)2+ | 7,25 × 1010 | 10,86 |
Cu(NH3)42+ | 1,07 × 1012 | 12,03 |
Hg(NH3)42+ | 1,99 × 1019 | 19,3 |
Ni(NH3)62+ | 1,02 × 108 | 8,01 |
Zn(NH3)42+ | 5,01 × 108 | 8,7 |
Бромидные | ||
AgBr2– | 2,19 × 107 | 7,34 |
AuBr2– | 2,88 × 1012 | 12,46 |
BiBr4– | 6,92 × 107 | 7,84 |
HgBr42– | 1,00 × 1021 | 21,00 |
Комплексный ион | Куст | lg Куст |
Гидроксидные | ||
Ag(OH)2– | 1,00 × 104 | 4,0 |
Al(OH)4– | 1,0 × 1033 | 33,0 |
Au(OH)4– | 1,00 × 1033 | 33,0 |
Be(OH)42– | 1,0 × 1015 | 15,0 |
Cd(OH)42– | 2,63 × 108 | 8,42 |
Cr(OH)4– | 7,94 × 1029 | 29,9 |
Cu(OH)42– | 3,63 × 1014 | 14,56 |
Fe(OH)42– | 3,63 × 108 | 8,56 |
Fe(OH)4– | 2,6 × 1034 | 34,4 |
Sb(OH)4– | 2,0 × 1038 | 38,3 |
Zn(OH)42– | 5,02 × 1017 | 17,70 |
Иодидные | ||
AgI2– | 5,5 × 1011 | 11,74 |
BiI4– | 8,91 × 1014 | 14,95 |
CdI42– | 2,24 × 105 | 5,35 |
HgI42– | 6,76 × 1029 | 29,83 |
PbI42– | 8,32 × 103 | 3,92 |
ZnI42– | 3,1 × 10-1 | -0,51 |
Нитритные | ||
Ag(NO2)2– | 6,76 × 102 | 2,83 |
Оксалатные | ||
Cr(C2O4H)3 | 2,6 × 1015 | 15,4 |
Fe(C2O4H)3 | 1,70 × 1020 | 20,23 |
Роданидные | ||
Ag(SCN)2– | 1,7 × 108 | 8,23 |
Cd(SCN)42– | 7,9 × 102 | 2,91 |
Co(SCN)42– | 5,12 × 10-1 | -0,309 |
Cr(SCN)63– | 6,3 × 103 | 3,8 |
Cu(SCN)42– | 3,3 × 106 | 6,52 |
Pb(SCN)42– | 0,71 | 0,85 |
Zn(SCN)42– | 1,1 × 103 | 3,02 |
Fe(CNS)63– | 1,70 × 103 | 3,23 |
Комплексный ион | Куст | lg Куст |
Fe(CNS)4– | 3,39 × 104 | 4,53 |
Fe(CNS)2+ | 2,20 × 104 | 4,33 |
Hg(CNS)42– | 1,7 × 1021 | 21,23 |
Тиосульфатные | ||
Ag(S2O3)23-– | 2,88 × 1013 | 13,46 |
Cu(S2O3)23– | 1,86 × 1012 | 12,27 |
Фторидные | ||
AlF63– | 4,68 × 1020 | 20,67 |
BeF42– | 2,45 × 1013 | 13,39 |
FeF63– | 1,26 × 1016 | 16,10 |
Хлоридные | ||
AgCl2– | 1,1 × 105 | 5,04 |
AuCl2– | 2,63 × 109 | 9,42 |
AuCl4– | 2,0 × 1021 | 21,30 |
BiCl63– | 2,63 × 106 | 6,42 |
CuCl2– | 2,24 × 105 | 5,35 |
HgCl42– | 1,66 × 1015 | 15,22 |
SnCl42– | 30,2 | 1,48 |
SnCl62– | 6,61 × 106 | 6,82 |
Цианидные | ||
Ag(CN)2– | 7,08 × 1019 | 19,85 |
Au(CN)2– | 2,0 × 1038 | 38,3 |
Au(CN)4– | 1056 | 56 |
Cd(CN)42– | 1,29 × 1017 | 17,11 |
Co(CN)64– | 1,23 × 1019 | 19,09 |
Co(CN)63– | 1 × 1064 | 64 |
Cu(CN)2– | 1,00 × 1024 | 24 |
Fe(CN)64– | 7,94 × 1036 | 36,9 |
Fe(CN)63– | 7,94 × 1043 | 43,9 |
Hg(CN)42– | 9,33 × 1038 | 38,97 |
Ni(CN)42– | 1,0 × 1031 | 31,0 |
Цитратные | ||
Fe[(СН2)2 С(ОН)(СОО)3] | 2,6 × 1011 | 11,4 |
Стандартные электродные потенциалы некоторых систем
в водных растворах
Уравнение процесса | Е0, В |
Азот | |
3N2+2e- =2N3- | -3,4 |
N2+4H2O+2e- =2NH2OH+2OH- | -3,04 |
N2+4H2O+4e- =N2H4+4OH- | -1,16 |
N2+8H++6e-=2NH4 | 0,26 |
NO2- +H2O+e- =NO+2OH- | -0,46 |
2NO2- +4H2O+6e- =N2+8OH- | 0,41 |
NO3- +2H2O+3e- =NO+4OH- | -0,14 |
NO3- +H2O+2e- =NO2-+2OH- | -0,01 |
NO3- +2H+ + e- =NO2+H2O | 0,80 |
NO3- +10H+ + 8e- =NH4+ +3H2O | 0,87 |
NO3- +3H+ + 2e- =HNO2+H2O | 0,94 |
NO3- +4H+ + 3e- =NO+2H2O | 0,957 |
2HNO2+6H+ +6e- =N2+4H2O | 1,44 |
HNO2+H+ + e- =NO+H2O | 0,99 |
Алюминий | |
AlO2- +2H2O+3e- =Al+4OH- | -2,35 |
Al(OH)3+3e-=Al+3OH– | -2,29 |
AlF63- +3e- =Al+6F- | -2,07 |
Al3+ +3e- =Al | -1,663 |
Барий | |
Ba2+ +2e- =Ba | -2,905 |
Бериллий | |
Be2+ +2e- =Be | -1,97 |
Бор | |
BF4- +3e- =B+4F- | -1,04 |
BO33- +6H+ +3e- =B+3H2O | -0,165 |
Бром | |
BrO - +H2O+2e- =Br - +2OH- | 0,76 |
Br2+2e- =2Br- | 1,065 |
BrO3- +6H+ +6e- =Br - +3H2O | 1,44 |
Уравнение процесса | Е0, В |
2BrO3- +12H+ +10e- =Br2 +6H2O | 1,52 |
BrO4- +2H+ +2e- = BrO3- +H2O | 1,88 |
Ванадий | |
V2++ 2e- =V | -1,186 |
V3+ +3e- =V | -0,87 |
V3+ +e- =V2+ | -0,255 |
VO2++ 2H+ +e- =V3++H2O | 0,337 |
VO2+ +e- =VO+ | -0,044 |
VO2+ +2H+ +e- =VO2++H2O | 1,00 |
VO2+ +4H+ +2e- =V3++2H2O | 0,668 |
VO2+ +4H+ +3e- =V2++2H2O | 0,36 |
VO2+ +4H+ +5e- =V+2H2O | -0,25 |
Висмут | |
Bi(OH)3 +3e- =Bi+3OH- | -0,46 |
BiO3– +6H+ +2e- =Bi3++3H2O | 1,81 |
Водород | |
H2 +2e- =2H- | -2,251 |
2H2O+2e- =H2+2OH- | -0,828 |
2H+ +2e- =H2 | 0,000 |
Вольфрам | |
WO42- +4H2O+6e- =W+6OH- | -1,05 |
WO42- +8H+ +6e- =W+4H2O | 0,049 |
Галлий | |
Ga3+ +3e- =Ga | -0,53 |
Гафний | |
Hf 4+ +4e- =Hf | -1,70 |
Германий | |
H2GeO3 +4H+ +2e- =Ge2+ +3H2O | -0,363 |
H2GeO3 +4H+ +4e- =Ge +3H2O | -0,13 |
Ge2+ +2e- =Ge | 0,000 |
Железо | |
Fe(OH)3 + e- =Fe(OH)2 +OH- | -0,53 |
Fe(OH)2 + 2e- =Fe+2OH- | -0,877 |
Fe3O4+8H++2e-=3Fe2++4H2O | 1,21 |
Уравнение процесса | Е0, В |
Fe3O4+8H++8e-=3Fe+4H2O | -0,085 |
Fe2+ +2e- =Fe | -0,440 |
Fe3+ +3e- =Fe | -0,037 |
Fe(CN)63- + e- = Fe(CN)64- | 0,356 |
Fe3+ + e- =Fe2+ | 0,771 |
FeO42- +8H+ +3e- =Fe3+ +4H2O | 1,700 |
Золото | |
Au(CN)- + e- =Au+2CN- | -0,61 |
Au3+ +2e- =Au+ | 1,401 |
Au3+ +3e- =Au | 1,498 |
Au+ +e- =Au | 1,692 |
Иод | |
2IO3- +6H2O+10e- =I2 +12OH- | 0,21 |
IO3- +3H2O+6e- =I - +6OH- | 0,25 |
2IO - +2H2O+2e- =I2 +4OH- | 0,45 |
IO - +H2O+2e- =I - +2OH- | 0,49 |
I2 +2e- =2I- | 0,536 |
2IO3- +12H+ +10e- =I2 +6H2O | 1,19 |
IO3- +6H+ +6e- =I– +3H2O | 1,08 |
2HIO +2H+ +2e- =I2 +2H2O | 1,45 |
H5IO6 +H+ +2e- =IO3- +3H2O | 1,6 |
IO4- +2H+ +2e- =IO3- +H2O | 1,64 |
Кадмий | |
Cd(CN)42- +2e- =Cd +4CN- | -1,09 |
Cd(NH3)42+ +2e- =Cd +4NH3 | -0,61 |
Cd2+ +2e- = Cd | -0,403 |
Калий | |
K+ + e- =K | -2,924 |
Кальций | |
Ca2+ +2e- =Ca | -2,866 |
Кислород | |
O2 +2H2O+4e- =4OH- | 0,401 |
O2 +2H+ +2e- =H2O2 | 0,682 |
O2 +4H+ +4e- =2H2O | 1,228 |
Уравнение процесса | Е0, В |
H2O2 +2H+ +2e- =2H2O | 1,776 |
O3 +H2O +2e- =O2 +2OH– | 1,24 |
O3 +2H+ +2e- =O2 +H2O | 2,07 |
Кобальт | |
Co(CN)63- + e- =Co(CN)64- | -0,83 |
Co2+ +2e- =Co | -0,277 |
Co(NH3)63+ + e- = Co(NH3)62+ | 0,1 |
Co(OH)3 + e- =Co(OH)2 +OH- | 0,17 |
Co3+ +3e- =Co | 0,33 |
Co3+ + e- =Co2+ | 1,808 |
Кремний | |
Si+4H++4e-=SiH4 | 0,10 |
SiO2+4H++4e-=Si+2H2O | -0,86 |
SiO32- +3H2O +4e- =Si+6OH | -1,7 |
SiF62- +4e- =Si+6F- | -1,2 |
SiO32- +6H+ +4e- =Si+3H2O | -0,455 |
Литий | |
Li+ + e- =Li | -3,045 |
Магний | |
Mg2+ +2e- =Mg | -2,363 |
Марганец | |
Mn2+ +2e- =Mn | -1,179 |
MnO4- + e- =MnO42- | 0,564 |
MnO4- +2H2O+3e- =MnO2 +4OH- | 0,60 |
MnO2 +4H+ +2e- =Mn2+ +2H2O | 1,228 |
MnO4- +8H+ +5e- =Mn2+ +4H2O | 1,507 |
Mn3+ + e- =Mn2+ | 1,509 |
MnO4- +4H+ +3e- =MnO2 +2H2O | 1,692 |
MnO42- +4H+ +2e- =MnO2 +2H2O | 2,257 |
Медь | |
Cu(CN)2- + e- =Cu+2CN- | -0,43 |
Cu(NH3)42+ +2e- =Cu+4NH3 CuI+ e- =Cu+I- | -0,07 -0,185 |
Уравнение процесса | Е0, В |
Cu2+ +2e- =Cu | 0,337 |
Cu+ + e- =Cu | 0,52 |
Cu2+ +Cl - + e- =CuCl | 0,53 |
Cu2+ +Br - + e- =CuBr | 0,64 |
Cu2+ +I - + e- =CuI | 0,84 |
Cu2+ +2CN - + e- =Cu(CN)2- | 1,12 |
Молибден | |
Mo3+ +3e- =Mo | -0,200 |
MoO42- +8H+ +6e- =Mo+4H2O | 0,154 |
Мышьяк | |
As+3H++3e- =AsH3 | -0,60 |
H3AsO4 +2H+ +2e- =HAsO2 +2H2O | 0,56 |
AsO43- +2H2O+2e- =AsO2- +4OH- | -0,71 |
Натрий | |
Na+ + e- =Na | -2,714 |
Никель | |
Ni2+ +2e- =Ni | -0,250 |
Ni(OH)3 + e- =Ni(OH)2 +OH- | 0,49 |
Ниобий | |
Nb3+ +3e- =Nb | -1,1 |
Nb2O5 +10H+ +10e- =2Nb+5H2O | -0,65 |
Олово | |
Sn(OH)62- +2e- =HSnO2- +3OH - +H2O | -0,90 |
SnCl42- +2e- =Sn+4Cl- | -0,19 |
SnF62- +4e- =Sn+6F- | -0,25 |
Sn2+ +2e- =Sn | -0,136 |
SnO2 +4H+ +4e- =Sn +2H2O | -0,106 |
Sn4+ +4e- =Sn | 0,01 |
Sn4+ +2e- =Sn2+ | 0,151 |
Осмий | |
OsO4 +8H+ +8e- =Os+4H2O | 0,85 |
Os2+ +2e- =Os | 0,85 |
Палладий | |
Pd2+ +2e- =Pd | 0,987 |
Уравнение процесса | Е0, В |
PdCl62- +2e- =PdCl42- +2Cl- | 1,288 |
Платина | |
Pt2+ +2e- =Pt | 1,188 |
Рений | |
ReO4- +4H2O+7e- =Re+8OH- | -0,584 |
Re3+ +3e- =Re | -0,18 |
ReO4- +8H+ +7e- =Re+4H2O | 0,37 |
Родий | |
Rh3+ +3e- =Rh | 0,8 |
Ртуть | |
Hg(CN)42- +2e- =Hg+4CN- | -0,37 |
Hg22+ +2e- =2Hg | 0,788 |
Hg2Cl2 +2e- =2Hg+2Cl– | 0,27 |
Hg2+ +2e- =Hg | 0,850 |
2Hg2+ +2e- =Hg22+ | 0,920 |
Рубидий | |
Rb+ + e- =Rb | -2,925 |
Рутений | |
Ru+ +2e- =Ru | 0,45 |
RuO2 +4H+ +4e- =Ru+2H2O | 0,79 |
Свинец | |
Pb2+ +2e- =Pb | -0,126 |
PbO32- +H2O+2e- =PbO22- +2OH- | 0,2 |
PbO2 +4H+ +2e- =Pb2+ +2H2O | 1,449 |
Pb4+ +4e- =Pb2+ | 1,694 |
Селен | |
Se+2e- =Se2- | -0,92 |
Se+2H+ +2e- =H2Se | -0,40 |
H2SeO3 +4H+ +4e- =Se+3H2O | -0,741 |
SeO42- +4H+ +2e- =H2SeO3 +H2O | 1,15 |
SeO42- +H2O +2e- =SeO32– +2OH– | 0,05 |
Сера | |
SO42- +H2O+2e- =SO32- +2OH- | -0,93 |
SO42- +4H2O+6e- =S +8OH- | -0,75 |
Уравнение процесса | Е0, В |
S+2e- =S2- | -0,48 |
SO42- +10H+ +8e- =H2S +4H2O | 0,31 |
SO42- +4H2O +8e- =S2– +8OH– | -0,68 |
S+2H+ +2e- =H2S | 0,17 |
SO42- +2H+ +2e- =SO32- +H2O | 0,22 |
2SO42- +10H+ +8e- =S2O32- +5H2O | 0,29 |
2SO42- +5H2O +8e- =S2O32- +10OH– | -0,76 |
SO42- +8H+ +6e- =S +4H2O | 0,357 |
S2O82- +2e- =2SO42- | 2,010 |
S4O62- +2e- =2S2O32- | 0,09 |
Серебро | |
Ag(CN)2- +e- =Ag+2CN- | -0,29 |
Ag(NH3)2+ +e- =Ag+2NH3 | 0,373 |
Ag+ +e- =Ag | 0,799 |
AgCl +e- =Ag+Cl– | 0,222 |
Ag2O+H2O+2e- =2Ag+2OH– | 0,342 |
Стронций | |
Sr2+ +2e- =Sr | -2,888 |
Сурьма | |
Sb+3e- =Sb | 0,20 |
SbO+ +2H+ +3e- =Sb+H2O | 0,212 |
SbO2- +4H+ +3e- =Sb+2H2O | 0,446 |
Sb2O5 +6H+ +4e- =2SbO+ +3H2O | 0,58 |
Таллий | |
Tl+ +e- =Tl | -0,336 |
Tl3+ +2e- =Tl+ | 1,252 |
Тантал | |
Ta2O5 +10H+ +10e- =2Ta+5H2O | -0,750 |
Теллур | |
Te +2e- =Te2- | -1,14 |
Te +2H+ +2e- =H2Te | -0,51 |
TeO42- +2H+ +2e- =TeO32- +H2O | 0,892 |
H2TeO6 +2H+ +2e- =TeO2 +4H2O | 1,02 |
Уравнение процесса | Е0, В |
Технеций | |
Tc2+ +2e- =Tc | 0,4 |
TcO4- +8H+ +5e- =Tc2+ +4H2O | 0,5 |
Титан | |
Ti2+ +2e- =Ti | -1,630 |
Ti3+ +3e- =Ti | -1,23 |
TiO2+4H++4e- =Ti+2H2O | -0,86 |
TiO2+ +2H+ +4e- =Ti+H2O | -0,88 |
Ti3+ +e- =Ti2+ | -0,368 |
TiO2+ +2H+ +5H2O+e- =Ti(H2O)63+ | 0,1 |
Углерод | |
CO2 +2H+ +2e- =CO+H2O | -0,12 |
CO2 +2H+ +2e- =HCOOH | -0,20 |
CO32- +6H+ +4e- =C+3H2O | 0,475 |
Фосфор | |
PO43- +2H2O+2e- =HPO32- +3OH- | -1,12 |
P+3H2O+3e- =PH3 +3OH- | -0,89 |
H3PO4 +4H+ +4e- =H3PO2 +2H2O | -0,39 |
H3PO4 +5H+ +5e- =P +4H2O | -0,383 |
H3PO2 +H+ +e- =P +2H2O | -0,51 |
H3PO3+3H+ +3e- =P +3H2O | -0,50 |
Фтор | |
OF2 +2H+ +4e- =2F - +H2O | 2,1 |
F2 +2e- =2F- | 2,87 |
Хлор | |
2ClO - +2H2O+2e- =Cl2 +4OH- | 0,40 |
ClO4- +4H2O+8e- =Cl - +8OH- | 0,56 |
ClO3- +3H2O+6e- =Cl - +6OH- | 0,63 |
ClO - +H2O+2e- =Cl - +2OH- | 0,88 |
ClO4- +2H+ +2e- =ClO3- +H2O | 1,189 |
Cl2 +2e- =2Cl- | 1,359 |
ClO4- +8H+ +8e- =Cl - +4H2O | 1,38 |
2ClO4- +16H+ +14e- =Cl2 +8H2O | 1,39 |
ClO3- +6H+ +6e- =Cl - +3H2O | 1,451 |
Уравнение процесса | Е0, В |
Хром | |
Cr2+ +2e- =Cr | -0,913 |
Cr3+ +3e- =Cr | -0,744 |
Cr3+ +e- =Cr2+ | -0,404 |
Cr(OH)3 +3e- =Cr+3OH– | -1,3 |
CrO42- +4H2O+3e- =Cr(OH)3 +5OH- | -0,13 |
CrO42- +4H+ +3e- =CrO2- +2H2O | 0,945 |
CrO2- +4H+ +e- =Cr2+ +2H2O | 1,188 |
Cr2O72- +14H+ +6e- =2Cr3+ +7H2O | 1,333 |
CrO42- +8H+ +3e- =Cr3+ +4H2O | 1,477 |
Цезий | |
Cs+ + e- =Cs | -2,923 |
Цинк | |
Zn(CN)42- +2e- =Zn+4CN- | -1,26 |
Zn2+ +2e- =Zn | -0,763 |
ZnO22- +2H2O+2e- =Zn+4OH- | -1,216 |
Цирконий | |
ZrO2+ +2H+ +4e- =Zr+H2O | -1,570 |
Zr4+ +4e- =Zr | -1,539 |
ZrO2 +4H+ +4e- =Zr+2H2O | -1,43 |
Лантаниды | |
La3+ +3e- =La | -2,522 |
Ce3+ +3e- =Ce | -2,48 |
Ce4+ + e- =Ce3+ | 1,61 |
Pr3+ +3e- =Pr | -2,462 |
Pm3+ +3e- =Pm | -2,423 |
Sm2+ +2e- =Sm | -3,121 |
Произведения растворимости

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 |




