Таблица 3 – Функционально – технологические свойства белковых изолятов гибридных семян и подсолнечного жмыха
Функциональные свойства, % | Белковый изолят: | ||
Брио | Ферти | Подсолнечный жмых | |
ЖУС ВУС ЖЭС ПОС СП | 320 176 75 29 41 | 280 246 70 24 46 | 150 189 48 22 43 |
Белковый изолят подсолнечного жмыха по функциональным свойствам и относительной биологической ценности уступает изолятам из нативных семян. У белковых изолятов семян гибридного подсолнечника ЖУС более чем в 2 раза, а ЖЭС в 1,5 раза больше, чем у белкового изолята подсолнечного жмыха. В то же время, получение и модификация белковых изолятов из подсолнечного жмыха более технологически целесообразно и экономически выгодны, по сравнению с использованием для этих целей масличных семян. Поэтому в дальнейших исследованиях использовать подсолнечный жмых для получения белковых изолятов и направленного регулирования их свойств.
3.3 Обоснование выбора ферментных препаратов и исследование их протеолитической активности. Ферментативная модификация растительных белковых изолятов применяется для регулирования их функциональных свойств и биологической ценности.
На основании проведенного анализа научной и технической литературы по использованию протеолитических ферментов для модификации белковых веществ, нами были выбраны протеазы пророщенных семян подсолнечника – РП и протеолитические ферменты подсырной молочной сыворотки - ПМС. Для получения препарата растительных протеаз использовали водную вытяжку из пророщенных гибридных семян подсолнечника.
В результате проведенных исследований установлены оптимальные условия для проращивания гибридных семян подсолнечника и получения ферментной вытяжки с максимальной протеиназной активностью (ПА). Время выдержки семян при проращивании - 72 часа, температура - 270C.
2 1
![]()
![]()
![]()
![]()
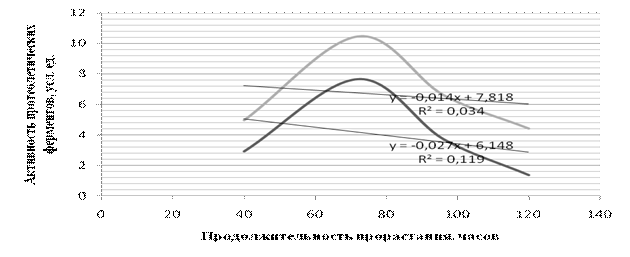
1 – гибрид НК Брио; 2 – гибрид НК Ферти
Рисунок 2 - Динамика изменения протеолитической активности пророщенных семян подсолнечника
Изучение динамики протеолитической активности пророщенных семян исследуемых гибридов подсолнечника с различным жирнокислотным составом НК Ферти и НК Брио (рисунок 2) показало, что максимальной активностью - 10,64 ед. ПА, обладает гибрид НК Ферти (высокоолениновый). Полученной ферментной вытяжкой проводили обработку белкового изолята исследуемого подсолнечного жмыха.
Использование ПМС, содержащей протеолитически активные молочнокислые бактерии и сычужный фермент, представляется обоснованным и целесообразным и может являться альтернативой использованию дорогостоящих промышленных ферментных препаратов. Используемая в работе сыворотка имела протеолитическую активность - 10,12 ед. ПА.
3.4 Оптимизация условий гидролиза и разработка технологической схемы получения белкового изолята подсолнечного жмыха.Поиск оптимальных параметров проведения гидролиза белкового изолята подсолнечного жмыха ПМС и РП осуществляли по 3х факторному эксперименту (рисунки 3, 4).
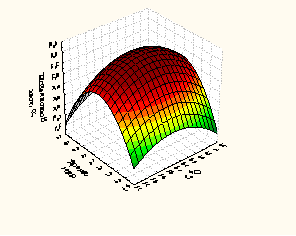
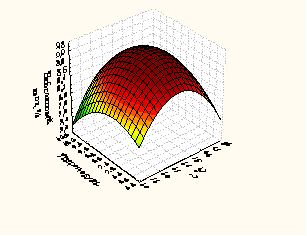
Рисунок 3 – Зависимость глубины гидролиза сывороточными протеазами от времени, гидромодуля и температуры
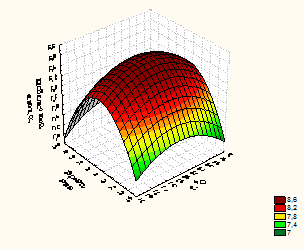
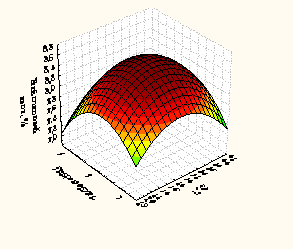
Рисунок 4 – Зависимость глубины гидролиза растительными протеазами от времени, гидромодуля и температуры
Факторами, оказывающими наибольшее влияние на выход небелкового азота (У, %) при гидролизе белкового изолята ПМС являются: температура, оС (фактор Х1), время, мин (фактор Х2) и гидромодуль (соотношения белкового изолята и ферментного препарата) (фактор Х3).
Анализ, полученных частных зависимостей (рисунки 3 и 4) показал, что наибольшее значение функции получено в следующих параметрах проведения процесса при использовании: ПМС температура – 35-37оС, время 40-42 минут, гидромодуль 8:1 (небелковый азот 9,09 – 9,07%); и РП температура – 25-27 оС, время 45-47 минут, гидромодуль 3:1 (небелковый азот 8,60– 8,62 %).
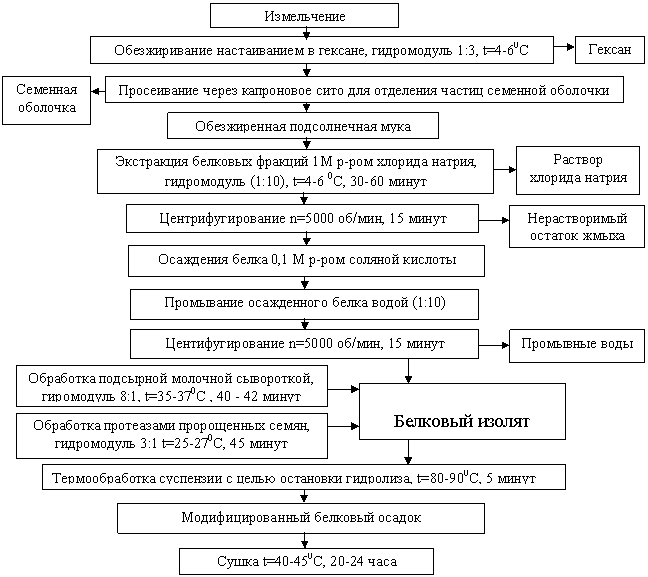
Классическая схема получения белкового изолята из подсолнечного жмыха заключается в экстракции белка диспергирующим агентом с последующим осаждением его в изоэлектрической точке соляной кислотой. Усовершенствованная схема получения белковых изолятов по предлагаемой технологии (рисунок 5) дополнительно включает последовательную обработку сывороточными и растительными протеазами с последующей термообработкой для остановки гидролиза и сушкой модифицированного белкового изолята.

![]() Жмых подсолнечный
Жмых подсолнечный
Модифицированный белковый изолят
![]()
Рисунок 5 - Схема получения модифицированных белковых изолятов
3.5 Влияние ферментативной модификации белковых изолятов на биологическую ценность и функционально-технологические свойства. Ограниченный протеолиз белковых биополимеров, по мнению исследователей, приводит к «разукрупнению» исходных субъединиц белков (вследствие деструкции четвертичной структуры) и «гидрофобизации», т. е. образуются белковые ассоциаты с новыми технологическими свойствами.
Растворимость белка – одно из наиболее важных функциональных свойств растительных белковых продуктов. Из приведенных данных в таблице 4 видно, что все виды модификаций приводят к изменению соотношений растворимого и нерастворимого белка. Наиболее существенные изменения, в сторону увеличения растворимости белка, наблюдаются при последовательной модификации сывороточными и растительными протеазами (СРП).
Таблица 4 – Изменение растворимости белка при различной модификации
Белок (а. с.в.), % | До модифи-кации | Виды модификации протеазами | ||
ПМС | РП | СРП | ||
- суммарный - нерастворимый - растворимый | 84,38 28,19 56,19 | 89,50 31,69 57,81 | 87,63 30,19 57,44 | 90,62 32,56 58,06 |
Электрофоретические исследования модифицированных белков показали, что ферментативная модификация сопровождается определенной деструкцией белковых глобул: происходит их «разрыхление» и деполимеризация протеазами, что подтверждается появлением ряда новых низкомолекулярных белковых компонентов. В исходных белках выделяется 11 фракций белковых компонентов. В белках модифицированных отдельно РП и ПМС имеются соответственно 17 и 19 электрофоретически разнородных компонентов, имеющих меньшую молекулярную массу. Белки при последовательной комплексной модификации характеризуются еще большей неоднородностью и включают 21 белковый компонент. Общая площадь электрофоретических спектров увеличивается от 20,89 mAU•сек в исходных белках до: 24,20; 28,73 и 39,65 mAU•сек в модифицированных белках (соответственно РП, ПМС и СиРП), что можно объяснить добавлением белков модифицирующих агентов (ферментов). В целом, обработка белковых изолятов подсолнечного жмыха СиРП позволяет получить большее количество новых белковых компонентов по сравнению с использованием отдельно сывороточных и растительных протеаз. Очевидно, проявляется суммарный протеолитический эффект действия протеаз (растительных, сычужных и микробных), обладающих различной субстратной специфичностью по отношению к пептидным связям между определенными аминокислотами в белковых молекулах.
Анализируя результаты жидкостной хроматографии по аминокислотному составу исследуемых модифицированных белковых изолятов, таблица 5, следует отметить некоторое возрастание относительной доли незаменимых аминокислот в исследуемых образцах модифицированных белковых изолятов по сравнению с исходным белком подсолнечного жмыха.
Так содержание лизина возрастает во всех вариантах модификации, а при обработке последовательно сывороточными и растительными препаратами – практически вдвое по сравнению с исходным образцом. Комплексная модификация приводит и к увеличению доли метионина, лейцина и изолейцина (в 1,3, 1,4 и 1,5 раза соответственно). Одновременно происходят изменения и в содержании заменимых аминокислот: уменьшается относительная доля глютаминовой аминокислоты в 1,3 раза и несколько снижается доля аспарагиновой; в то же время доля пролина и аланина пропорционально увеличивается, что можно объяснить взаимным превращением этих аминокислот (глютамат служит предшественником пролина, аспарагиновая кислота - аланина).
Увеличение массовой доли незаменимых аминокислот в модифицированных образцах можно объяснить за счет добавления белковых веществ самих модифицирующих препаратов: растительная ферментная вытяжка. Кроме ферментативных аминокислот могут дополнительно содержаться и синтезируемые аминокислоты проростков семян. Используемая для модификации подсырная сыворотка наряду с ферментами содержит и казеиновую пыль (в среднем 0,5%) - частицы белка казеина размером менее 1мм.
Таблица 5 – Изменения аминокислотного состава белковых изолятов при различной модификации
Аминокислоты | Содержание аминокислот, мг/г белка | |||
до модифи-кации | Виды модификаций | |||
ПМС | РП | СРП | ||
Незаменимые аминокислоты В том числе: лизин фенилаланин лейцин изолейцин метионин валин гистидин аргинин треонин | 252,72 11,95 32,42 18,42 16,18 18,71 42,76 24,83 43,03 44,42 | 276,04 21,68 20,32 25,17 23,13 22,75 30,58 31,49 47,03 53,89 | 272,99 18,33 28,13 24,53 20,23 13,62 38,51 26,76 48,93 49,95 | 282,00 23,57 27,51 23,48 24,63 23,93 40,91 30,81 44,44 33,72 |
Заменимые аминокислоты В том числе: аланин пролин глицин серин глютаминовая кислота аспарагиновая кислота тирозин | 456,04 42,44 46,17 51,26 42,73 148,70 97,12 27,62 | 442,29 50,14 47,02 42,59 50,13 138,13 78,14 26,14 | 445,47 50,49 48,43 48,74 50,48 136,72 77,34 35,27 | 442,14 50,87 49,35 44,53 49,51 137,38 76,72 33, 78 |
Отмеченные взаимные превращения аминокислот могут быть объяснены наличием в составе используемых модифицирующих реагентов не только протеолитических ферментов. Ферментная вытяжка из семян подсолнечника представляет комплекс различных ферментов образующихся при прорастании, в том числе, вероятно, синтетаз и трансфераз аминокислот. Сыворотка наряду с сычужным ферментом (смесь химозина и пепсина) содержит и различные ферментные комплексы молочнокислых бактерий.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 |



