На правах рукописи
СИНТЕЗ, СВОЙСТВА И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ МЕТИЛ 7-АРИЛ(ГЕТЕРИЛ)-6-(2-ГЕТЕРОИЛ)-4,7-ДИГИДРОТЕТРАЗОЛО[1,5-а] ПИРИМИДИН-5-КАРБОКСИЛАТОВ И ИХ ПРОИЗВОДНЫХ
14.04.02 – фармацевтическая химия, фармакогнозия
Автореферат диссертации
на соискание ученой степени
кандидата фармацевтических наук
Пермь-2011
Диссертационная работа выполнена в ГБОУ ВПО «Пермская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации
Научный руководитель: доктор химических наук,
профессор
Научный консультант: доктор медицинских наук,
профессор
Официальные оппоненты: доктор фармацевтических наук,
доцент
«Пермская государственная фармацевтическая академия».
Доктор химических наук,
доцент
«Пермская государственная сельскохозяйственная академия».
Ведущая организация:
ГБОУ ВПО «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развитии Российской Федерации
Защита диссертационной работы состоится 20 сентября 2011 года в 13:00 на заседании диссертационного совета Д 208.068.01 при ГБОУ ВПО «Пермская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации,
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО «Пермская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации, 6
Дата размещения объявления о защите диссертации на сайте «Пермской государственной фармацевтической академии» http:// www. ***** « » июля 2011 г.
Автореферат разослан « » июля 2011 г.
Ученый секретарь
диссертационного совета Д 208.068.01,
к. ф.н., доцент
Актуальность работы.
Одной из первостепенных задач фармацевтической химии является синтез малотоксичных соединений, обладающих различными видами биологической активности. Согласно литературным данным, к настоящему времени среди замещенных тетразолов найдены вещества, проявляющие антиаллергическую, антиастматическую, антимикробную, противовирусную, противотуберкулезную, противогрибковую, антигипертензивную и гипогликемическую активность. Известно, что эти соединения практически не вовлекаются в метаболизм человеческого организма, что позволяет создавать на их основе эффективные и безопасные препараты, способные достигать нужный рецептор или ключевой фермент, не претерпевая нежелательных побочных превращений. Поэтому синтез конденсированных гетероциклических систем, содержащих в качестве структурного фрагмента тетразольный цикл, аннелированный с пиримидиновым кольцом и исследование их на наличие биологической активности является актуальным.
Принимая во внимание значительный практический интерес к указанным гетероциклическим соединениям, следует отметить, что их химические свойства, в особенности способность к формированию конденсированных гетероциклических систем, изучены недостаточно. В литературе имеются сведения о синтезе тетразолопиримидинов на основе реакции эфиров ацетоуксусных и ароилпировиноградных кислот со смесью ароматического альдегида и 5-аминотетразола.
Продолжая синтез конденсированных гетероциклических систем производных тетразола с целью поиска среди них биологически активных соединений, представляло научный и практический интерес получить соединения ряда метил 7-арил(гетерил)-6-(2-гетероил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов, изучить их свойства и биологическую активность.
Цель работы. Целью данного исследования является синтез нового класса биологически активных и малотоксичных соединений ряда метил 7- арил(гетерил)-6-(2-гетероил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов и их производных, установление строения, изучение их химических свойств, выявление путей практического использования синтезированных соединений и возможной зависимости между строением и биологическим действием.
Задачи исследования. Для достижения поставленной цели были сформулированы следующие задачи:
1. Осуществить синтез конденсированной гетероциклической системы тетразоло[1,5-a]пиримидина, содержащей в 6 положении 2-гетероильный заместитель реакцией эфиров 2-гетероилпировиноградных кислот со смесью 5-аминотетразола и ароматического (гетерильного) альдегида.
2. Изучить взаимодействие синтезированных соединений с различными азотсодержащими моно - и бинуклеофильными реагентами.
3. Провести анализ результатов исследований биологической активности впервые полученных метил 7-арил(гетерил)-6-(2-гетероил)-4,7-дигидротетразоло[1,5-а] пиримидин-5-карбоксилатов и соединений, полученных в результате их химических превращений.
4. Выработать рекомендации по целенаправленному синтезу биологически активных соединений.
Научная новизна работы. Осуществлен синтез метил 7-арил(гетерил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов, метил 7-арил(гетерил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов. Обнаружено, что при взаимодействии полученных соединений с гидразингидратом образуются 5-оксо-8-тиенил-9-арил(гетерил)-4,9-дигидротетразоло[1',5':1,2] пиримидино[4,5-d]пиридазин-5-оны и 5-оксо-8-фурил-9-арил(гетерил)-4,9-дигидротетразоло[1',5':1,2]пиримидино[4,5-d]пиридазин-5-оны.
Обнаружено, что реакции метил 7-фенил-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилата и метил 7-тиенил-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилата с пропиламином проходит с образованием соответствующих N-пропил-7-фенил-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксамида и N-пропил-7-тиенил-6-(2-тиеноил)-4,7-дигидротетразоло [1,5-a]пиримидин-5-карбоксамида.
Впервые найдено, что реакция метил 7-(2,4-дихлорфенил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилата с 2-метоксианилином протекает с образованием 7-(2,4-дихлорфенил)-6-(2-фураноил)-N-(2-метоксифенил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксамида.
Впервые обнаружено, что при взаимодействии метил 7-(2-хлорфенил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилата с семикарбазида гидрохлоридом образуется метил 7-(2-хлорфенил)-6-[(2-карбомоилгидразоно)(2-фураноил)метил]-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилат.
Осуществлен синтез 107 соединений. На основании ИК, ЯМР 1Н, масс-спектров и рентгеноструктурного анализа установлена структура полученных соединений. Обнаружены вещества, обладающие сахароснижающей активностью, противомикробным действием. Проведен анализ результатов исследований биологической активности вновь синтезированных соединений в сравнении с препаратами эталонами и установлены закономерности взаимосвязи «структура - биологическое действие».
Практическая значимость. Разработаны препаративные методы синтеза неописанных ранее метил 7-арил(гетерил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5- a]пиримидин-5-карбоксилатов, метил 7-арил(гетерил)-6-(2-фураноил)-4,7-дигидро-тетразоло[1,5- a]пиримидин-5-карбоксилатов, 5-гидрокси-8-тиенил-9-арил(гетерил)-4,9-дигидротетразоло[1',5':1,2]пиримидино[4,5-d]пиридазин-5-онов, 5-гидрокси-8-фурил-9-арил(гетерил)-4,9-дигидротетразоло[1',5':1,2]пиримидино[4,5-d]пиридазин-5-онов, N-пропил-7-фенил-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксамида, N-пропил-7-тиенил-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксамида, 7-(2,4-дихлорфенил)-6-(2-фураноил)-N-(2-метоксифенил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксамида, метил 7-(2-хлорфенил)-6-[(2-карбомоилгидразоно)(2-фураноил)метил]-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилата, которые могут быть использованы в научно-исследовательской работе кафедр физической и коллоидной химии, органической химии и фармацевтической химии при синтезе новых биологически активных соединений.
Среди полученных 45 соединений выявлены вещества с выраженным сахароснижающим действием. Исследованиям на противомикробную активность подвергнуто 102 соединений, практически все из которых проявили антибактериальную активность разной степени.
Апробация работы. Основные результаты работы доложены на Всероссийской конференции по органической химии, посвященной 75-летию со дня основания Института органической химии им. (Москва, 2009), в вестниках Пермской государственной фармацевтической академии (Пермь, №2, 2007, №4, 2008, №5, 2009, №6, 2010), региональной научной конференции «35 лет синтеза фурандионов», краевой дистанционной научно-практической конференции молодых ученых и студентов «Молодежная наука Прикамья - 2008» (Пермь, 2008), Российской научно-практической конференции, посвященной 70-летию ПГФА «Достижения и перспективы в области создания новых лекарственных средств» (Пермь, 2007), I Международной конференции «Техническая химия: от теории к практике» (Пермь, 2008), II Международной конференции «Техническая химия. От теории к практике», посвященной 25-летию со дня основания Института технической химии УрО РАН (Пермь, 2010), на пятой Международной конференции по органической химии молодых ученых (Inter YCOS-9 «Universities Contribution in the Organic Chemistry Progress») (Санкт-Петербург, 2009), конференции с международным участием «Фармация и общественное здоровье» (Екатеринбург, 2008, 2010), 1-ой Международной конференции «Новые направления в химии гетероциклических соединений» (Кисловодск, 2009), научно-практической конференции «Фармация из века в век». Часть V. Синтез биологически активных веществ для создания фармацевтических субстанций. Фармакологические исследования (Санкт-Петербург, 2008), VI Всероссийской конференции молодых ученых с международным участием «Современные проблемы теоретической и экспериментальной химии» (Саратов, 2007).
Конкретное участие автора в получении научных результатов.
Изучены и обобщены данные отечественной и зарубежной литературы по методам получения и биологической активности конденсированных гетероциклов, содержащих в своём составе фрагмент тетразолопиримидина и гетероциклических систем, полученных на их основе.
Разработаны методики синтеза и полученно 107 ранее неизвестных соединений, исследованы их физико-химические свойства, структура соединений подтверждена данными ИК, ЯМР1Н, масс-спектроскопии и рентгеноструктурного анализа.
На основании трехкомпонентной реакции метиловых эфиров гетероилпировиноградных кислот со смесью ароматического (гетероциклического) альдегида и 5-аминотетразола разработан синтез метил 7-арил(гетерил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов, метил 7-арил(гетерил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов. Обнаружено, что при взаимодействии полученных соединений с гидразингидратом образуются 5-оксо-8-тиенил-9-арил(гетерил)-4,9-дигидротетразоло[1',5':1,2]пиримидино[4,5-d]пиридазин-5-оны и 5-оксо-8-фурил-9-арил(гетерил)-4,9-дигидротетразоло[1',5':1,2]пиримидино[4,5-d] пиридазин-5-оны.
Спектры ЯМР1Н синтезированных соединений выполнены зав. кафедрой физики и математики ПГФА, доцентом, к. физ.-мат. н. , ИК-спектры – в РИЦ «Фарматест» провизором-аналитиком , рентгеноструктурный анализ выполнен в Институте органического синтеза им. УрО РАН, к. х.н., руководителем группы рентгеноструктурного анализа
Исследования гипогликемической активности и острой токсичности веществ выполнены на кафедре фармакологии ПГФА аспирантами и под руководством д. м.н., профессора Котегова активность веществ исследована на кафедре микробиологии ПГФА ст. преподавателем, к. х.н. под руководством зав. кафедрой, д. ф.н., профессора
На основании данных биологических испытаний полученных соединений для более углубленного изучения рекомендуются: метил 7-(4-хлорфенил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилат; метил 7-(4-гидрокси-3-этоксифенил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилат; 5-оксо-8-тиенил-9-(4-гидрокси-3-этоксифенил)-4,9-дигидротетразоло[1',5':1,2]пиримидино[4,5-d]пиридазин-5-он, обладающие выраженным гипогликемическим действием, повышающие устойчивость к нагрузке глюкозой и усиливающие сахароснижающие свойства экзогенного инсулина.
Публикации. По материалам диссертации опубликованы 1 статья в издании, рекомендованном ВАК РФ, 6 статей в сборниках, 8 тезисов на научных конференциях.
Структура и объем диссертации. Содержание работы изложено на 150 страницах машинописного текста и состоит из введения, обзора литературы, обсуждения результатов собственных исследований, экспериментальной части, биологической части, выводов, списка литературы из 105 наименований, 15 таблиц, приложения, иллюстрирована 6 рисунками.
Основные положения, выносимые на защиту.
1. Синтез новых конденсированных гетероциклических систем метил 7-арил(гетерил)-6-(2-гетероил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов трехкомпонентной реакцией эфиров 2-гетероилпировиноградных кислот со смесью 5-аминотетразола и ароматического (гетерильного) альдегида.
2. Изучение взаимодействия синтезированных соединений с ароматическими и алифатическими аминами, гидразингидратом, семикарбазида гидрохлоридом.
3. Доказательство структуры полученных соединений на основании данных ИК, ЯМР 1Н-спектроскопии, масс-спектрометрии и РCA.
4. Анализ результатов исследований биологической активности впервые полученных метил 7-арил(гетерил)-6-(2-гетероил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов и соединений, полученных в результате их химических превращений.
5. Рекомендации по целенаправленному синтезу биологически активных соединений.
Основное содержание диссертации
1. Синтез и строение 7-арил(гетерил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a] пиримидин-5-карбоксилатов
Было установлено, что выдерживание при 130-150 ºС в течение 20 – 30 мин. метилового эфира 2-тиеноилпировиноградной кислоты со смесью 5-аминотетразола и ароматического (гетерильного) альдегида приводит к образованию метил 7-арил(гетерил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов (Iа-я).
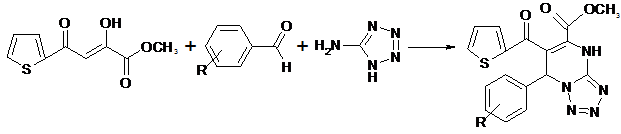 I а-я
I а-я
R=Н (а); 4-СН3 (б); RС6Н4= 2-тиенил (в); RС6Н4= 2-фурил (г); 4-СН3О (д); 3-СН3О (е); 2-СН3О (ё); 4-Сl (ж); 2-Сl (з); 4-NO2 (и); 3-NO2 (й); 2-NO2 (к); 4-F (л); 3-F (м); 2-F (н); 4-Br (о); 3-Br (п); 4-С2Н5 (р); 4-(СН3)2СH (с); 4-(СН3)3С (т); 3,4-(СН3О)2 (у); 2,4-(СН3О)2 (ф); 2,5-(СН3О)2 (х); 4-СН3ОOC (ц); 4-OH-3-СН3О (ч); 4-OH-3-С2Н5О (ш); 2,4-Сl2 (щ); 4-С2Н5О (э); 3-OH (ю); 4-OH(я).
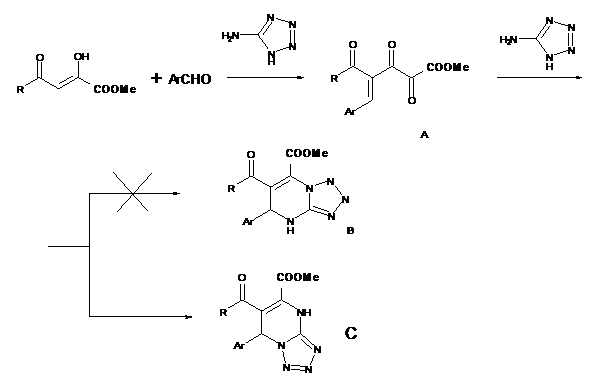
По-видимому, на первой стадии реакции образуется непредельное соединение А, с которым взаимодействует 5-аминотетразол с образованием соединений С. Изомерная структура В не образуется, по-видимому, вследствие меньшей термодинамической устойчивости 1,2-дигидропроизводных по сравнению с 1,4-дигидросоединениями С. Это подтверждает и тот факт, что в спектрах ЯМР1Н полученных веществ отсутствует расщепление сигналов протонов в положениях 1,2, характерное для АВ-системы в структуре В.
Iа-я
Соединения (Iа-я) представляют собой бесцветные или слабоокрашенные кристаллические вещества, растворимые в ДМФА, ДМСО, при нагревании растворимые в этаноле, уксусной кислоте, эфире, хлороформе, толуоле и не растворимые в воде.
В ИК спектрах соединений (Iа-я) наблюдаются полосы, обусловленные валентными колебаниями кетонной и сложноэфирной групп в областях и см-1 соответственно, а также полоса поглощения связи NH в области см-1.
В ЯМР1Н спектрах полученных соединений (I a-я) наблюдается синглет C7H протона при 6.40-7.30 м. д., группа линий ароматических протонов при 6.40-7.70 м. д., группа линий тиенильного фрагмента, которые прописываются в виде триплета при 6.90-7.40 м. д., двух дублетов при 7.40-7.90 и 7.80-8.10 м. д., присутствует синглет трёх протонов метоксигруппы при 3.40-3.50 м. д., синглет N4H-протона при 11.10-11.55 м. д.
В масс-спектре соединения (Iд) присутствует пик молекулярного иона с m/z: 383[M]+, а также пики фрагментных ионов с m/z: 354 [М–CO]+, 272 [M-(СН3О)2С6Н3]+, 244 [M-(СН3О)2С6Н3–CO]+, 111 [PhCH3О]+, 77 [Ph]+, что полностью соответствует указанной структуре.
Природа заместителей и их положение в ароматических альдегидах влияет на протекание реакции. Так, в случае взаимодействия с ароматическими альдегидами, имеющими в п-положении заместители любой природы, время реакции уменьшается, реакции протекают быстрее и с лучшим выходом, а при наличии заместителя в м- и о- положении время реакции увеличивается. Повышение электроноакцепторных свойств заместителей способствует повышению выхода соединений (I а-я).
Для установления пространственной структуры соединений (I а-м) в кристаллическом состоянии был получен кристалл метилового эфира 7-фенил-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоновой кислоты медленной кристаллизацией из этилового спирта и проведены его рентгеноструктурные исследования. Полученные результаты свидетельствуют о полном соответствии предложенной структуры соединения данным РСА (рис.1).
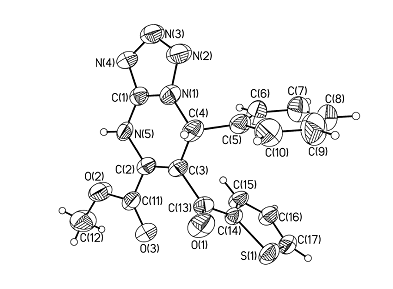
Рис.1. Молекула метилового эфира 7-фенил-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоновой кислоты в тепловых эллипсоидах 50% вероятности по данным РСА.
Бициклический фрагмент молекулы имеет вид листа, согнутого по прямой N5…C4. Двугранный угол между плоскостями С4С3С2N5 и N1N2N3N4N5C1C4 11о с отклонением атомов от плоскости не более чем на 0.015 Å. Двойные связи локализованы, без заметного влияния сопряжения. Все длины связей и валентные углы имеют обычные для соответствующих атомов значения. Наиболее существенным элементом молекулярной упаковки является образование межмолекулярных водородных связей NH…N типа, объединяющих молекулы в димеры с межатомным расстоянием N5…N4[-x+1, - y+1, - z+2] d= 2.889(3) Å (рис. 2).
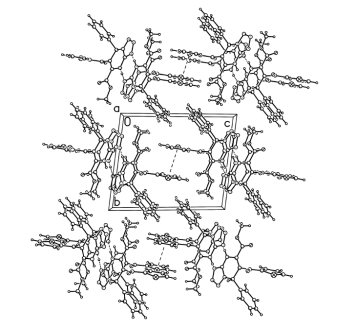

Рис.2. Фрагмент молекулярной упаковки метилового эфира 7-фенил-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоновой кислоты
2. Синтез и строение 7-арил(гетерил)-6-(2-фураноил)-4,7-дигидротетразоло [1,5-a]пиримидин-5-карбоксилатов
Выдерживание при 130-140º С в течение 20 – 30 мин. метилового эфира 2-фураноилпировиноградной кислоты со смесью 5-аминотетразола и ароматического альдегида приводит к образованию метил 7-арил(гетерил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов (IIа-я).
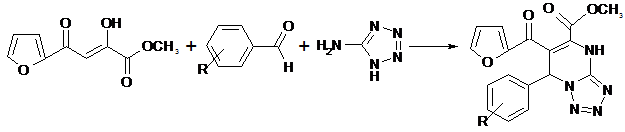 IIа-я
IIа-я
R= Н (а); 4-СН3 (б); RС6Н4 = 2-тиенил (в); RС6Н4 = 2-фурил (г); 4-СН3О (д); 3-СН3О (е); 2-СН3О (ё); 4-Сl (ж); 2-Сl (з); 4-NO2 (и); 3-NO2 (й); 2-NO2 (к); 4-F (л); 3-F (м); 2-F (н); 4-Br (о); 3-Br (п); 4-С2Н5 (р); 4-(СН3)2СH (с); 4-(СН3)3С (т); 3,4-(СН3О)2 (у); 2,4-(СН3О)2 (ф); 2,5-(СН3О)2 (х); 4-СН3ОOC (ц); 4-OH-3-СН3О (ч); 4-OH-3-С2Н5О (ш); 2,4-Сl2 (щ); 4-С2Н5О (э); 3-OH (ю); 4-OH (я).
Соединения (IIа-я) представляют собой бесцветные или слабоокрашенные кристаллические вещества, растворимые в ДМФА, ДМСО, при нагревании растворимые в этаноле, уксусной кислоте, толуоле, нерастворимые в воде.
В ИК-спектрах соединений (II а-я) наблюдаются полосы, обусловленные валентными колебаниями кетонной и сложноэфирной групп в областях и см-1 соответственно, а также полоса поглощения связи NH в области см-1.
В ЯМР1Н спектрах полученных соединений (II a-я) наблюдается синглет C7H протона при 6.60-7.40 м. д., группа линий ароматических протонов при 6.45-7.80 м. д., группа линий фурильного фрагмента, которые прописываются в виде триплета при 6.45-7.20 м. д., двух дублетов при 7.10-7.60 и 7.75-8.15 м. д., присутствует синглет трёх протонов метоксигруппы при 3.40-3.57 м. д., синглет N4H-протона при 11.17-11.70 м. д.
В масс-спектре соединения (II в) присутствует пик молекулярного иона с m/z: 357[M]+, а также пики фрагментных ионов с m/z: 328 [М–CO]+, 297 [M-СН3О–CO]+, 108 [C6H5OCH3]+, 95[C4H3OCO]+, 77 [Ph]+, что полностью соответствует указанной структуре.
На выход образующихся соединений оказывает некоторое влияние характер заместителя в ароматическом альдегиде. Так, повышение электроноакцепторных свойств заместителей способствует повышению выхода соединений (IIа-я). На основе ЯМР1Н спектров полученных соединений (II a-я) можно предположить наличие межмолекулярных водородных связей, аналогичных таковым для соединений (I a-я).
3. Химические свойства 7-арил(гетерил)-6-(2-гетероил)-4,7-дигидротетразоло[1,5-а] пиримидин-5-карбоксилатов.
3.1. Взаимодействие метил 7-арил(гетерил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов с мононуклеофильными реагентами.
При изучении химических свойств соединений (IIа-я) представляло научный и практический интерес провести реакции с ароматическими и алифатическими аминами.
Было установлено, что реакция метил 7-фенил-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов с пропиламином протекает при выдерживании исходных компонентов в течение суток при комнатной температуре с последующим нагреванием реакционной смеси до С в течение 20 минут с образованием N-пропил-7-фенил-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a] пиримидин-5-карбоксамида. (III).
Реакция метил 7-(2,4-дихлорфенил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a] пиримидин-5-карбоксилатов с 2-метоксианилином протекает при выдерживании исходных компонентов в течение часа при комнатной температуре и последующем нагревании реакционной смеси при 150 0С в течение 5-10 минут с образованием 7-(2,4-дихлорфенил)-6-(2-фураноил)-N-(2-метоксифенил)-4,7-дигидротетразоло[1,5-а] пиримидин-5-карбоксамида (IV).

III: R= C6H5; IV: R= 2,4–Cl2C6H3
Полученное соединение (III) представляет собой бесцветное кристаллическое вещество, нерастворимое в воде, этаноле, растворимое при нагревании в ледяной уксусной кислоте, ацетонитриле, хорошо растворимое в ДМСО, ДМФА.
Соединение (IV) представляет собой белое с серым оттенком кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, при нагревании растворимое в этаноле, диоксане, уксусной кислоте, нерастворимое в воде.
В спектре ЯМР1Н соединения (III) наблюдается сигнал С7Н протона при 6,20 м. д., группа линий ароматических протонов с центром при 6,30 м. д. и протонов гетероцикла от 6,90–7,55 м. д., триплет протонов метильной группы пропильного остатка при 0,85 м. д., мультиплет двух протонов пропильного остатка при 1,45 м. д., триплет протонов C1H2 при 2,65 м. д., уширенный сигнал NH-протона амидного остатка с центром при 8,50 м. д.
В ЯМР1Н–спектре соединения (IV) присутствует синглет С7Н протона при 7,42 м. д., группа линий ароматических протонов от 6.50-7.10 м. д., группа линий протонов гетероцикла от 7,30–7,80 м. д., синглет протонов CH3O-группы при 3,74 м. д.
3.1.1. Взаимодействие метил 7-тиенил-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a] пиримидин-5-карбоксилата с пропиламином

V
Было установлено, что реакция метил 7-тиенил-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилата с пропиламином протекает при выдерживании исходных компонентов в течение суток при комнатной температуре и дальнейшем нагревании реакционной смеси при С в течение 20 минут с образованием N-пропил-7-тиенил-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксамида. (V).
Полученное соединение (V) представляет собой бесцветное кристаллическое вещество, нерастворимое в воде, этаноле, растворимое при нагревании в ледяной уксусной кислоте, ацетонитриле, хорошо растворимое в ДМСО, ДМФА.
В спектре ЯМР1Н соединения (V) наблюдается сигнал С7Н протона при 7,70 м. д., группа линий протонов гетероцикла от 6,95–8,15 м. д., триплет протонов метильной группы пропильного остатка при 0,90 м. д., мультиплет двух протонов пропильного остатка при 1,55 м. д., триплет протонов C1H2 при 2,75 м. д., уширенный сигнал NH-протона амидного остатка с центром при 8,60 м. д.
3.2. Взаимодействие метил 7-арил(гетерил)-6-(2-тиеноил)-4,7-дигидротетразоло [1,5-a]пиримидин-5-карбоксилатов с бинуклеофильными реагентами.
Было установлено, что при выдерживании метил 7-арил(гетерил)-6-(2-тиенил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов с гидразингидратом при С до прекращения газовыделения образуются 5-оксо-8-тиенил-9-арил(гетерил)-4,9-дигидротетразоло[1',5':1,2]пиримидино[4,5-d]пиридазин-5-оны (VI а-я).
 VI а-я
VI а-я
R= Н (а); 4-СН3 (б); RС6Н4 = 2-тиенил (в); RС6Н4 = 2-фурил (г); 4-СН3О (д); 3-СН3О (е); 2-СН3О (ё); 4-Сl (ж); 2-Сl (з); 4-NO2 (и); 3-NO2 (й); 2-NO2 (к); 4-F (л); 3-F (м); 2-F (н); 4-Br (о); 3-Br (п); 4-С2Н5 (р); 4-(СН3)2СH (с); 4-(СН3)3С (т); 3,4-(СН3О)2 (у); 2,4-(СН3О)2 (ф); 2,5-(СН3О)2 (х); 4-СН3ОOC (ц); 4-OH-3-СН3О (ч); 4-OH-3-С2Н5О (ш); 2,4-Сl2 (щ); 4-С2Н5О (э); 3-OH (ю); 4-OH (я).
Данные соединения (VI а–я) представляют собой бесцветные кристаллические вещества, легкорастворимые в ДМСО, ДМФА, при нагревании растворимые в этаноле, диоксане, уксусной кислоте, нерастворимые в воде.
В ИК-спектрах соединений (VI а–я) наблюдаются полосы, обусловленные валентными колебаниями связи C=N и карбонильной группы в области см-1 и см-1 соответственно, а также полоса поглощения NH связей в области см-1.
В ЯМР1Н-спектрах соединений (VI а–я) наблюдается синглет С9Н протона при 6.75-7.49 м. д., группа линий ароматических протонов при 6.40-7.45 м. д., группа линий тиенильного фрагмента, которые прописываются в виде триплета при 6.50-7.30 м. д., двух дублетов при 6.95-7.90 и 7.40-8.00 м. д., синглет N4H-протона при 11.40-11.95 м. д., синглет N6H-протона при 13.20-13.50 м. д.
В масс-спектре соединения (VI ф) присутствует пик молекулярного иона с m/z: 409[M]+, а также пики фрагментных ионов с m/z: 381 [М–CO]+, 272 [M-(СН3О)2С6Н3]+, 110 [PhCH3О]+, 77 [Ph]+, что полностью соответствует указанной структуре.
Наличие сигналов в ЯМР1Н-спектрах соединений (VI а–я) дает возможность предположить существование полученных соединений в 2-х формах – лактамной (А) и лактимной (В). Образование соединений VI а–я, по-видимому, может протекать через промежуточный гидразон А или гидразид В. В пользу образования последнего свидетельствует получение N-пропил и N-ариламидов в реакции соединений I и II с нуклеофилами.
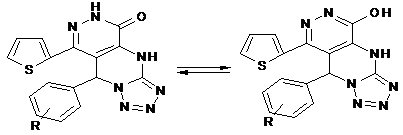
А В
Полученные соединения существуют преимущественно в лактамной форме (А), по-видимому, стабилизированной межмолекулярной водородной связью типа N-H…O=C.
3.2.1. Взаимодействие метил 7-арил(гетерил)-6-(2-фураноил)-4,7-дигидротетразоло [1,5-a]пиримидин-5-карбоксилатов с гидразингидратом и семикарбазида гидрохлоридом.
Было установлено, что при выдерживании метил 7-арил(гетерил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов с гидразингидратом при С до прекращения газовыделения образуются 5-оксо-8-(2-фурил)-9-фенил-4,9-дигидротетразоло[1',5':1,2] пиримидино[4,5-d]пиридазин-5-оны (VII а, б).
Данные соединения (VII а, б) представляют собой бесцветные кристаллические вещества, легкорастворимые в ДМСО, ДМФА, при нагревании растворимые в этаноле, диоксане, уксусной кислоте, нерастворимые в воде.
В ИК–спектрах соединений (VII а, б) наблюдаются полосы, обусловленные валентными колебаниями связи CN и карбонильной группы в области 1628(а), 1624(б) см-1 и 1672 см-1 (а, б) соответственно, а также полоса поглощения NH связей в области 3120 см-1 (а, б).
В ЯМР1Н спектрах полученных соединений (VII а, б) наблюдается сигнал C7H протона при 7,05 и 7,15 м. д., группа линий ароматических протонов с центром при 6,40 и 6,80 м. д., и протонов гетероцикла от 6,97–7,50 и 6,90–7,50 м. д., сигнал N4H-протона при 11,66 и 11,73 м. д., сигнал N6H протона при 13,28 и 13,33 м. д. соответственно. В ЯМР1Н спектре соединения (VII а) наблюдается сигнал CH3O-группы при 3,55 м. д. и сигнал OH-группы при 9,04 м. д. В ЯМР1Н спектре соединения (VII б) наблюдаются сигналы C2H5O-группы при 1,25 и 3,85 м. д.
Нами было изучено взаимодействие полученных метил 7-арил(гетерил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов с семикарбазидом. Проведенные исследования позволили установить, что реакция протекает при кратковременном кипячении исходных реагентов в присутствии КОН (безводный) с образованием метил 7-(2-хлорфенил)-6-[(2-карбомоилгидразоно)(2-фураноил)метил]-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилата. (VIII).
Соединение (VIII) представляет собой желтое кристаллическое вещество, растворимое в ДМФА, ДМСО, при нагревании растворимое в этаноле, уксусной кислоте, нерастворимое в воде.

(VII) R= 4-OH-3-СН3О (а); 4-С2Н5О (б).
(VIII) R= 2-Cl.
В ЯМР1Н спектре соединения (VIII) присутствует сигнал C7H протона при 7.25 м. д., группа линий ароматических протонов с центром при 7.10 м. д. и протонов гетероцикла от 6.40–7.50 м. д., уширенный сигнал N4H-протона с центом при 10.45 м. д., сигналы NH-протонов семикарбазидного остатка при 7.76, 8.67 и 9.29 м. д.
Данные ИК, ЯМР1Н спектров позволяют сделать вывод о существовании полученных соединений (VII а, б) преимущественно в лактамной форме (А), по-видимому, стабилизированной межмолекулярной водородной связью типа N-H…O=C.
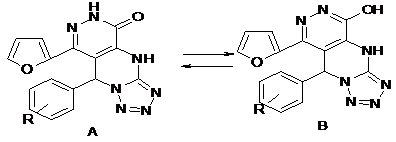
(VII)
4. Биологическая активность
У синтезированных веществ была изучена противомикробная, сахароснижающая активность и острая токсичность.
Противомикробная активность исследовалась на кафедре микробиологии с курсом гигиены и экологии под руководством зав. кафедрой, д. ф.н. Одеговой Татьяны Федоровны при участии ст. преподавателя, к. х.н. Винокуровой на противомикробную активность фармакологическому скринингу подвергнуто 102 соединения.
Острая токсичность и сахароснижающая активность исследована на кафедре фармакологии с курсом клинической фармакологии под руководством зав. кафедрой, д. м.н., профессора при участии аспирантов и Пестова фармакологическому скринингу подвергнуто 45 соединений. Кроме того, три наиболее активных вещества были подвергнуты углубленному изучению в условиях модельных опытов.
Животные содержались на стандартном пищевом режиме в условиях вивария. Исследования на животных выполнены в соответствии с Европейской конвенцией по защите и использованию позвоночных животных для экспериментальных и других целей EST №г.), ст. 37 и ст. 40 Федерального закона «О лекарственных средствах» (1998 г.), «Правилами лабораторной практики в Российской Федерации» (2003 г.), «Правилами проведения работ с использованием экспериментальных животных» и требованиями Фармкомитета РФ к проведению доклинических испытаний.
Статистическую обработку результатов проводили на персональном компьютере «Pentium-4» с вычислением среднего арифметического значения (М), ошибки средней арифметической (m), значений t и Р.
4.1. Острая токсичность
Опыты проведены на нелинейных животных обоего пола: 30 белых мышах массой 19-21 г. и 30 белых крысах массой 200-240 г.
При изучении острой токсичности наиболее активные вещества Iж, Iш и VI ш в виде суспензии на 1% крахмальной слизи вводили мышам внутрибрюшинно, а крысам – через рот. За их состоянием наблюдали 14 суток, после чего учитывали летальность в каждой группе и подсчитывали ЛД50 по методу Литчфилда - Уилкоксона.
Показано, что в токсических дозах соединения вызывали у животных паралич задних конечностей, ригидность мышц, судороги, потерю координации и нарастающее общее угнетение. Гибель части из них наступала в результате остановки дыхания.
Показано, что вещества Iж, Iш и VIш менее токсичны, чем эталоны сравнения, и, в соответствии с ГОСТ 12.1.007-76, могут быть отнесены к 4 классу опасности.
Таблица 1
Острая токсичность соединений I ж, I ш, VI ш
Серия опыта | R | ЛД50 мг/кг | |
Мыши, в/б | Крысы, ч/рот | ||
Iж | 4-Сl | 1¸1565) | 1¸2150) |
Iш | 4-OH-3-С2Н5О | 1¸1670) | 1¸2220) |
VIш | 4-OH-3-С2Н5О | 1¸1380) | 1¸1805) |
Метформин | ÷ 550) | 1÷ 2372) | |
Гликлазид | ÷ 575) | 1÷ 1760) |
4.2 Гипогликемическая активность
Гипогликемическая активность изучена у 45 производных метил-7-арил(гетерил)-6-(2-гетероил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов и 5-оксо-8-тиенил-9-арил(гетерил)-4,9-дигидротетразоло[1',5':1,2]пиримидино[4,5-d]пиридазин -5-онов.
Скрининговые исследования проведены на 282 самках белых нелинейных крыс массой 200-240г. С учетом малого количества субстанции изучаемые соединения инъецировали в/б на 1% крахмальной слизи в скрининговой дозе 25 мг/кг. В контроле использовали эквиобъемные количества крахмальной слизи. Содержание глюкозы в крови животных определяли глюкозооксидазным методом на биохимическом анализаторе Stat Fax 4500 до, а также спустя 3 и 5 час после введения веществ. Препаратами сравнения служили пероральные противодиабетические средства гликлазид (группа сульфонилмочевины) и метформин (группа бигуанида).
При оценке активности соединений, помимо достоверности отличий по сравнению с контролем, учитывалась стабильность их гипогликемического действия. Вещества с выраженным эффектом обеспечивали его сохранение на протяжении всего периода наблюдения, соединения с умеренным действием – только в одной временной точке.
По результатам проведенных скрининговых исследований показано, что выраженным гипогликемическим эффектом в ряду метил 7-арил(гетерил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов (I) обладают соединения 1д, 1ж и 1ш, снижающие уровень глюкозы в крови интактных крыс на 14,6-23,4% за 3 часа и на 18,8-27,3% за 5 часов наблюдения.
В ряду метил 7-арил(гетерил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a] пиримидин-5-карбоксилатов (II) выраженные сахароснижающие свойства отмечены у соединений IIй, IIц и IIэ, обеспечивших уменьшение гликемии у интактных крыс через 3 часа после введения на 13,3-21,4%, а через 5 часов – на 16,7-25,0%. Умеренную активность проявили при этом вещества IIм и IIш.
Среди 8-тиенил-9-фенил-4,9-дигидротетразоло[1’,5’:1,2]пиримидино[4,5-d] пиридазин-5-онов (VI) выраженное гипогликемическое действие отмечено у соединения VIш, снижавшего сахар крови спустя 3 часа после начала опыта на 20,0% и на 24,4% - спустя 5 часов. Вещества VIе, VIз и VIс проявили умеренный эффект, обеспечив уменьшение гликемии за 3 часа опыта на 12,3-15%.
По результатам фармакологического скрининга для углубленного исследования были выбраны соединения:
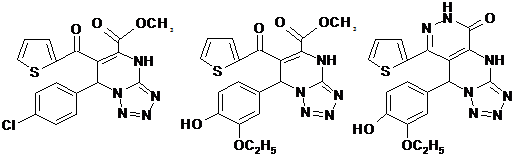
I ж I ш VI ш
Таблица 2
Гипогликемическая активность метил 7-арил(гетерил)-6-(2-гетероил)-4,7-дигидротетразоло[1,5-a] пиримидин -5-карбоксилатов и 5-оксо-8-тиенил-9-арил(гетерил)-4,9-дигидротетразоло [1',5':1,2]пиримидино[4,5-d]пиридазин-5-онов
Серия опыта | R | Уровень гликемии, ммоль/л | Изменение гликемии, % | |||
исходный | ч/з 3 час | ч/з 5 час | 3 час | 5 час | ||
I д | 4-СН3ОС6Н4 | 4,8 ± 0,18 | 4,1 ± 0,15 | 3,9 ± 0,24 | -14,6 ± 0,93* | -18,8 ± 2,64* |
I ж | 4-СlС6Н4 | 4,4 ± 0,26 | 3,4 ± 0,16 | 3,2 ± 0,31 | -22,7 ± 6,22* | -27,3 ± 5,65* |
I ш | 4-OH-3-С2Н5ОС6Н4 | 4,7 ± 0,08 | 3,6 ± 0,17 | 3,5 ± 0,14 | -23,4 ± 3,76* | -25,5 ± 3,11* |
II й | 3-NO2С6Н4 | 4,5 ± 0,21 | 3,9 ± 0,16 | 3,5 ± 0,16 | -13,3 ± 2,32* | -22,2 ± 2,31* |
II м | 3-FС6Н4 | 5,2 ± 0,24 | 4,6 ± 0,24 | 4,4 ± 0,21 | -11,5 ± 1,75* | -15,4 ± 5,77 |
II ц | 4-СН3ОOCС6Н4 | 4,2 ± 0,10 | 3,3 ± 0,18 | 3,5 ± 0,10 | -21,4 ± 3,18* | -16,7 ± 1,72* |
II ш | 4-OH-3-С2Н5ОС6Н4 | 4,6 ± 0,19 | 4,2 ± 0,18 | 3,7 ± 0,24 | -8,7 ± 4,99 | -19,6 ± 2,84* |
II э | 4-С2Н5ОС6Н4 | 4,4 ± 0,16 | 3,5 ± 0,13 | 3,3 ± 0,19 | -20,5 ± 3,92* | -25,0 ± 3,18* |
VI е | 3-СН3ОС6Н4 | 4,0 ± 0,19 | 3,4 ± 0,18 | 3,6 ± 0,26 | -15,0 ± 3,11* | -10,0 ± 4,87 |
VI з | 2-СlС6Н4 | 5,7 ± 0,35 | 5,0 ± 0,32 | 5,2 ± 0,37 | -12,3 ± 1,59* | -8,8 ± 2,99 |
VI с | 4-(СН3)2С6Н4 | 4,9 ± 0,27 | 4,2 ± 0,16 | 4,5 ± 0,18 | -14,3 ± 2,38* | -8,2 ± 5,00 |
VI ш | 4-OH-3-С2Н5ОС6Н4 | 4,5 ± 0,19 | 3,6 ± 0,15 | 3,4 ± 0,23 | -20,0 ± 3,46* | -24,4 ± 2,14* |
Контроль | 4,0 ± 0,16 | 3,8 ± 0,15 | 3,8 ± 0,18 | -5,0± 2,02 | -5,0 ± 1,13 | |
Гликлазид | 4,3 ± 0,17 | 2,9 ± 0,13 | 3,7 ± 0,07 | -32,5 ± 3,6* | -14,0 ± 1,9* | |
Метформин | 5,1 ± 0,11 | 5,3 ± 0,18 | 5,4 ± 0,16 | +3,9 ± 4,1 | +5,9 ± 2,8* |
Примечание: достоверность отличий по сравнению с контролем при P ≤ 0,05 - *.
По характеру влияния на уровень гликемии интактных крыс соединения Iж, Iш и VIш принципиально отличаются от производных бигуанида (метформин), действующих гипергликемически, и приближаются к производным сульфонилмочевины (гликлазид), снижающих сахар крови.
Соединения Iж, Iш и VIш были подвергнуты углубленному исследованию в условиях их ежедневного перорального введения самцам белых нелинейных крыс массой 220-240г. на протяжении 1,5 месяцев. Сравниваемые вещества использовали в эквитоксических дозах, равных 0,033 ЛД50, вычисленной для крыс при введении им веществ через рот: Iж – по 55 мг/кг, Iш – по 56 мг/кг, VIш и гликлазид – по 47 мг/кг, метформин – по 53 мг/кг (табл.1). В конце исследования у всех 36 животных изучали характер гликемической кривой после пероральной нагрузки глюкозой из расчета 2 г/кг и в/б инъекции им инсулина «актрапид» по 1,0 ЕД/кг. В дискретные интервалы времени в крови крыс с помощью глюкозооксидазного метода определяли концентрацию глюкозы.
Все три изучаемых соединения повышали толерантность к вводимой глюкозе: вещества I ж и VI ш – в самом конце 3-х - часового исследования, вещество I ш – на всём его протяжении. Соединения I ж и VI ш, кроме того, в конце опыта значительно усиливали сахароснижающее действие инсулина.
4.2. Противомикробная активность
Противомикробную активность определяли методом серийных разведений 102 исследуемых соединений в жидкой питательной среде, оценивая первую по отношению к грамотрицательным бактериям – кишечной палочке (E. Coli) и грамположительным бактериям – золотистому стафилококку (St. Аureus).
Исследуемые вещества растворяли в диметилформамиде в соотношении 1:100 и затем разводили мясопептонным бульоном (МПБ). Рабочий раствор готовили разведением бактериальной культуры с концентрацией 5 млн. микробных клеток в 1мл, который в количестве 0,1 мл вносили в 2 мл МПБ. В результате бактериальная нагрузка на 1 мл культуральной жидкости составляла 250000 микробных клеток. Результаты опытов оценивали после 18 – 20 часов выдержки контрольных и опытных образцов в термостате при температуре 36 – 37ºС. Регистрировали наличие роста бактериальных культур или торможения за счет бактериостатического действия соединений. Бактериостатическую активность соединений оценивали по величине минимальной подавляющей концентрации (МПК) в мкг/мл, которая задерживала рост бактериальных культур. Противомикробная активность была исследована у 102 соединений
Практически все испытанные вещества показали антибактериальную активность, приближаясь по противомикробному действию к антисептикам – фурацилину (МПК 250 мкг/мл в отношении St. Аureus и МПК 125 мкг/мл в отношении E. Coli) и диоксидину (МПК 1000-62 мкг/мл в отношении St. Аureus и МПК 62-3,9 мкг/мл в отношении E. Coli).
При анализе соединений ряда I а-я наибольшую активность проявило соединение I л, минимальная подавляющая концентрация которого составила 125 мкг/мл в отношении St. Аureus и 250 мкг/мл E. Coli. В результате исследований обнаружены соединения I н, п, щ, э, которые по силе противомикробного действия сходны с веществом-эталоном – фурацилином в отношении золотистого стафилококка (соед. I н, п, щ, э составляет 250 мкг/мл), а также соединения, приближающиеся по силе антимикробного действия к эталону в отношении кишечной палочки (соед. I л, н, ч, щ, э составляет 250 мкг/мл).
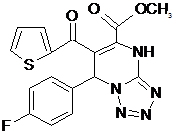
Iл
Замечено, что при введении атомов F, Cl и Br активность полученных соединений I повышается как в отношении E. Coli, так и в отношении и St. Аureus. По-видимому, это объясняется электроноакцепторными свойствами атомов галогенов. Так же при введении в п - положение этоксигруппы активность повышается как в отношении E. Coli, так и в отношении и St. Аureus – 250 мкг/мл.
При анализе соединений ряда II а-с, ч наибольшую активность проявило соединение II й. Замечено повышение противомикробного действия при введении нитрогруппы в положение 3 остатка альдегида – минимальная подавляющая концентрация составляет 500 мкг/мл в отношении E. Coli и 250 мкг/мл в отношении St. Аureus, по-видимому, это связано с электроноакцепторными свойствами нитрогруппы.
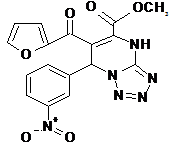
II й
При анализе соединений ряда VI а-я наибольшую активность проявили соединения VI а, б, минимальная подавляющая концентрация которых составила 250 мкг/мл в отношении St. Аureus и E. Coli.

VI а VI б
Основываясь на результатах предварительного исследования противомикробной активности можно сделать вывод, что соединения в целом обладают антимикробной активностью, близкой к эффектам фурацилина.
ВЫВОДЫ
1. На основании трехкомпонентной реакции метиловых эфиров гетероилпировиноградных кислот со смесью ароматического (гетероциклического) альдегида и 5-аминотетразола разработан синтез метил 7-арил(гетерил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-а] пиримидин-5-карбоксилатов, метил 7-арил(гетерил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов.
2. Обнаружено, что при взаимодействии полученных соединений с гидразингидратом образуются 5-оксо-8-тиенил-9-арил(гетерил)-4,9-дигидротетразоло[1',5':1,2] пиримидино[4,5-d]пиридазин-5-оны и 5-оксо-8-фурил-9-арил(гетерил)-4,9-дигидротетразоло[1',5':1,2]пиримидино[4,5-d] пиридазин-5-оны.
3. Найдено, что реакция метил 7-фенил-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a] пиримидин-5-карбоксилата с алифатическим амином (пропиламином) проходит с образованием N-пропил-7-фенил-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a] пиримидин-5-карбоксамида.
4. Установлено, что реакция метил 7-(2,4-дихлорфенил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилата с 2-метоксианилином протекает с образованием 7-(2,4-дихлорфенил)-6-(2-фураноил)-N-(2-метоксифенил)-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксамида.
5. Впервые показано, что при взаимодействии метил 7-(2-хлорфенил)-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилата с семикарбазида гидрохлоридом образуется метил 7-(2-хлорфенил)-6-[(2-карбомоилгидразоно)(2-фураноил)метил]-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилаты.
6. В результате исследований 107 полученных соединений, обнаружены малотоксичные вещества, обладающие противомикробной и сахароснижающей видами активности, установлена зависимость между биологической активностью соединений и их структурой. На основании ИК, ЯМР1Н, масс-спектров и рентгеноструктурного анализа установлена их структура.
7. Для более углубленного изучения рекомендуются: метил 7-(4-хлорфенил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилат; метил 7-(4-гидрокси-3-этоксифенил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилат; 5-оксо-8-тиенил-9-(4-гидрокси-3-этоксифенил)-4,9-дигидротетразоло[1',5':1,2] пиримидино[4,5-d]пиридазин-5-он, обладающие гипогликемическим действием, повышающие устойчивость к нагрузке глюкозой и усиливающие сахароснижающие свойства экзогенного инсулина.
Основные результаты исследований отражены в работах:
1. Гейн и противомикробная активность метил 7-арил-(гетерил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов / , , [и др.] // Хим. фармац. журнТ. 43, №12. - С.
2. Мишунин и свойства метил 7-арил-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов / , , // Тезисы докладов Всероссийской конференции по органической химии, посвященной 75-летию со дня рождения Института органической химии им. . – Москва, 2009. – С. 303
3. Гейн и свойства метил 6-ароил-4,7-дигидро-7-арилтетразоло[1,5-а] пиримидин-5-карбоксилатов / , , [и др.] // Вестник ПГФА№2. – С. 110
4. Мишунин и противомикробная активность метил 7-арил-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов / , , // Вестник ПГФА№5. – С.
5. Мишунин и противомикробная активность метил 7-арил(гетерил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов / , , // Тезисы докладов II международной конференции «Техническая химия. От теории к практике», посвященной 25-летию со дня основания Института технической химии УрО РАН – Пермь, 2010. – С.
6. Мишунин и свойства метил 7-арил(гетерил)-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов / , , // Материалы 5-ой международной конференции по органической химии для молодых ученых (InterYCOS-2009). – Санкт-Петербург, 2009. – С.
7. Гейн и свойства 7-фенил-6-(2-фураноил)-5-метоксикарбонил-4,7-дигидротетразоло[1,5-a]пиримидина / , , // Материалы Международной конференции. – Кисловодск, 2009. – С. 296.
8. Мишунин и противомикробная активность метил 7-арил-6-(2-тиеноил)-4,7-дигидротетразоло[1,5-a]пиримидин-5-карбоксилатов / , , // Вестник ПГФА№6. – С.
9. Мишунин и свойства 7-фенил-6-(2-фураноил)-4,7-дигидротетразоло[1,5-a]пиримидина / , , // Материалы региональной научной конференции «35 лет синтеза фурандионов». – Пермь, 2008. – С.40.
10. Мишунин 5-арил(гетерил)-β-гетероил-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов с аминами / , , [и др.] // Материалы 68-й открытой научно-практической конференции «Актуальные проблемы экспериментальной и клинической медицины». – Волгоград. – 2010. – С. 317.
11. , , . Синтез метил 7-арил(гетерил)-6-гетероил-4,7-дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов. Межвузовский сборник научных трудов «Современные проблемы теоретической и экспериментальной химии» - Саратов – 2007.
12. Гейн , свойства и противомикробная активность 7-бензоил-6-фураноил-5-метоксикарбонил-4,7-дигидротетразоло[1,5-а]пиримидинов / , , // Журн. «Современные проблемы науки и образования». – 2008. – №4. – С. 46.
13. УДК: 547.796.1:54.057.001.8. , , . Синтез и противомикробная активность N–пропил–7–фенил–6–фураноил–4,7–дигидротетразоло[1,5–а]пиримидин–5–карбоксамида. Материалы V международной медико-фармацевтической конференции студентов и молодых учёных (82-й ежегодный научный форум).
14. *, , . Синтез, свойства и противомикробная активность метил 7-арил-6-тиеноил-4,7-дигидротетразоло[1,5-а] пиримидинов. Материалы конференции «Фармация и общественное здоровье». – Екатеринбург. – 2008. – С. 58.
15. , , . Синтез, свойства и противомикробная активность метил 7-арил(гетерил)-6-гетероил-4,7- дигидротетразоло[1,5-а]пиримидин-5-карбоксилатов. Труды научно-практической конференции «Фармация из века в век». Часть V. Синтез биологически активных веществ для создания фармацевтических субстанций. Фармакологические исследования. – Санкт-Петербург, 2008. – С 123 – 124.




