Поскольку в данной работе было показано, что на этапе первичной интеграции транспозиция mini-Mu в хромосому M. methylotrophus происходит с высокой эффективностью, способность интегративных плазмид к мобилизационному переносу теперь не являлась обязательным условием. Поэтому новые интегративные векторы вводили в клетки M. methylotrophus, содержащие хелперную плазмиду с генами транспозазы, с помощью электропорации. Интеграцию и амплификацию проводили с использованием нестабильной хелперной плазмиды pTP310 в условиях термоиндукции синтеза факторов транспозиции. Частота амплификации (относительно общего количества клеток, взятых для индукции транспозиции) составила для контрольного mini-Mu транспозона {[FRT-KmR-FRT]-SmR} – 10-4, тогда как для транспозона {[FRT-KmR-FRT]-IAS-SmR}, содержащего энхансерную последовательность, была на два порядка выше – 2 х 10-2. Гибридизация по Саузерну (Рис. 8) показала, что в результате амплификации количество копий транспозона {[FRT-KmR-FRT]-IAS-SmR}, содержащего энхансер, увеличилось до 3-5 на хромосому, в то время как в контрольном штамме была зарегистрирована лишь одна дополнительная копия mini-Mu.
Следовательно, в результате проведенной модификации не только частота, но и множественность внутримолекулярной транспозиции mini-Mu в геноме M. methylotrophus существенно возросла и по эффективности стала сравнима с известными системами интеграции рекомбинантной ДНК на основе бактериофага Mu в E. coli ( и др., 2007; и др., 2007). Это позволяет использовать модифицированную нами систему, как для интеграции, так и для последующей амплификации целевых генов в хромосоме этих бактерий.
А. Б.
8 9
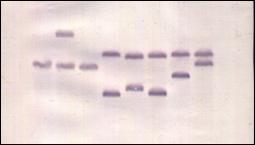
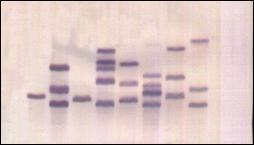
Рис. 8 Результаты ДНК-гибридизации по Саузерну клонов M. methylotrophus AS1, содержащих в хромосоме копии mini-Mu транспозона: А – {[FRT-KmR-FRT]-SmR}, Б – {[FRT-KmR-FRT]-IAS-SmR} Изолированная из клеток хромосомная ДНК была гидролизована нуклеазой EcoRV, полученные в результате фрагменты ДНК разделены с помощью электрофореза в агарозном геле и гибридизованы с меченым зондом: дорожка 1 – контроль – результат первичной интеграции mini-Mu в хромосому (устойчивость к SmR - 500 мг/л), дорожки 2 - 8 – результат амплификации mini-Mu в хромосоме (устойчивость к SmR – 2 г/л), дорожка 9 – отрицательный контроль – M. methylotrophus AS1.
1.8. Использование гена ZsGreen Zoanthus sp. в качестве селективного маркера для амплификации mini-Mu в хромосоме M. methylotrophus.
К сожалению, вторая копия транспозона {[FRT-KmR-FRT]-SmR} уже обеспечивает устойчивость штамма к высоким концентрациям Sm (до 10 мг/ мл), что не позволяет использовать селекцию на стрептомицине, чтобы различать варианты с высоким и низким уровнем амплификации mini-Mu. Кроме того, как показали результаты гибридизации (Рис. 8, дорожки 4 А и 4 Б), на используемой в наших экспериментах концентрации стрептомицина 2 г/л, могут образовываться мутанты, обладающие высокой устойчивостью к антибиотику, что, в свою очередь, является неудобным с точки зрения практического применения стрептомицина в качестве селективного маркера. Поэтому, как возможный дополнительный маркер для селекции вариантов с большим уровнем амплификации, был выбран ген ZsGreen морского полипа рода Zoanthus sp., кодирующий зеленый флуоресцентный белок GFP (green fluorescent protein). Уровень экспрессии ZsGreen может быть измерен количественно, с помощью метода спектрофлуорофотометрии (Penna V. et al., 2004). Уже на этапе первичной интеграции, как для контрольного {[FRT-KmR-FRT]-SmR-GFP}, так и для транспозона, содержащего энхансер {[FRT-KmR-FRT]-IAS-SmR-GFP}, были отобраны клоны, различающиеся по удельной флуоресценции приблизительно в 2 – 3 раза. Корреляция между количеством интегрированных в хромосому копий mini-Mu и удельной флуоресценцией GFP была подтверждена гибридизацией по Саузерну (Таблица 1, Рис. 9). Как видно из результатов гибридизации, действительно, клоны, содержащие две интегрированные единицы транспозона в составе генома (Таблица 1, Рис 9 №2 и №5), имели уровень удельной флуоресценции GFP в 2-3 раза превышающий уровень удельной флуоресценции вариантов с единственной копией mini-Mu в хромосоме.
Таблица 1. Значения удельной флуоресценции GFP клонов M. methylotrophus AS1, отобранных в результате первичной интеграции mini-Mu транспозонов: {[FRT-KmR-FRT]-SmR-GFP} или {[FRT-KmR-FRT]-IAS-SmR-GFP} в хромосому.
№ | Штамм | ОП 600 | Удельная флуоресценция GFP |
1 | M. methylotrophus AS1 | 0,431 | 0 |
2 | M. methylotrophus AS1::SmR-GFP (1) | 0,412 | 6194 |
3 | M. methylotrophus AS1::SmR-GFP (2) | 0,447 | 3045 |
4 | M. methylotrophus AS1::SmR-GFP (6) | 0,421 | 3401 |
5 | M. methylotrophus AS1::IAS-SmR-GFP (4) | 0,412 | 11019 |
6 | M. methylotrophus AS1::IAS-SmR-GFP (2) | 0,588 | 3673 |
7 | M. methylotrophus AS1::IAS-SmR-GFP (3) | 0,327 | 3624 |

Рис. 9. Результаты ДНК-гибридизации по Саузерну клонов M. methylotrophus AS1, отобранных в результате первичной интеграции mini-Mu транспозонов: {[FRT-KmR-FRT]-SmR-GFP} или {[FRT-KmR-FRT]-IAS-SmR-GFP} в хромосому. Изолированная из клеток хромосомная ДНК была гидролизована нуклеазой Mph1103I, полученные в результате фрагменты ДНК разделены с помощью электрофореза в агарозном геле и гибридизованы с меченым зондом: дорожка 1 – контроль – M. methylotrophus AS1, дорожка 2 – M. methylotrophus AS1::SmR-GFP (1), дорожка 3 – M. methylotrophus AS1::SmR-GFP (2), дорожка 4 – M. methylotrophus AS1::SmR-GFP (6), дорожка 5 – M. methylotrophus AS1::IAS-SmR-GFP (4), дорожка 6 – M. methylotrophus AS1::IAS-SmR-GFP (2), дорожка 7 – M. methylotrophus AS1::IAS-SmR-GFP (3).
Эксперименты по амлификации {[FRT-KmR-FRT]-SmR-GFP} и {[FRT-KmR-FRT]-IAS-SmR-GFP} в хромосоме подтвердили наши предыдущие результаты относительно позитивного влияния энхансера, расположенного в составе mini-Mu, на эффективность репликативной транспозиции mini-Mu в M. methylotrophus. Частота амплификации транспозона {[FRT-KmR-FRT]-IAS-SmR-GFP}, содержащего энхансерную последовательность, была на два порядка выше (10-2), чем контрольного (10-4), а об уровне внутрихромосомальной транспозиции каждого из исследуемых mini-Mu можно было судить по уровню удельной флуоресценции (Таблица 2).
Из таблицы 2 видно, что удельная флуоресценция клонов, отобранных после процедуры амплификации mini-Mu, возросла для обоих вариантов транспозонов. Однако, как и следовало ожидать, для транспозона {[FRT-KmR-FRT]-SmR-GFP} значения удельной флуоресценции GFP превышали уровень контрольного клона только в два – три раза, тогда как для транспозона {[FRT-KmR-FRT]-IAS-SmR-GFP}, в некоторых случаях – больше чем на порядок, что соответствует множественной хромосомальной амплификации транспозона.
Таблица 2. Значения удельной флуоресценции GFP клонов M. methylotrophus AS1::SmR-GFP (6) и M. methylotrophus AS1::IAS-SmR-GFP (2), отобранных после процедуры амплификации mini-Mu в хромосоме.
№ | Штамм | ОП 600 | Удельная флуоресценция GFP |
1 | M. methylotrophus AS1 | 0,227 | 0 |
2 | M. methylotrophus AS1::SmR-GFP (6) | 0,276 | 3837 |
3 | M. methylotrophus AS1::SmR-GFP (6/1) | 0,239 | 5552 |
4 | M. methylotrophus AS1::SmR-GFP (6/2) | 0,311 | 11820 |
5 | M. methylotrophus AS1::SmR-GFP (6/3) | 0,213 | 9542 |
6 | M. methylotrophus AS1::SmR-GFP (6/4) | 0,218 | 10001 |
7 | M. methylotrophus AS1::IAS-SmR-GFP (2) | 0,327 | 3821 |
8 | M. methylotrophus AS1::IAS-SmR-GFP (2/1) | 0,347 | 35516 |
9 | M. methylotrophus AS1::IAS-SmR-GFP (2/2) | 0,234 | 52605 |
10 | M. methylotrophus AS1::IAS-SmR-GFP (2/3) | 0,254 | 32919 |
11 | M. methylotrophus AS1::IAS-SmR-GFP (2/4) | 0,221 | 52482 |
Последующая гибридизация подтвердила корреляцию между количеством интегрированных копий mini-Mu и удельной флуоресценцией GFP и, хотя четкой линейной зависимости, позволяющей с точностью до одной копии определять уровень внутримолекулярной амплификации транспозона выявлено не было, однако возможность достоверно различать варианты с высоким (более 5) и низким (2 копии) уровнем транспозиции была показана. Это означает, что ген ZsGreen может быть успешно использован в качестве селективного маркера для отбора вариантов с большим уровнем амплификации целевых фрагментов ДНК в хромосоме M. methylotrophus. Следует также отметить, что высокая эффективность разработанной и усовершенствованной в этой работе системы позволяет теперь использовать транспозицию фага Mu для коструирования бесплазмидных безмаркерных штаммов-продуцентов на основе M. methylotrophus, в том числе и без применения вырезаемых маркеров для селекции генетических модификаций.
Безусловно, исследование фундаментальных аспектов Mu-зависимой транспозиции в клетках метилотрофов требует дальнейших экспериментов, но разработанная система уже в настоящее время может и реально используется для направленной модификации штаммов M. methylotrophus, проведения с этими бактериями различных экспериментов по метаболической инженерии (Tokmakova I. et al., 2007) с целью создания новых продуцентов биологически активных соединений, пригодных для биотехнологического производства. В частности, разработанная и усовершенствованная в этой работе система интеграции рекомбинантной ДНК в хромосому была успешно использована в АГРИ при конструировании на основе облигатного метилотрофа M. methylotrophus AS1 бесплазмидного и безмаркерного штамма-продуцента L-фенилаланина.
2. Создание коллекции ауксотрофных мутантов c нарушенным биосинтезом ароматических аминокислот у Methylophilus methylotrophus AS1::aroPEco .
Следующей нашей задачей было отобрать мутантные варианты M. methylotrophus AS1, дефектные по синтезу ароматических соединений. Для этого мы использовали различные формы мутагенеза с помощью N-метил-N’-нитро-N-нитрозогуанидина (МННГ), применяя как стандартные, описанные для штаммов E. coli протоколы (Miller J., 1972), так и специально модифицированные для M. methylotrophus AS1 (Gunji Y. et al., 2004; Kim C. and Wood T., 1997) и M. flagellatus KT методы (Tsygankov Y. and Kasakova S., 1987), известные в настоящее время в литературе. Несмотря на то, что было проанализировано более чем 200000 отобранных после мутагенеза клонов, ни одного мутанта c нарушенным синтезом ароматических соединений обнаружить не удалось. В то же время, мутанты устойчивые к высоким концентрациям L-фенилаланина (Phe) или к его неметаболизируемым аналогам DL-фторофенилаланину и мета-фторофенилаланину возникали и могли быть изолированы в результате метода химического мутагенеза с частотой, характерной для штаммов E. coli. Кроме того, в ходе нашей работы мы обнаружили, что базальный уровень устойчивости M. methylotrophus AS1 к некоторым токсичным для роста клетки соединениям, в частности 5-метилтриптофану и L-валину более чем в 100 раз выше, чем клеток E.coli. Одним из объяснений наших неудачных попыток в селекции ауксотрофов могла быть низкая проницаемость некоторых метаболитов (аминокислот и витаминов, в частности) через цитоплазматическую мембрану из селективной среды и, как следствие, гибель потенциальных ауксотрофов.
2.1. Влияние амплификации генов aroP и brnQ E. coli на чувствительность M. methylotrophus AS1 к аналогам ароматических аминокислот и валину.
С целью увеличить проницаемость мембраны M. methylotrophus для ароматических аминокислот было решено ввести в клетки M. methylotrophus рекомбинантную плазмиду, содержащую ген aroP E. coli (aroPEco). Пермеаза АroPEco принадлежит к APC (аmino acid/polyamine-organic cation) суперсемейству белков-транспортеров (Young G. et al., 1999) и обеспечивает протон-зависимый транспорт ароматических аминокислот Phe, Tyr и Trp через внутреннюю мембрану E. coli из периплазмы в цитоплазму. (Cosgriff A. et al., 2000; Cosgriff A. and Pittard A., 1997) В качестве контрольного для демонстрации субстратной специфичности выбранного нами транспортера был использован другой ген E. coli brnQ (brnQEco). Белковый продукт гена brnQEco имеет высокую гомологию с ортологом S. typhimurium, который принадлежит к LIVCS (branched chain amino acid:cation symporter) семейству транспортных белков и функционирует как Na+-зависимый симпортер разветвленных аминокислот (sodium / branched-chain amino acid (BCAA)) (Ohnishi K. et al., 1988).
Как можно видеть из результатов, представленных в таблице 3, присутствие aroPEco существенно увеличило чувствительность M. methylotrophus к аналогу ароматических аминокислот 5-метилтриптофану, но совсем не повлияло на высокую устойчивость к L-валину. В отличие от этого амплификация гена brnQEco наоборот сообщала метилотрофным клеткам в сравнении с контрольным штаммом высокую чувствительность к L-Val и не меняла их устойчивости к 5-метилтриптофану.
Таблица 3. Устойчивость штаммов M. methylotrophus AS1, содержащих плазмиды pAYCTER3 (контроль), pAYCTER3-aroPEco и pAYCTER3-brnQEco, к 5-метилтриптофану и L-валину на минимальной агаризованной среде SEIIa с добавлением 1% метанола.
Штамм | Рост в присутствии | |||||||
5-метилтриптофан | L-Val | |||||||
0 | 5 мг/л | 10 мг/л | 50 мг/л | 0 | 1 г/л | 2,5 г/л | 5 г/л | |
M. methylotrophus AS1 pAYCTER3 | + | + | + | + | + | + | + | + |
M. methylotrophus AS1 pAYCTER-aroPEco | + | - | - | - | + | + | + | + |
M. methylotrophus AS1:: aroPEco | + | - | - | - | + | + | + | + |
M. methylotrophus AS1 pAYCTER-brnQEco | + | + | + | + | + | - | - | - |
Вероятнее всего введение транспортеров аминокислот E. coli специфически увеличивает проницаемость внутренней цитоплазматической мембраны M. methylotrophus для соответствующих аминокислот и их аналогов. Можно было ожидать, что использование метилотрофного штамма с экспрессий гетерологичного белка АroPEco позволит нам получить группу ауксотрофных мутантов по биосинтезу ароматических соединений. Для этого на первом этапе ген aroPEco был интегрирован в бактериальную хромосому M. methylotrophus AS1 с помощью разработанной нами интегративной системы на основе транспозиции бактериофага Mu. Полученный таким образом бесплазмидный безмаркерный штамм M. methylotrophus AS1::aroPEco имел уровень чувствительности к 5-метилтриптофану такой же как штамм, содержащий плазмиду pAYCTER3-aroPEco (Таблица 3) и, следовательно, мог быть использован в дальнейших экспериментах по созданию ауксотрофных мутантов.
2.2. Клонирование генов trpEGDMme через функциональную комплементацию trpE мутанта E. coli и инактивация trpE в хромосоме M. Methylotrophus AS1.
На следующем этапе нашей работы гены, кодирующие ферменты ароматического пути биосинтеза, были клонированы из хромосомы M. methylotrophus AS1 методом «shotgun» по комлементации соответствующих ауксотрофных мутантов E.coli К-12 из Кео коллекции (Baba et al., 2006) и секвенированы методом Сенгера (Рис. 10, 12).
В результате анализа нуклеотидной последовательности фрагмента хромосомы M. methylotrophus (5227 п. н.), который комплементировал trpE мутацию E. coli JW1256-∆trpE, в его составе было обнаружено пять транскрибирющихся в одном направлении открытых рамок считывания (ORFs) (Рис. 10 А). Сравнение аминокислотной последовательности предполагаемых белковых продуктов с белками M. flagellatus KT с использованием программы BLAST выявил высокий уровень гомологии трех первых ORFs c известными TrpEGD субъединицами антранилат синтазы, глутамин-амидотрансферазы, антранилат фосфорибозил трансферазы (ЕС 4.1.3.27/2.4.2.18), а последней – с индол-3-глицерол фосфат синтазой/ N-5-фосфорибозил антранилат изомеразой (EC 5.3.1.24/4.1.1.48) M. flagellatus KT (77.3% идентичных аминокислот для TrpE, 83.3% для TrpG, 85,5% для TrpD и 74,9% для ТrpC) (Рис. 10 Б).
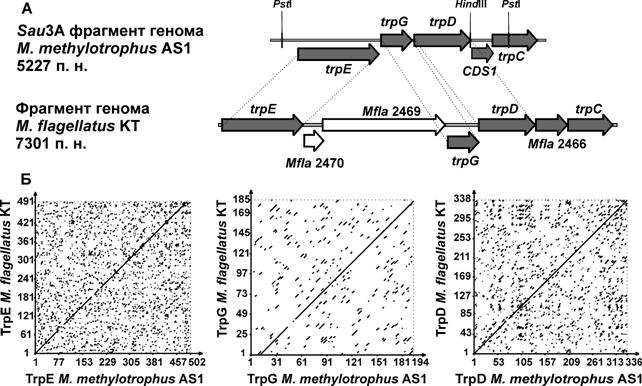
Рис. 10. (А) Генетическая организация клонированного в этой работе Sau 3A (Bsp143I) фрагмента ДНК хромосомы M. methylotrophus AS1 и фрагмента хромосомы M. flаgellatus KT, содержащих гены пути биосинтеза триптофана. (Б) Сравнение аминокислотной последовательности предполагаемых белковых продуктов с белками M. flagellatus KT.
Для того, чтобы сконструировать штамм M. methylotrophus AS1, мутантный по биосинтезу Trp, предполагаемый ген trpEMme в составе клонированного фрагмента был нарушен в результате встраивания в структурную часть гена, ПЦР фрагмента, содержащего вырезаемый маркер [FRT-KmR-FRT]. Для предотвращения возможного «полярного эффекта» при транскрипции дистально расположенных генов конструирование и встраивание KmR-маркера в trpEMme проводили таким образом, чтобы после интеграции в хромосому M. methylotrophus AS1 и FLP-зависимого удаления канамицина, оставшаяся в хромосоме «scar» последовательность, содержащая FRT, не приводила к сдвигу рамки считывания «downstream» области хромосомальной ДНК (Рис. 11А).
Линейный фрагмент ДНК, содержащий trpEMme::[FRT-KmR-FRT], был введен электропорацией в штамм M. methylotrophus AS1::aroPEco с целью получения KmR колоний. Длина гомологии участков ДНК, фланкирующих с двух сторон маркер KmR, с хромосомой M. methylotrophus в этом случае составляла более 2000 пар нуклеотидов. Селективный отбор целевых клонов проводили на минимальной среде SEII c добавлением 2 % метанола и 100 мг/л L-триптофана. В качесте контроля дикий тип M. methylotrophus AS1 был использован как реципиент в аналогичных экспериментах по электропорации фрагмента trpEMme::[FRT-KmR-FRT]. Приблизительно 100 KmR рекомбинантных колоний, не способных расти без добавления L-триптофана в питательную среду, были изолированы в случае, когда мы использовали в качестве реципиена штамм M. methylotrophus AS1:: aroPEco, но ни одного ауксотрофного мутанта нам не удалось отобрать в тех же условиях, когда реципиентом являлся контрольный штамм M. methylotrophus AS1. Наличие KmR маркера в геноме M. methylotrophus AS1::aroPEco и инактивация trpEMme в результате гомологичной рекомбинации между линейным фрагментом ДНК, содержащим trpEMme::[FRT-KmR-FRT], и бактериальной хромосомой были подтверждены с помощью ПЦР (Рис. 11 В).
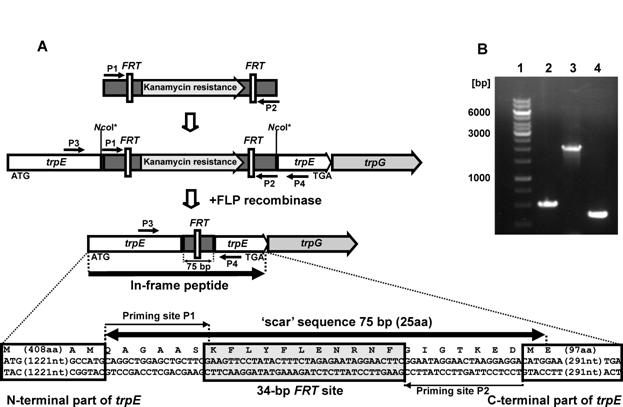
Рис. 11. (А) Схема конструирования «in frame» инсерционных мутантов и структура остаточной после FLP-зависимого удаления маркера KmR «scar» последовательности на примере инактивации гена trpE M. methylotrophus. Праймеры Р1 и Р2 использованы для ПЦР-амплификации маркера KmR из pKD4, праймеры P3 и P4 – для подтверждения целевой инсерции в хромосоме. (B) Подтверждение инсерционной мутации гена trpE в хромосоме M. methylotrophus – электрофорез в агарозном геле: дорожка 1 – маркер, дорожка 2 – ПЦР продукт хромосомы M. methylotrophus AS1::aroPEco с праймеров P3 и P4, дорожка 3 – ПЦР продукт хромосомы M. methylotrophus AS1::aroPEco-trpEMme::[FRT-KmR-FRT] с праймеров P3 и P4, дорожка 4 – ПЦР продукт хромосомы M. methylotrophus AS1::aroPEco-trpEMme::FRT с праймеров P1 и P4.
Далее было проведено вырезание селективного маркера из хромосомы двух отделено взятых колоний M. methylotrophus AS1::aroPEco-trpEMme::[FRT-KmR-FRT. Приблизительно 90% полученных в результате клонов имели фенотип KmS. Удаление маркера из хромосомы с сохранением 75 нуклеотидов, содержащих сайт узнавания FLP-рекомбиназы FRT, в виде «scar» последовательности, локализованной в структурной части гена trpEMme, было подтверждено методом ПЦР (Рис. 11 В). Как и следовало ожидать, все KmS клоны сохраняли Trp - фенотип.
Таким образом, мы смогли получить стабильный безмаркерный ауксотрофный штамм M. methylotrophus AS1::aroPEco-trpEMme::FRT, используя (1) специально сконструированный реципиентный штамм с геном транспортера aroPEco, интегрированным в хромосому; (2) линейный фрагмент ДНК, содержащий ген trpEMme, инактивированный вырезаемым маркером KmR; (3) метод обмена маркером между линейным фрагментом ДНК и бактериальной хромосомой с использованием механизма общей рекомбинации и (4) систему FLP-FRT-зависимой рекомбинации для удаления селективного маркера.
2.3. Клонирование и инактивация генов M. methylotrophus AS1, вовлеченных в пути биосинтеза ароматических соединений, оптимизация экспериментальной процедуры.
Аналогичный подход был использован при конструировании других ауксотрофных мутантов с нарушенным синтетезом ароматических соединений на основе M. methylotrophus AS1::aroPEco.
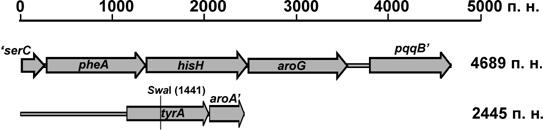
Рис. 12. Генетическая организация клонированных в этой работе Sau 3A (Bsp143I) фрагментов ДНК хромосомы M. methylotrophus AS1, содержащих гены ароматического пути биосинтеза.
Полная открытая рамка считывания, обнаруженная в составе фрагмента хромосомы M. methylotrophus, который комплементировал ΔtyrA мутацию E. coli JW2581-ΔtyrA, имела высокий уровень гомологии с хоризмат мутазой / префенат дегидрогеназой (ЕС 1.3.1.12/5.4.99.5) M. flagellatus KT (60,4% идентичных аминокислот) (Рис. 12). Чтобы оптимизировать процедуру конструирования ауксотрофных мутантов и определить минимальный размер гомологии небходимый для рекомбинации в M. methylotrophus, при конструировании tyrA ауксотрофов мы использовали линейные фрагменты ДНК, содержащие tyrAMme::[FRT-KmR-FRT] с различной длиной фланговой гомологии селективного маркера. С этой целью были получены ПЦР фрагменты tyrAMme::[FRT-KmR-FRT] с маркером, фланкированным участками хромосомальной ДНК, размером 100, 250, 500 и 1000 пар нуклеотидов. Несколько KmR Tyr - колоний было изолировано уже в случае, когда область гомологии фрагментов ДНК, окружающих маркер, с хромосомой была протяженностью не менее 500 пар нуклеотидов, и более 20 клонов ауксотрофных мутантов могли быть отобраны в каждом эксперименте, когда длина фланговой гомологии составляла ³1000 пар нуклеотидов. Согласно полученным результатам при создании ауксотрофных мутантов достаточно использовать линейные фрагменты ДНК с заданными плечами гомологии к целевому гену размером ³1000 пар нуклеотидов, что позволяет конструировать их in vitro методом ПЦР с перекрывающимися праймерами («overlap extention»). Этот подход был использован нами при создании PheA - и AroG - мутантов M. methylotrophus AS1::aroPEco.
Гены pheAMme, кодирующий хоризмат мутазу / префенат дегидратазу (ЕС 1.3.1.12/5.4.99.5), и aroGMme, кодирующий 3-деокси-D-арабино-гептулозонат-7-фосфат синтазу (ДАГФ) (ЕС 2.5.1.54), были клонированы из хромосомы M. methylotrophus AS1 в составе достаточно большого (4689 п. н.) фрагмента ДНК (Рис.12). В результате анализа нуклеотидной последовательности в составе этого фрагмента были обнаружены три сонаправленные и транскрипционно перекрывающиеся ORFs, которые имели высокий уровень гомологии с PheA, HisH и AroG M. flagellatus KT (63,4%, 71,9% и 73,5% идентичных аминокислот соответственно). Для штаммов E. coli, известны три изофермента ДАГФ синтазы, кодируемые генами aroGEco, aroFEco и aroHEco. Тогда как для родственного M. methylotrophus AS1 микроорганизма M. flagellatus KT был аннотирован в бактериальном геноме лишь один ген ДАГФ синтазы – aroG.
Два линейных фрагмента ДНК, содержащие маркированные делеции ΔpheAMme::[FRT-KmR-FRT] и ΔaroGMme::[FRT-KmR-FRT], были сконструированы с помощью метода ПЦР с перекрывающимися праймерами и гены pheAMme и aroGMme были инактивированы в хромосоме M. methylotrophus AS1::aroPEco. При инактивации pheAMme устойчивые к канамицину колонии были получены только на селективной среде с добавлением всех трех ароматических аминокислот (AroAs): L-Phe, L-Tyr, L-Trp и пара-аминобензойной кислоты (ПАБК), и ни одного KmR клона мы не смогли отобрать, когда L-Phe был добавлен в минимальную среду в качестве единственного компонента для селекции ауксотрофных мутантов. Мы предполагаем, что «полярный эффект» при нарушении pheAMme гена в результате инсерции [FRT-KmR-FRT] мог привести к преждевременной терминации транскрипции обозначенного оперона, содержащего aroGMme как дистально расположенный цистрон. Когда маркер KmR был удален из хромосомы, оставшаяся «scar» последовательность восстанавливала исходную рамку считывания в ΔpheAMme::FRT и мутантный штамм M. methylotrophus AS1::aroPEco-ΔpheAMme::FRT мог расти на минимальной среде с метанолом, содержащей 100 мг/л L-фенилаланина.
Фрагмент ДНК с ΔaroGMme::[FRT-KmR-FRT] был использован для создания ауксотрофного мутанта, который также мог расти только, когда все основные ароматические компоненты (AroAs и ПАБК) присутствовали в селективной среде. При этом удаление маркера KmR из хромосомы не привело к изменению потребностей безмаркерного штамма M. methylotrophus AS1::aroPEco-ΔaroGMme::FRT в питательных составляющих среды. Эти результаты однозначно указывают на то, что, также как и ранее было показано для M. flagellatus KT, только один ген, кодирующий ДАГФ синтазу, присутствует в геноме M. methylotrophus AS1.
Подводя итоги этой части нашей работы, следует отметить, что достаточно большое число генов E. coli экспрессируются в M. methylotrophus AS1 под контролем своих регуляторных областей (Abalakina et al., 2008), поэтому сам факт транскрипции генов aroPEco, brnQEco в клетках этого метилотрофа был в достаточной степени предсказуем. Именно поэтому и не была проведена предварительная замена промоторов у этих генов, как, по-видимому, следовало бы сделать в случае другого реципиентного организма. Однако функционирование их белковых продуктов в качестве специфических транспортеров в составе гетерологичной бактериальной мембраны, безусловно, можно отнести к экспериментальным удачам. Тем не менее, уже при наличии прецедента, можно рекомендовать введение генов транспортеров аминокислот при создании ауксотрофов и на базе других метилотрофных бактерий. Можно думать, что функционирование специфического транспортера в гетерологичном хозяине можно будет экспериментально зарегистрировать по снижению устойчивости рекомбинантных штаммов к структурным аналогам соответствующих аминокислот. Таким образом, использованный в данной работе подход, возможно, будет иметь практическое значение и для получения мутантов на основе различных организмов.
Сам по себе метод получения инсерционных мутантов в результате обмена маркером с использованием механизма общей рекомбинации (recombination-mediated marker exchange) не является оригинальным для клеток метилотрофных бактерий и, в частности, для M. methylotrophus AS1 (Bohanon et al., 1988). Однако использование этого подхода подразумевало введение в реципиентные клетки кольцевой молекулы ДНК, не способной к автономной репликации в данном хозяине, и последующий обмен содержащегося на ней фрагмента с селективным маркером на участок бактериальной хромосомы. Использование в данной работе для «marker-exchange» линейной ДНК, значительно повышает селективность отбора целевых рекомбинантов, поскольку маркер может оказаться в составе хромосомы лишь в результате рекомбинации по обоим флангам, а не по одному, как это может быть в случае введения в клетки кольцевой плазмиды.
Сочетание этих двух элементов – (1) создание специализированного реципиента и (2) оптимизация процедуры конструирования фрагмента для инсерционного мутагенеза позволило создать удобные мутанты M. methylotrophus AS1 с нарушенными путями биосинтеза ароматических соединений, которые ранее у этого организма получены не были. Эти ауксотрофные мутанты, а также методы их конструирования в дальнейшем были использованы нами для создания штамма-продуцента L-фенилаланина на метаноле (Yomantas Y. and Abalakina E., 2002; Tokmakova I. et al., 2007).
ВЫВОДЫ
1. Система транспозиции бактериофага Mu адаптирована для интеграции рекомбинантной ДНК в геном M. methylotrophus AS1. Эта система включает две плазмиды: первая, хелперная, с репликоном широкого круга хозяев и термоиндуцибельными генами Mu-A и Mu-B; вторая, интегративная, с mini-Mu транспозоном, содержащим L - и R-концевые участки ДНК Mu. Для селекции интегрантов использовали ген устойчивости к канамицину (KmR), фланкированный сайтами FRT, а для последующего удаления маркера – FLP-рекомбиназу S. cerevisiae.
2. Показана высокая эффективность транспозиции с использованием данной системы на этапе первичной интеграции mini-Mu в хромосому M. methylotrophus, осуществляющейся, в основном, по механизму репликативной транспозиции через образование коинтегратов с их последующим разрешением. Возможность последовательной интеграции нескольких различных фрагментов ДНК продемонстрирована с использованием генов α-амилазы B. amyloliquefaciens и катехол-2,3-диоксигеназы P. putida.
3. Введение в состав интегрируемого mini-Mu транспозона энхансерного элемента (IAS) обеспечивало возможность высокоэффективной (с частотой 2х10-2) амплификации mini-Mu в бактериальной хромосоме в присутствии факторов транспозиции.
4. Для клеток M. methylotrophus разработан метод получения ауксотрофных мутантов по биосинтезу ароматических соединений. Он основан на (а) использовании специально сконструированного реципиентного штамма с геном транспортера aroPEco; (б) конструировании линейных фрагментов ДНК, содержащих целевые гены, инактивированные вырезаемым маркером KmR; (в) обмене in vivo маркером между линейным фрагментом ДНК и бактериальной хромосомой в ходе общей рекомбинации и (г) использовании системы FLP-FRT-рекомбинации для удаления маркера.
5. С помощью разработанного метода создана коллекция ауксотрофных мутантов M. methylotrophus по генам trpE, tyrA, pheA, aroG с нарушенным биосинтезом ароматических аминокислот.
Список работ, опубликованных по теме диссертации:
1. Zakataeva N. P., Aleshin V. V., Tokmakova I. L., Troshin P. V. and Livshits V. A. The novel transmembrane Escherichia coli proteins involved in the amino acid efflux. // FEBS Lettes 452(3):228-32, 1999
2. Kutukova E. A., Livshits V. A., Altman I. P., Ptitsyn L. R., Zyiatdinov M. H., Tokmakova I. L., Zakataeva N. P. The yeaS (leu E) gene of Escherichia coli encodes an exporter of leucine, and the Lrp protein regulates its expression // FEBS Lettes 579(21):4629-34, 2005
3. , , Способ придания бактерии, принадлежащей к роду Methylophilus, ауксотрофности по L-аминокислоте. // Патентная заявка РФ №, 2007
4. Katashkina J. I., Kuvaeva T. M., Andreeva I. G., Skorokhodova A. Y., Biryukova I. V., Tokmakova I. L., Golubeva L. I., Mashko S. V. Construction of stably maintained non-mobilizable derivatives of RSF1010 lacking all known elements essential for mobilization. // BMC biotechnology 7:80, 2007
5. Абалакина Е. Г., Токмакова И. Л., Горшкова Н. В., Смирнов С. В., Ахвердян В. З., Машко С. В., Йомантас Ю. В. Использование системы транспозиции бактериофага Mu для интеграции рекомбинантной ДНК в хромосому Methylophilus methylotrophus. // Биотехнология №3, 2008
6. Abalakina E. G., Tokmakova I. L., Gorshkova N. V., Gak E. R., Akhverdyan V. Z., Mashko S. V., Yomantas Y. V. Phage Mu-driven two-plasmid system for integration of recombinant DNA in the Methylophilus methylotrophus genome. // Appl. Microbiol. Biotechnol. 81(1):191-200, 2008
7. Yomantas Y. V., Tokmakova I. L., Gorshkova N. V., Abalakina E. G., Kazakova S. M., Gak E. R., Mashko S. V. Aromatic amino acid auxotrophs constructed by recombinant marker exchange in Methylophilus methylotrophus AS1 cells expressing the aroP-encoded transporter of Escherichia coli. // Appl. Environ. Microbiol. 76(1):75-83, 2010

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 |




