Лекция 2
Калийные соли. Производство простых и комплексных калийных удобрений.
Важнейшими солями калия являются хлорид и сульфат и образуемые ими минералы. Получаемые калийные соли применяют главным образом в качестве минеральных удобрений, т. к. калий играет большую роль в регулировании жизненных процессов, происходящих в растении. Калий улучшает водный режим растений, способствует обмену веществ и образованию углеводов, увеличивая, так же как и фосфор, накопление крахмала в картофеле, сахара в сахарной свекле, и др., значительно повышает засухоустойчивость и морозостойкость растений. Содержание калия в сухом веществе растения достигает 4-5%, а в золе листьев 30-60% (в основном в виде поташа).
По легкости усвоения различают три формы соединений калия: 1) водорастворимый, 2) обменный, т. е. переходящий в почвенный раствор в результате ионообменных процессов, 3) необменный, входящий в состав безводных силикатов из которых калий извлекается растениями медленно и частично.
Содержание калия в удобрениях традиционно выражают в пересчете на K2O. Основным видом калийной промышленности является хлористый калий, 95% которого используется в качестве готового минерального удобрения или сырьем для производства комплесных удобрений содержащих калий, а остальные 5% перерабатывают на гидрооксид калия и другие соединения калия.
Из общего количества калийных удобрительных солей 8-10% вырабатывают в виде сульфата калия и двойной соли сульфатов калия и магния ( K2SO4*MgSO4), используемых для удобрения почв под хлорофобные культуры (табак, цитрусовые).
По данным 2005 г. крупнейшими производителями калийных удобрений являются: Канада 10.7 млн. т./г, Белоруссия 5.5 млн. т./г., Россия 5 млн. т./г, Германия 3.5 млн. т./г., Израиль 2.1 млн. т./г., Иордания 1.2 млн. т./г, Великобритания 0.6 млн. т./г., Китай 0.6 млн. т./г., Украина 0.1 млн. т./г.
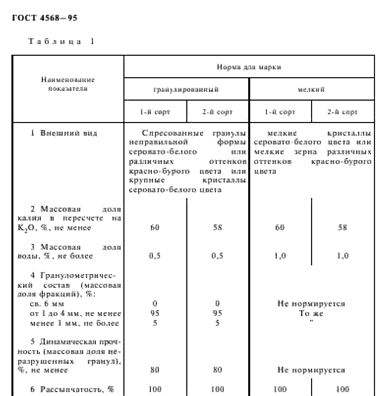
Качество хлорида калия производимого на территории России регламентируется ГОСТ 4568-95.
Сульфатнокалийные удобрения в России выпускаются в виде сульфата калия, калимагнезии (двойной соли сульфатов калия и магния с примесями хлоридов калия и натрия) и калийно-магниевого концентрата, получаемого флотационным обогащением.
Калимагнезия в соответствии с техническими условиями содержит в пересчете на сухое вещество: в 1 сорте K2O не менее 30%, во 2-ом 28%; MgO соответственно 10% и 8%. Соедержание иона хлора не должно превышать 5% для первого сорта, а для второго не регламентируется.
Калиево-магниевый концентрат выпускают двух сортов:

Сульфат калия, получаемый при переработке полиминеральных руд, выпускается 1 и 2 сортов. Содержание K2O для сорта 1 не менее 50%, для 2 не менее 45; иона хлора не более 0.5 и 2 соответственно.
Сырье
Содержание калия в земной коре составляет 1.5%. Калий входит в состав алюмосиликатов, слагающих многие породу, гранитов, лейцитов, гнейсов, твердых ископаемых солевых отложений и рассолов морского и континентального происхождения. Состав части почв, особенно глинистые вещества, активно удерживают ( путем сорбции) калий, что, в частности, имеет очень важное значение для жизни растений. Благодаря такой способности почв вымывание калия идет очень медленно, в результате чего содержание его солей в природных водах, как правило, во много раз ниже, чем солей натрия и магния.
Основные калийные минералы:

Калийные руду определяют по преобладающему содержанию в них тех или иных минералов. Сильвинитом называют породу состоящую из сильвина (10-60%) и галита (25-70%) с примесями карбоната магния и глинистых веществ.
Получение хлористого калия
Соответственно переработку сильвинита, карналлита с получением хлористого калия осуществляют следующим образом:
1.Методом растворения и раздельной кристаллизации, основанной на различии растворимости компонентов руды в зависимости от температуры. (также называется конверсионным и галлургическим)
2. Механическим обогащением руды, в основном флотацией.
3. Комбинация флотации с растворением и кристаллизацией мелких фракций руды
4. Подземным выщелачиванием руды с последующей переработкой рассола: выпарка и кристаллизация.
Метод растворения:
В основе получения хлористого калия методами растворения и кристаллизации лежат свойства системы KCl-NaCl-H2O. Обычно расчет процесса растворения с последующей кристаллизацией хлорида калия из данной системы производят по фазовой диаграмме. В основе лежит различие температурных коэффициентов растворения хлоридов калия и натрия. Так растворимость хлорида калия сильно меняется в зависимости от температуры в то время как растворимость хлорида натрия почти не меняется. Поэтому разделение системы производят при максимально возможной температуре (соответственно около 100 градусов т. к. процесс проводят при атмосферном давлении и определяется температурой кипения раствора), в результате в раствор переходит в основном хлористый калий, а хлористый натрий остается в руде, т. к. раствор насыщен по хлористому натрию. В дальнейшем для кристаллизации хлорида калия раствор охлаждают, т. к. при уменьшении температуры растворимость хлористого калия резко падает. Отделив осадок от раствора, раствор возвращают на стадию растворения сырья. Таким образом процесс можно разделить на следующие стадии:
1. Растворение измельченного сырья горячим раствором, полученным после кристаллизации KCl; при этом из сильвинита в раствор переходит KCl, а NaCl остается в сырье.
2. Отделение горячего раствора от остатков нерастворенного сырья и очистка его от мелких увлеченных твердых частиц.
3. Охлаждение горячего насыщенного по KCl раствора, сопровождающегося кристаллизацией KCl
4. Отделение кристаллов KCl от раствора, сушка
5. Нагревание полученного раствора насыщенного NaCl, возвращаемого на растворение KCl из новых порций сильвинита.
Флотационный метод разделения.
Флота́ция (фр. flottation, от flotter — плавать) — процесс разделения мелких твёрдых частиц (главным образом, минералов), основанный на различии их в смачиваемости водой. Гидрофобные (плохо смачиваемые водой) частицы избирательно закрепляются на границе раздела фаз, обычно газа и воды, и отделяются от гидрофильных (хорошо смачиваемых водой) частиц. При флотации пузырьки газа или капли масла прилипают к плохо смачиваемым водой частицам и поднимают их к поверхности. На данный момент для увеличения объёмов и расширения области применения используют пенную флотацию, при которой обработанные реагентами частицы выносятся на поверхность воды пузырьками воздуха, образуя пенный слой, устойчивость которого регулируется добавлением пенообразователей.
Калийные минералы являются гидрофобными и находятся в слое пены, а натриевые и магниевые соли по сравнению с калийными являются гидрофильными и оседают в водном слое. Стадии производственного процесса получения хлористого калия включают следующие стадии:
Сухое и мокрое измельчение руды Оттирка глинистых примесей от частиц руды в специальных мешалках и их выделение Обработка суспензии реагентами флотации Основная флотация с перемешиванием Перечистка концентрата, полученного при основной флотации Контрольная флотация для снижения потерь калия с отходом Обезвоживание перечищенного концентрата на фильтрах и центрифугах, сушка.Так же могут применяться перед флотацией гравитационные методы разделения основанные на разности плотностей галита и сильвина. Проводятся в гидроциклонах или осаждением под действием силы тяжести в статических аппаратах (ванны с конусообразными выводами на дне)
Получение сульфата калия:
1. Переработка с помощью растворения и кристаллизации полиминеральных сульфатнокалийных руд.
2. Конверсионными методами на основе взаимодействия хлористого калия и различных сульфатных солей (эпсомита MgSO4*7H2O, мирабилита глауберовой соли Na2SO4*10H2O, лангбейнита K2SO4*2MgSO4)
3. Комбинированием флотационного метода с переработкой концентрата конверсионным методом.
4. При производстве серной кислоты из хлористого калия.
5. Гидротермическим методом на основе взаимодействия сульфатных солей с хлористым калием с получением побочной соляной кислоты
6. Переработкой водонерастворимых калийных руд (полигалитов, лейцитов, глауконитов)
Поташ
Поташ используют в производстве стекла. Высококачественные сорта его применяют для изготовления медицинского, электровакуумного, художественного стекла, а также хрусталя. Поташ употребляют для производства некоторых солей, фармацевтических препаратов, жидкого калийного мыла, при получении жидкой и твердой двуокиси углерода, при крашении и отбелке тканей, для промывания шерсти. Так же его применяют для очистки промышленных газов от сероводорода, особенно в коксохимической промышленности для очистки коксового газа. Так же он используется в строительстве в качестве морозозащитной добавки в растворы и бетоны, имеющей преимущества перед другими солями – он не вызывает коррозии. В сельском хозяйстве его применяют как бесхлорное щелочное удобрение, но из-за высокой стоимости применяют все таки редко.
Методы производства поташа:
1. Извлечение поташа из растительной золы на данный момент потерял свое значение из-за экономической неэффективности.
2. Переработка бардяного угля и золы. Барда отход после сбраживания патоки свеклосахарных заводов и отгонки спирта.
3. Производство из минерального сырье комплексной переработкой например переработкой нефелина.
4. Карбонизация гирооксида калия, полученного электролизом растворов хлорида калия
5. Аммиачный способ. 2KCl+2NH3+CO2+H2O=K2CO3 + 2NH4Cl
KCl+N(CH3)3+CO2+H2O=KHCO3+N(CH3)*HCl
2(N(CH3)3*HCl)+ Ca(OH)2=2N(CH3)3+CaCl2+2H2O
6. Магнезиальный метод Энгеля-Прехта Заключающийся в карбонизации под давлением суспензии активного карбоната магния в растворе хлорида калия: 3(MgCO3*3H2O)+KCl+CO2=2(KHCO3*MgCO3*4H2O)+MgCl2
7. Переработка природного сернокислого калия формиатным способом. K2SO4+Ca(OH)2+CO2=CaSO4+2HCOOK
2HCOOK+O2=K2CO3+H2O+CO2
Нитрат калия
Нитрат калия используют для производства порохов, в пиротехнике, в пищевой и стекольной промышленности и как комплексное удобрение. Имеет ряд важных преимуществ: малая гигроскопичность (низкая влагопоглащение). Качество регламентируется ГОСТ .
В природе нитрат калия встречается в виде небольших залежей. Искусственным способом, известным с давних времен, калиевую селитру получали в так называемых селитряницах из компостов, в которые входили: навоз, зола, известь, хворост. В результате биохимических процессов получалась калиевая селитра, которую обрабатывали водой и кристаллизовали.
Получение:
1. Нейтрализацией KOH или K2CO3 азотной кислотой. Почти не используется из-за дорого сырья.
2. Конверсионные методы получения:
KCl+NaNO3=KNO3+NaCl
NH4NO3+KCl=KNO3+NH4Cl
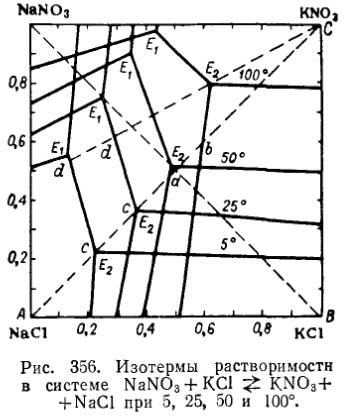
3. Получение нитрата калия из хлорида калия и азотной кислоты или окислов азота. Используется редко из-за дорогостоящего оборудования, т. к. в процессе образуется хлористый нитрозил (NOCl).




