На правах рукописи
АЛБЕГОВА ЖАННА КУЦУКОВНА
ПАТОГЕНЕЗ И ЭКСПЕРИМЕНТАЛЬНАЯ ПРОФИЛАКТИКА
ЭНТЕРОСОРБЕНТАМИ НЕФРО - И КАРДИОПАТИЙ,
ВЫЗВАННЫХ ЦВЕТНЫМИ МЕТАЛЛАМИ
14.03.03 – патологическая физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
ВЛАДИКАВКАЗ – 2012
Работа выполнена в государственном бюджетном образовательном учреждении высшего профессионального образования «Северо-Осетинская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Научный консультант: | БРИН Вадим Борисович доктор медицинских наук, профессор, заслуженный работник ВШ РФ |
Официальные оппоненты: | ОВСЯННИКОВ Виктор Григорьевич доктор медицинских наук, профессор, заслуженный работник ВШ РФ, заведующий кафедрой патологической физиологии ГБОУ ВПО «Ростовский государственный медицинский университет» Минздравсоцразвития России (г. Ростов-на-Дону) |
КОЖИН Александр Алексеевич доктор медицинских наук, заслуженный деятель науки РФ, Лауреат премии Правительства РФ, профессор кафедры биофизики и биокибернетики ЮФУ (г. Ростов-на-Дону) | |
ДЗУГКОЕВА Фира Соломоновна доктор медицинских наук, заслуженный деятель науки РСО-Алании, профессор, заведующая отделом патобиохимии ФГБУН Института биомедицинских исследований Владикавказского научного центра РАН и Правительства РСО-Алания (г. Владикавказ) |
Ведущая организация: Российский национальный исследовательский медицинский университет им. Минздравсоцразвития России
Защита состоится «25» декабря 2012 года в «11оо» часов на заседании диссертационного совета Д 208.095.01 в ГБОУ ВПО «Северо-Осетинская государственная медицинская академия» Минздравсоцразвития России (0)
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО «Северо-Осетинская государственная медицинская академия» Минздравсоцразвития России (0)
Автореферат разослан « » ноября 2012 года
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор
АКТУАЛЬНОСТЬ ТЕМЫ. На современном этапе развития медико-биологической науки весьма актуальным является изучение влияния экопатогенных факторов среды на здоровье человека. Экологическая ситуация в ряде регионов Российской Федерации, в том числе в РСО-Алании, крайне тревожная, что является фактором риска для здоровья населения (, 2010; , , 2010; , 2011). Промышленные предприятия черной и цветной металлургии, транспорт, добыча и сжигание твердого и жидкого топлива, электронная и полупроводниковая промышленность, работа горно-обогатительных и мусоросжигающих комплексов ежедневно, выбрасывая тонны токсичных металлов и их соединений, интенсивно загрязняют экосистему (, , 1992; , 2009; , , 2011). На отвальном поле и на территории заводов «Электроцинк» и «Победит» в г. Владикавказ накоплено 3696 тыс. тонн клинкера, а в его составе 1312 тонн никеля, 407 тонн молибдена, 173 тонны вольфрама и др. Этот материал является постоянным источником загрязнения поверхностных и подземных вод разными химическими компонентами I-III классов опасности.
Повышение содержания солей тяжелых металлов в воздухе, воде и почве способствует их поступлению в организм человека, вызывая серьезные нарушения здоровья, особенно сердечно-сосудистой системы и почек, которые одними из первых подвергаются токсическому воздействию ксенобиотиков (, 2004; , 2010; , , и соавт., 2011; , , 2011).
Вместе с тем отсутствие эффективных и доступных способов профилактики и ускоренного выведения тяжелых металлов сделало их разработку насущной необходимостью, так как известные сегодня детоксиканты при длительном применении выводят из организма жизненно важные микроэлементы и вызывают различные побочные эффекты (, 2005). Наше внимание привлекли цеолитоподобные глины Северной Осетии – Ирлиты, их большие запасы и доступность, ионообменные, сорбционные и молекулярно-ситовые свойства (, , 2000) позволяют обосновать целесообразность их применения в качестве энтеросорбентов, способных в условиях экспериментальных моделей интоксикации соединениями кобальта, кадмия, ртути и свинца адсорбировать тяжелые металлы, продукты распада и токсины внутренней среды (, 2004; , 2004; , 2008; , 2008).
Другим сорбентом выбран разработанный в Институте неорганической химии им. СО РАН новый углеродный нанокомпозитный модифицированный сорбент для биомедицинского применения.
Целью данной работы явилось экспериментальное изучение патогенеза токсических нефро - и кардиопатий, вызванных цветными металлами, и профилактических эффектов природного цеолитоподобного нанокомпозитного сорбента Северной Осетии – Ирлита, и созданного в лабораторных условиях нанокомпозитного углеродного модифицированного сорбента – НУМС.
Для реализации поставленной цели необходимо решить следующие задачи:
1. Изучить влияние внутрижелудочного ежедневного, в течение двух месяцев, введения хлорида никеля на функцию почек и состояние сердечно-сосудистой системы у крыс линии Вистар.
2. Изучить влияние внутрижелудочного ежедневного, в течение двух месяцев, введения молибдата аммония на функции почек и состояние сердечно-сосудистой системы у крыс линии Вистар.
3. Изучить влияние внутрижелудочного ежедневного, в течение двух месяцев, введения паравольфрамата аммония на функции почек и состояние сердечно-сосудистой системы у крыс линии Вистар.
4. Изучить влияние профилактического применения природного энтеросорбента глины Ирлит, вводимого внутрижелудочно через день в течение двух месяцев, на функции почек и состояние сердечно-сосудистой системы в условиях хронической интоксикации хлоридом никеля, молибдатом и паравольфраматом аммония.
5. Изучить влияние профилактического применения модифицированного углеродного энтеросорбента НУМС, вводимого внутрижелудочно через день в течение одного месяца, на функции почек и состояние сердечно-сосудистой системы в условиях хронической интоксикации хлоридом никеля, молибдатом и паравольфраматом аммония.
6. Исследовать влияние изучаемых солей цветных металлов, энтеросорбентов и их совместного введения на процессы перекисного окисления липидов и состояние активности антиоксидантной системы.
7. Исследовать влияние хлорида никеля, молибдата аммония и паравольфрамата аммония, энтеросорбентов и их совместного введения на гистологическую характеристику почек, печени и миокарда.
8. Исследовать влияние изучаемых солей цветных металлов, энтеросорбентов и их совместного введения на накопление цветных металлов в тканях почек, печени и миокарда, их содержание в плазме крови и экскрецию с мочой и калом.
Научная новизна. Новизна работы подтверждена 11 патентами на изобретения. Впервые получены экспериментальные модели токсической кардио - и нефропатии при хронической интоксикации солями цветных металлов (никеля, молибдена и вольфрама). Изучено влияние хронической интоксикации, вызванной хлоридом никеля, молибдатом и паравольфраматом аммония, на функции почек, системную гемодинамику и адренореактивность сердечно-сосудистой системы у крыс.
Впервые установлено, что глина Ирлит и НУМС профилактируют изменения водо - и электролитовыделительной функций почек при интоксикации тяжёлыми цветными металлами. Впервые выявлено, что используемые энтеросорбенты профилактируют изменения системной гемодинамики, адренореактивности сердечно-сосудистой системы при интоксикации цветными металлами. Впервые показано, что профилактическое применение энтеросорбентов при хронической интоксикации цветными металлами уменьшает выраженность патологических изменений в тканях внутренних органов. Впервые установлено, что профилактическое использование энтеросорбентов Ирлит и НУМС в условиях хронической интоксикации цветными металлами снижает интенсивность процесса перекисного окисления липидов, повышая при этом активность ферментов антиокислительной защиты клеток.
Научно-практическая значимость работы. Полученные экспериментальные данные относятся к области фундаментальных знаний, т. к. расширяют представления о механизмах токсического действия тяжелых цветных металлов на сердечно-сосудистую систему и почки. Выявлены сдвиги ионо-водовыделительной функции почек и степень протеинурии в условиях хронической интоксикации ксенобиотиками. Исследованы изменения системной гемодинамики и адренореактивности сосудистой системы, и, как один из возможных патогенетических механизмов этих нарушений, изучен дисбаланс в системе перекисное окисление липидов – антиоксидантная защита клеток.
Полученные результаты являются основанием для разработки способов профилактики хронической интоксикации тяжелыми цветными металлами. Выявленные эффекты Ирлита и НУМС демонстрируют закономерности влияния наноэнтеросорбентов на токсические проявления избытка цветных металлов в нефроне и сосудистой системе. Экспериментальные фундаментальные данные могут быть использованы в учебном процессе на кафедрах, изучающих вопросы медицинской экологии, физиологические основы энтеросорбции и патогенетические механизмы влияния экотоксикантов. Материалы диссертации используются в лекциях и научных исследованиях на кафедрах нормальной физиологии, патофизиологии, гигиены и в курсе профпатологии Северо-Осетинской государственной медицинской академии.
Основные положения, выносимые на защиту:
1. Хроническая интоксикация тяжелыми цветными металлами (Ni, Mo, W) способствует развитию токсических нефро - и кардиопатий у крыс.
2. Профилактическое использование энтеросорбентов уменьшает выраженность изменений ионоводовыделительной функции почек, вызванных внутрижелудочным введением солей тяжелых цветных металлов, вследствие уменьшения процесса их накопления в тканях и более интенсивного их выведения.
3. Профилактическое использование энтеросорбентов уменьшает выраженность изменений системной гемодинамики и адренореактивности сердечно-сосудистой системы, вызванных внутрижелудочным введением солей тяжелых цветных металлов, вследствие снижения их накопления в тканях и более интенсивного выведения из организма.
4. Дисбаланс в системе перекисное окисление липидов – антиоксидантная защита может являться одним из патогенетических механизмов нефропатии и кардиопатии при хронической интоксикации тяжелыми цветными металлами.
Личный вклад автора. Автором самостоятельно выполнены эксперименты по изучению функции почек и сердечно-сосудистой системы, математическая и статистическая обработка данных, проведен анализ и обобщение полученных результатов.
Публикации И АППРОБАЦИЯ РАБОТЫ. По теме диссертации опубликована 31 научная работа, в том числе 15 – в журналах, рекомендованных ВАК Министерства образования России.
Основные положения работы доложены и обсуждены на: юбилейной научной сессии, посвященной 70-летию СОГМА «Актуальные проблемы медицины» (Владикавказ, 2009); III международной научно-практической конференции «Актуальные проблемы биологии, нанотехнологий и медицины» (Ростов-на-Дону, 2009); VII международной научной конференции «Устойчивое развитие горных территорий в условиях глобальных изменений» (Владикавказ, 2010); III съезде физиологов СНГ (Ялта, 2011); V региональной научно-практической конференции «Новые технологии в рекреации здоровья населения» (Владикавказ, 2012); международной заочной научно-практической конференции «Биология, химия, физика: теоретические и практические аспекты» (Новосибирск, 2012).
Объем и структура диссертации. Диссертация изложена на 312 страницах компьютерного текста и состоит из введения, обзора литературы, материалов и методов исследования, 7-и глав собственных результатов и их обсуждения, заключения, выводов и приложения в виде сводных таблиц. Работа содержит 13 таблиц, иллюстрирована 41 рисунками и одной схемой, отражающей патофизиологические механизмы выявленных изменений. В библиографическом указаисточника, 217 из которых отечественные и 109 – зарубежные.
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ. Исследования проводились на 320 половозрелых крысах-самцах линии Wistar для исключения возможных гормональных циклов, отмечающихся у самок, а также влияния возрастных сдвигов в эндокринной системе на водно-солевой обмен. Опытные животные в период исследований содержались на стандартном рационе в условиях свободного доступа к воде и пище. Световой режим – естественный.
Модели хронической никелевой, молибденовой и паравольфрамовой интоксикации создавали путем внутрижелудочного введения крысам в течение двух месяцев растворов хлорида никеля в дозе 25,0 мг/кг, молибдата и паравольфрамата аммония в дозах 50,0 мг/кг. Исследования проводили через две недели, один и два месяца. В качестве контроля были взяты интактные крысы.
Исследуемые сорбенты – природная глина Северной Осетии Ирлит и разработанный для фармакопейного применения в Институте химии СО РАН нанокомпозитный углеродный модифицированный сорбент или НУМС вводили крысам через день внутрижелудочно в виде 6,0% взвесей в количестве 2,5% массы тела (НУМС, по рекомендации производителей, в течение одного месяца, а Ирлит – двух). Оба сорбента в условиях in vitro способны извлекать 99,0% молибдена и никеля из водных растворов с концентрацией, аналогичной in vivo соответствующей молибденовой (50,0 мг/дм3) и никелевой (25,0 мг/дм3) интоксикации, снижая содержание этих металлов до уровней ПДК (, , 2000). Гранулометрический анализ НУМС и Ирлита, проведенный на лазерном дифракционном анализаторе ANALYSETTE 22 Nanotech с использованием блока мокрого диспергирования, показал, что более 80% частиц имеют размеры менее 20 нм.
Для изучения функции почек в условиях спонтанного диуреза животные помещались в обменные клетки, где в течение шести часов у них собиралась моча. В целях изучения функции почек в условиях водного диуреза животным через зонд в желудок давалась в/н (5% от массы тела), после чего в обменных клетках собиралась моча в течение трех часов через каждый час. По завершении экспериментов часть животных забивались под тиопенталовым наркозом для исследования крови и тканей (почка, печень, сердце). В слоях тканей почки (корковое вещество, наружное мозговое вещество, почечный сосочек) определялось содержание мочевины и натрия. В плазме крови и собранной моче определялась концентрация креатинина, общего белка, общего кальция спектрофотометрически (СФ-46) наборами «АгатМед» (Россия), натрия и калия с помощью пламенной фотометрии (ПАЖ-3), уровень мочевины в тканях определялся методом (1962) с использованием фенолгипохлоритной реакции, в нашей модификации (рац. предлож № 000 и 242 от 01.01.2001). Уровни метгемоглобина в крови (, 1987), концентрация малонового диальдегида в эритроцитах с тиобарбитуровой кислотой (, 2003), гидроперекисей в плазме крови, активность супероксиддисмутазы и каталазы в эритроцитах (, 2003) определялись спектрофотометрически (UNICO). Содержание никеля и молибдена в почках, печени, миокарде, крови, моче и кале определялось на масс-спектрометре ICP-MS HP 450.
Исследование гемодинамических показателей проводилось на наркотизированных животных инвазивным способом с измерением артериального давления с помощью электроманометра ДДА в правой бедренной артерии и частоты сердечных сокращений с помощью электрокардиографии. Среднее артериальное давление рассчитывалось по общепринятой формуле. При измерении минутного объема крови через левую общую сонную артерию в дугу аорты вводился термистор МТ-54М, а в правое предсердие через катетеризируемую правую яремную вену – 0,2 мл физиологического раствора. Кривые термодилюции регистрировались на самописце ЭПП-5, а затем по специальным формулам (, , 1984) проводился расчет сердечного индекса, ударного индекса и удельного периферического сосудистого сопротивления. Для анализа реактивности сердечно-сосудистой системы использовали норадреналин (в минимальной, средней и максимальной дозах – 2,68х10–4, 4х10–4 и 8х10–4 мг/100г) и адреналин (в минимальной и средней дозах – 0,25х10– 4 и 0,5х10– 4 мг/100 г массы тела).
Для гистологических исследований образцы тканей (печень, почка, сердце) фиксировали в 10% нейтральном формалине, затем подвергали заливке в парафин с последующим приготовлением срезов толщиной 7–8 микрон. Срезы окрашивались гематоксилином и эозином. Изучение срезов проводилось в проходящем свете при помощи микроскопа Микмед-1 под увеличением х600 и х1500.
Расчёт показателей водо - и электролитовыделительной функции почек производили по формулам (1974). Для статистической обработки полученных данных использовался параметрический метод сравнения средних величин с помощью t-критерия Стьюдента и метод корреляционного анализа с расчетом коэффициента корреляции Пирсона. Графики строили в программе «GraphPad Prizm 5.03».
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ. Определение содержания никеля в крови интактных крыс и получавших сорбенты выявило только следовое его присутствие (0,0018±0,0002 мг/л), а введение хлорида никеля в течение одного и двух месяцев повысило уровень металла до 0,93±0,085 мг/л и 1,6±0,14 мг/л, который при совместном введении с Ирлитом снизился в 1,9 раза (р<0,001) и в 1,4 раза (р<0,02) соответственно и в 1,3 (р<0,05) после месячного приема НУМС. То есть эффект Ирлита по снижению содержания никеля в крови, максимально проявляющийся при месячном приёме, был на 46,4% значительнее НУМСа.
Уровень никеля в моче с интактного уровня в 0,01±0,0009 мг/л увеличился до 10,36±0,99 мг/л и 12,41±1,02 мг/л после одно - и двухмесячного введения хлорида никеля и снизился в 1,9 и 1,4 раза (р<0,001 и р<0,02) при совместном приёме с природным сорбентом и в 1,4 раза (р<0,002) – с модифицированным.
Содержание никеля в кале у интактных крыс было равно 2,02±0,58 мг/кг сухого веса и оставалось близким к этому значению после приёма сорбентов, а введение хлорида никеля в течение одного месяца повысило его до 418,56±40,28 мг и до 515,36±50,32 мг/кг сухого веса после двух месяцев. В варианте экспериментов совместного введения сорбентов и хлорида никеля уровень металла в кале увеличился еще в большей степени: на 45,7% (р<0,002) и 31,6% (р<0,05) с Ирлитом и на 31,4% (р<0,05) с НУМС. То есть Ирлит в большей степени, чем НУМС, способствует выведению никеля через желудочно-кишечный тракт.
Содержание молибдена в крови крыс после месячного введения молибдата аммония повысилось в 21,1 раз (0,8±0,077 мг/л), а после двух месяцев – в 29,5 раза (1,12±0,092 мг/л), но при совместном введении молибдата аммония и Ирлита снизилось на 47,5% (р<0,001) через один месяц и на 24,2% (р<0,05) через два, а в группе крыс, получавших НУМС, – на 27,5% (р<0,05).
С интактного уровня в 0,073±0,0026 мг/л содержание молибдена в моче, на который приём сорбентов не оказал влияния, повысилось до 464,39±42,37 мг/л через один месяц введения крысам молибдата аммония и до 517,32±45,3 мг/л после двух месяцев. Приём Ирлита на фоне развивающейся молибденовой интоксикации снизил уровень металла на 71,1% (р<0,002), на 30,5% (р<0,05) после одно - и двухмесячного введения и на 35,6% (р<0,05) после месячного введения НУМС.
Содержание молибдена в кале крыс интактной группы составляло 1,12±0,19 мг/кг сухого веса и оставалось в пределах среднестатистических колебаний после приёма сорбентов, а месячное введение молибдата аммония повысило уровень металла до 331,36±30,36 мг/кг сухого веса и более чем в два раза – в конце эксперимента. При совместном приёме Ирлита и молибдата аммония в течение одного и двух месяцев содержание молибдена увеличилось в 1,96 и 1,38 раза (р<0,001 и р<0,02), а при месячном эксперименте с НУМС – в 1,5 раза (р<0,01). То есть Ирлит в большей степени способствовал выведению молибдена из организма.
Таким образом, введение крысам хлорида никеля и молибдата аммония повышает в крови, моче и кале содержание никеля и молибдена, а приём Ирлита и НУМС снижает их уровни в крови и моче и увеличивает в кале, что доказывает способность сорбентов уменьшать всасывание металлов из кишечника, ослаблять токсические проявления и оказывать профилактическое действие.
Учитывая задачи по изучению влияния исследуемых ксенобиотиков на выделительную и сердечно-сосудистую систему, мы посчитали целесообразным определить содержание металлов в почках и миокарде, а так как основным местом их всасывания являлся желудочно-кишечный тракт, то еще и в печени.
Прием сорбентов не изменял содержание металлов тканях. Уровень никеля в почках интактных крыс был 0,118±0,02 мг/кг. Введение хлорида никеля увеличило уровень металла через месяц в 18,4 раз и в 26,6 раза – через два. Приём Ирлита на фоне интоксикации снизил накопление металла в почке на 29,2% (р<0,05) и 29,3% (р<0,02) соответственно и на 25,8% (р<0,02) – при совместном введении с НУМС.
Уровень никеля в печени крыс после месячной интоксикации увеличился до 3,58±0,35 мг/кг, что было в 18,6 раза больше интактного уровня, а после двух месяцев введения хлорида никеля – в 25,2 раза. Приём Ирлита снизил эти величины на 49,2% (р<0,001) и 34,3% (р<0,05), а НУМС – на 29,1% (р<0,02).
Содержание никеля в миокарде интактных крыс было равно 0,085±0,007 мг/кг, а после одного и двух месяцев введения хлорида никеля увеличилось в 10,3 и 15,1 раза. Совместное введение ксенобиотика и Ирлита снизило уровень металла в миокарде в 2,4 раза и в 1,39 раза (р<0,05) и в 1,35 раза (р<0,02) – с НУМС. То есть Ирлит на 80,5% больше, чем НУМС предотвратил накопления никеля в сердечной мышце.
Изучение содержания молибдена в ткани органов показало, что его уровень в почках после месячного введения молибдата аммония с 0,24±0,018 мг/кг повысился в 21,1 раза (5,06±0,48 мг/кг), а после двух месяцев – в 31,1 раза. Введение ксенобиотика и Ирлита достоверно снизило содержание молибдена в почках крыс до 2,48±0,25 мг/кг (один месяц) и 5,23±0,51 мг/кг (два месяца), а прием НУМС способствовал уменьшению накопления молибдена до 3,55±0,36 мг/кг.
Содержание молибдена в печени через один месяц введения молибдата аммония увеличилось до 4,68±0,37 мг/кг, что в 11,1 раза превышало интактный уровень (0,42±0,039 мг/кг), а после двух месяцев интоксикации повышение было в 15,7 раза. При сочетанном месячном введении крысам молибдата аммония и Ирлита уровень металла в печени снизился на 28,3% (р<0,05), а в двухмесячных экспериментах – на 31,2% (р<0,01). Приём НУМС уменьшил накопление молибдена в печени более эффективно – на 54,3% (р<0,001), снизив его до 2,14±0,18 мг/кг.
Уровень молибдена в миокарде после месячной интоксикации с интактного уровня в 0,117±0,011 мг/кг увеличился до 2,45±0,23 мг/кг, а после двух месяцев – до 3,85±0,33 мг/кг. При одновременном приеме молибдата аммония и Ирлита в течение одного месяца уровень молибдена снизился на 27,4% (р<0,05), а после двух месяцев – на 25,8% (р<0,02), а в варианте с НУМС накопление молибдена в миокарде было на 48,6% (р<0,001) меньше.
Таким образом, ежедневное, в течение двух месяцев, введение крысам хлорида никеля и молибдата аммония повышает содержание никеля и молибдена в почках, печени и сердечной мышцы, а при совместном введении ксенобиотиков и сорбентов уровень металлов достоверно уменьшается, при этом приём Ирлита в большей степени предотвращает накопление никеля в этих органах и молибдена в почках, а НУМС – молибдена в печени и миокарде.
Результаты гистологического исследования при интоксикации крыс хлоридом никеля и молибдатом аммония были во многом однотипны, и в печени, и в почках и в миокарде отмечались альтеративные, дистрофические, некробиотические и дисциркуляторные изменения. При этом выраженность поражения превалирует в печени и почках, что объясняется ключевой ролью гепатоцита в обезвреживании ксенобиотиков, попадающих в печень по воротной вене, и экскрецией их с мочой через почки. У крыс, получавших сорбенты на фоне интоксикации, эти изменения были выражены в меньшей степени с положительной компенсаторной реакцией в виде лимфогистиоцитарной инфильтрации и повышения макрофагальной активности.
Изучение водовыделительной функции почек в условиях введения интактным крысам сорбентов показало, что спонтанный шестичасовой диурез на протяжении двухмесячного приёма Ирлита и месячного НУМС не изменился, оставаясь близким к результату интактных животных контрольной группы (0,079±0,004 мл/час/100г), а введение крысам хлорида никеля уже через две недели увеличило его на 40,5% (р<0,001) и при интоксикации ещё в течение двух недель способствовало уже более значительному, на 87,7%, повышению количества выделившейся мочи, которое сохранилось на этом же уровне до конца второго месяца интоксикации (табл.1).
При совместном введении хлорида никеля и Ирлита в течение двух недель спонтанный диурез хоть и оставался достоверно (р<0,01) увеличенным сравнительно с результатом введения только Ирлита на 38,0%, но одновременно снизился на 11,7% по сравнению с данными, полученными после введения крысам только ксенобиотика; и по мере пролонгирования экспериментов (табл.1) все время снижался – соответственно на 14,2% и 15,3% к концу первого и второго месяца (р<0,01 и р<0,05). Аналогичное действие оказывал и НУМС, введение которого крысам на фоне двухнедельной интоксикации снизило диуретическое действие хлорида никеля на 14,5%, а в месячных исследованиях – на 8,1% (табл.1). То есть при двухнедельном профилактическом приёме можно использовать оба сорбента, а при необходимости более длительной профилактики целесообразнее применение Ирлита, эффект которого сохраняется, эффективность же НУМС снижается.
Отмеченное повышение диуреза было обусловлено достоверным (р<0,001) уменьшением канальцевой реабсорбции воды, клубочковая фильтрация особо не менялась (табл.1). Введение хлорида никеля повышало содержание креатинина в плазме крови с интактного уровня в 81,24±3,36 мкмоль/л на 9,8% через две недели, на 16,4% (р<0,02) – к концу первого месяца и на 26,3% (р<0,001) – по окончании экспериментов, достигнув 102,64±5,54 мкмоль/л. Концентрация креатинина в плазме крови и основные процессы мочеобразования у крыс, получавших сорбенты, не менялись.
При совместном введении хлорида никеля и сорбентов уменьшение диуреза было связано с повышением канальцевой реабсорбции воды, которая имела достоверное отличие только в месячных опытах (Ирлит, НУМС) и в конце второго месяца (Ирлит). Клубочковая фильтрация в обоих вариантах с приемом сорбентов не изменялась (табл.1), а содержание креатинина в плазме крови, по сравнению с результатом введения только хлорида никеля, снижалось.
Таким образом, диуретический эффект у крыс, вызванный ежедневным внутрижелудочным двухмесячным введением хлорида никеля, обусловлен снижением канальцевой реабсорбции воды, которая на фоне приёма сорбентов Ирлит и НУМС повышается, способствуя уменьшению диуретического действия никеля.
Приём сорбентов не оказал влияния на степень протеинурии и содержание белка в плазме крови, а введение хлорида никеля уже через две недели в 2,45 раза повысило экскрецию белка с мочой (0,11±0,009 мг/мл – контроль, 0,27±0,036 мг/мл – опыт), тогда как в плазме крови наметилась тенденции к снижению его уровня. Степень протеинурии в конце первого месяца интоксикации увеличилась в 10,8 раза, а при завершении экспериментов еще значительнее – в 14,7 раза (табл.1). Одновременно отмечалась гипопротеинемия, которая была меньше контроля, равного 67,88±2,96 г/л, на 15,6% (р<0,02) в конце первого и на 20,0% (р<0,002) – в конце второго месяца. Очевидно, снижение содержания общего белка в плазме крови было обусловлено не только протеинурией, а, возможно, уменьшением синтеза белка в печени, учитывая изменения гистологической структуры органа.
Приём Ирлита на фоне развивающейся интоксикации уже в двухнедельных опытах снизил протеинурию на 33,3% (р<0,05), продолжение экспериментов – на 37,0% (р<0,001) и 25,8% (р<0,05) соответственно к концу первого и второго месяца введения хлорида никеля (табл.1). В варианте с применением НУМС степень протеинурии уменьшилась на 29,7% (р<0,05) и 25,3% (р<0,05) через две недели и к концу месяца (табл.1). Изменения содержания белка плазмы крови обнаружили тенденцию к увеличению как при приёме Ирлита, так и НУМС.
Таким образом, введение крысам хлорида никеля вызывает протеинурию и гипопротеинемию, степень выраженности которых снижается на фоне приёма сорбентов, особенно Ирлита.
Для выяснения механизма снижения канальцевой реабсорбции мы определяли осмолярность коркового и мозгового вещества почечной ткани (по содержанию натрия и мочевины по окончании эксперимента). Проведенные исследования показали, что у интактных животных и получавших сорбенты результаты были близкими по содержанию натрия и мочевины в корковом и мозговом веществе в ткани почек и почечном сосочке, т. е. имел место кортико-папиллярный осмолярный градиент. Введение хлорида никеля изменило содержание осмотически активных веществ в слоях почек. Уровень натрия в корковом веществе незначительно (на 6,8%) снизился, а в мозговом веществе и почечном сосочке с уровней контроля 40,23±0,98 мкмоль/г и 98,53±3,72 мкмоль/г сухого веса – на 7,9% (р<0,05) и 14,0% (р<0,02) соответственно. Содержание мочевины снизилось более значительно: в корковом и мозговом веществе на 12,8% (р<0,05) и 15,3% (р<0,002) сравнительно с уровнем контроля у интактных крыс (19,87±0,82 мкмоль/г и 57,62±1,82 мкмоль/г сухого веса); а в почечном сосочке – на 22,4% (р<0,001), тогда как у интактных крыс концентрация мочевины составляла 131,46±3,94 мкмоль/г сухого веса.
При совместном месячном введении хлорида никеля и Ирлита уровень мочевины в почечном сосочке увеличился на 18,6% (р<0,001), в корковом и мозговом веществах также отмечалось повышение соответственно на 5,2% и 7,1%, но эти изменения были не достоверны. В группе крыс, получавших на фоне интоксикации НУМС, содержание мочевины также достоверно повысилось в почечном сосочке (на 9,3%, р<0,05). Уровень натрия был незначительно увеличен в почечном сосочке как после приёма Ирлита, так и НУМС.
Таким образом, приём сорбентов не оказывает влияния на уровень натрия и мочевины и, соответственно, осмолярность ткани почек крыс, а введение хлорида никеля снижает их содержание, что уменьшает осмолярность интерстиция почек и, как следствие, вызывает угнетение канальцевой реабсорбции воды и повышение величины спонтанного диуреза. При совместном введении крысам хлорида никеля и сорбентов снижение содержания осмотически активных веществ происходит в меньшей степени, что способствует повышению реабсорбции воды в канальцах почек и уменьшению диуретического эффекта хлорида никеля.
Об ионовыделительной функции почек мы судили по обмену натрия, калия и кальция, с определением их содержания в моче и крови, расчетом экскреции, фильтрационных зарядов и канальцевой реабсорбции (для натрия и кальция). Приём сорбентов не оказал заметного влияния на изучаемые параметры, в то время как введение хлорида никеля вызвало изменение всех показателей. Через две недели интоксикации в результате снижения канальцевой реабсорбции натрия с контрольного уровня в 99,66±0,055% до 99,52±0,04% (р<0,05) повысилась его экскреция (р<0,05). Одновременно снизились фильтрационный заряд натрия с интактного уровня в 2499,8±75,1 мкмоль/час/100г до 2247,9±94,85 мкмоль/час/100г (р<0,05) и его содержание в плазме крови 143,23±0,98 ммоль/л и138,54±1,28 ммоль/л (р<0,01). Месячная интоксикация крыс (табл.2) еще более (р<0,001) снизила содержание натрия в крови, а экскреция возросла на 39,2% (р<0,001), что также было обусловлено снижением уровня обратного всасывания катиона (р<0,02) в канальцах почек на фоне сниженного фильтрационного заряда. При завершении хронического эксперимента содержание натрия в плазме крови снизилось до 131,04±0,85 ммоль/л, а его выделение с мочой увеличилось на 71,6%, что также было обусловлено снижением канальцевой реабсорбции (табл.2). Очевидно, что одной из причин снижения канальцевой реабсорбции натрия, которая является активным процессом, и в нем принимает участие Na+, K+АТФ-аза, расщепляющая макроэргические фосфатные связи АТФ и обеспечивающая энергией транспорт этих ионов, может быть снижение активности этого фермента в корковом и мозговом веществах почечной ткани ( и др., 2010) на фоне экотоксикантов.
При совместном с интоксикацией введении Ирлита в течение двух недель отмеченный гипернатриурез снизился на 19,8% (р<0,05) за счет усиления канальцевой реабсорбции с 99,52±0,04% до 99,68±0,05% (р<0,05), которая оставалась повышенной (р<0,002) и в месячных экспериментах, что и способствовало снижению натриуреза на 27,1% (р<0,002), в результате этого содержание натрия в плазме крови (р<0,001) и его фильтрационный заряд (р<0,002) повысились (табл.2). Аналогичные изменения были и при завершении экспериментов в конце второго месяца, с той лишь разницей, что степень их выраженности была меньше, в частности, натриурез снизился на 14,5% (р<0,05). Двухнедельное совместное введение крысам НУМС и хлорида никеля не оказало особого влияния на обмен натрия, но при введении энтеросорбента в течение месяца (табл.2) уровень канальцевой реабсорбции натрия (<0,001), и его концентрация в крови (р<0,05) повысились, а экскреция снизилась на 13,7% (р<0,001). То есть Ирлит (на 27,4%) более эффективно, чем НУМС, снизил натриуретическое действие хлорида никеля.
Таким образом, введение крысам хлорида никеля, снижая канальцевую реабсорбцию натрия, усиливает его экскрецию с мочой и способствует развитию гипонатриемии, а месячный приём сорбентов, особенно Ирлита, уменьшает выраженность этих изменений.
В отношении обмена калия двухнедельная интоксикация стимулировала повышение уровня калия в плазме крови (на 7,2%) и его экскрецию (на 12,3%), которая с пролонгированием введения хлорида никеля до одного месяца сильнее возросла (р<0,02) (табл.2). Однако наиболее выраженные изменения были выявлены в конце второго месяца, когда отмечались достоверные (р<0,001) изменения в данных, характеризующих гиперкалиемию и гиперкалиурез, и увеличение фильтрационного заряда иона (77,67±3,57 мкмоль/час/100г – контроль, 106,14±3,95 мкмоль/час/100г – опыт).
При совместном введении хлорида никеля и сорбентов, как в двухнедельных, так и месячных опытах, особых изменений в обмене калия не отмечалось, и полученные результаты и с Ирлитом, и с НУМС были средними между данными интактных крыс, получавших хлорид никеля. Но в конце второго месяца в варианте исследований с Ирлитом концентрация калия в крови с повышенного до 6,02±0,21 ммоль/л после введения хлорида никеля снизилась на 15,0% (р<0,05). На 13,2% (р<0,001) с величины в 106,14±3,95 мкмоль/час/100г уменьшился и фильтрационный заряд иона, а отмеченный калиурез уменьшился на 8,1% (табл.2).
Причиной гиперкалиемии, возможно, является нарушение осмотической резистентности эритроцитов и гемолиз в результате накопления в крови хлорида никеля. Усиление процесса перекисного окисления липидов и ослабление активности антиоксидантной защиты, нарушение гидрофобности цитоплазматических мембран эритроцитов, послужили причиной снижения осмотической резистентности эритроцитов.
Таким образом, введение крысам хлорида никеля вызывает увеличение фильтрационного заряда калия, гиперкалиурез и гиперкалиемию, степень проявлений которых уменьшает приём сорбентов, особенно Ирлита.
Введение хлорида никеля уже через две недели вызвало изменения всех исследуемых параметров обмена кальция. В результате снижения канальцевой реабсорбции с интактного уровня 98,3±0,06% до 97,77±0,07% (р<0,001) на 17,2% (р<0,05) увеличилась его экскреция, что способствовало снижению его концентрации в плазме крови с 2,32±0,05 ммоль/л до 2,15±0,06 ммоль/л (р<0,05) и фильтрационного заряда с 27,7±0,85 мкмоль/час/100г на 13,9% (р<0,02). Продолжение интоксикации до конца месяца достоверно (р<0,001) усилило снижение кальция в крови на 25,0% и его фильтрационного заряда на 28,8%, а экскрецию – увеличило на 31,9% (р<0,001) вследствие более выраженного снижения канальцевой реабсорбции с 98,3±0,06% до 96,74±0,11% (р<0,001). В конце второго месяца (табл.2) содержание кальция в плазме крови осталось на прежнем уровне, хотя выведение его с мочой в результате повышения фильтрационного заряда и торможения обратного всасывания в канальцевом аппарате увеличилось на 20,9%.
При совместном введении хлорида никеля с Ирлитом в течение двух недель все исследуемые показатели обмена кальция особо не менялись, но после месячных экспериментов концентрация кальция в плазме крови по сравнению с результатами, полученными у интоксицированных крыс достоверно (р<0,001) увеличилась, причиной этого было снижение экскреции в результате усиления канальцевой реабсорбции (р<0,001). Фильтрационный заряд иона не менялся. При завершении опытов в конце второго месяца усилилась канальцевая реабсорбция кальция с 96,74±0,11% до 97,51±0,06% (р<0,001), что способствовало снижению кальциуреза и повышению содержания кальция в крови. Аналогичные изменения, имеющие достоверные отличия по данным содержания кальция в плазме крови, его экскреции и канальцевой реабсорбции, отмечались и в варианте совместного введения хлорида никеля и НУМС (табл.2).
Таким образом, введение крысам хлорида никеля снижает канальцевую реабсорбцию кальция и вызывает гиперкальциурез, приводящий к гипокальциемии, степень проявлений которых снижается при профилактическом приеме сорбентов.
Таблица 1.
Спонтанный диурез, основные процессы мочеобразования и степень протеинурии у крыс с хронической интоксикацией хлоридом никеля и молибдатом аммония и при их совместном введении с сорбентами
Условия опытов | Стат. показа-тели | Диурез | Клубочковая фильтрация | Канальцевая реабсорбция | Содержание белка в моче |
мл/час/100г | % | мг/мл | |||
Интактные | М±m | 0,079±0,004 | 18,37±0,62 | 99,57±0,03 | 0,11±0,009 |
Хлорид никеля 1 месяц | М±m | 0,148±0,005 | 17,45±0,5 | 99,15±0,035 | 1,19±0,11 |
рин. | <0,001 | ٭ | <0,001 | <0,001 | |
Хлорид никеля 2 месяца | М±m | 0,151±0,006 | 20,13±0,94 | 99,25±0,02 | 1,63±0,145 |
рин. | <0,001 | ٭ | <0,001 | 25 // <0,001 | |
Хлорид никеля+Ирлит 1 месяц | М±m | 0,127±0,007 | 18,95±0,78 | 99,33±0,05 | 0,75±0,074 |
рин. // рNi | <0,001// <0,01 | ٭ // ٭ | <0,001// <0,01 | <0,001/<0,001 | |
Хлорид никеля+Ирлит 2 месяца | М±m | 0,128±0,0085 | 18,98±0,51 | 99,35±0,04 | 1,21±0,13 |
рин. // рNi | <0,001 //<0,05 | ٭ // ٭ | <0,001 //<0,05 | <0,001 //<0,02 | |
Хлорид никеля+НУМС 1 месяц | М±m | 0,136±0,004 | 17,89±0,5 | 99,25±0,03 | 0,89±0,08 |
рин. // рNi | <0,001 //<0,05 | ٭ // ٭ | <0,001 //<0,05 | <0,001 //<0,05 | |
Молибдат аммония 1 месяц | М±m | 0,131±0,005 | 14,88±0,62 | 99,12±0,04 | 0,65±0,06 |
рин. | <0,001 | <0,001 | <0,001 | <0,001 | |
Молибдат аммония 2 месяца | М±m | 0,146±0,004 | 14,6±0,72 | 99,0±0,04 | 1,35±0,12 |
рин. | <0,001 | <0,001 | <0,001 | <0,001 | |
Молибдат аммония+Ирлит 1 месяц | М±m | 0,109±0,005 | 15,79±0,58 | 99,31±0,06 | 0,38±0,03 |
рин.//рMo | <0,001/<0,002 | <0,05 // ٭ | <0,002 // ٭ | <0,001/<0,001 | |
Молибдат аммония+Ирлит 2 месяца | М±m | 0,133±0,004 | 15,13±0,7 | 99,12±0,04 | 0,97±0,08 |
рин. //рMo | <0,001/<0,001 | <0,05 // ٭ | <0,001/<0,001 | <0,001 //<0,02 | |
Молибдат аммония+НУМС 1 месяц | М±m | 0,116±0,004 | 16,11±0,71 | 99,28±0,06 | 0,49±0,04 |
рин. //рMo | <0,001 //<0,05 | ٭ // ٭ | <0,01 // <0,05 | <0,001 //<0,05 |
Примечание ٭ отсутствие достоверности изменений. Рин – при сравнении с интактными животными; рNi, pMo – при сравнении с опытами с введением металлов.
Таблица 2.
Содержания в крови и экскреции натрия, калия и кальция у крыс с хронической интоксикацией хлоридом никеля и молибдатом аммония и при их совместном введении с сорбентами
Условия опытов | Стат. показа-тели | НАТРИЙ | КАЛИЙ | КАЛЬЦИЙ |
Содержание в крови (ммоль/л) | ||||
Экскреция (мкмоль/час/100г) | ||||
Интактные | М±m | 143,23±0,98 | 4,45±0,18 | 2,32±0,05 |
8,14±0,4 | 5,52±0,33 | 0,47±0,02 | ||
Хлорид никеля 1 месяц | М±m | 133,05±0,98 | 4,91±0,19 | 1,74±0,06 |
11,33±0,57 | 6,71±0,36 | 0,62±0,05 | ||
ркровь//экскрец. | <0,001//<0,001 | ٭// <0,02 | <0,001 // <0,001 | |
Хлорид никеля 2 месяца | М±m | 131,04±0,85 | 6,02±0,21 | 1,76±0,05 |
13,97±0,62 | 7,22±0,39 | 0,75±0,06 | ||
ркровь//экскрец. | <0,001 // <0,001 | <0,001 // <0,001 | <0,001 // <0,001 | |
Хлорид никеля+Ирлит 1 месяц | М±m | 139,18±1,34 | 4,75±0,26 | 2,09±0,06 |
8,89±0,72 | 6,22±0,35 | 0,58±0,03 | ||
рин. // рNi | ٭ // <0,001 | ٭ // ٭ | <0,02 // <0,001 | |
٭ // <0,002 | ٭ // ٭ | <0,01 // ٭ | ||
Хлорид никеля+Ирлит 2 месяца | М±m | 137,04±0,53 | 5,12±0,19 | 2,02±0,07 |
11,95±0,69 | 6,64±0,26 | 0,62±0,03 | ||
рин. // рNi | <0,001 // <0,001 | <0,05 // <0,05 | <0,001 // <0,01 | |
<0,001 // <0,05 | <0,02 // ٭ | <0,05 // <0,002 | ||
Хлорид никеля+НУМС 1 месяц | М±m | 135,92±0,94 | 4,88±0,18 | 2,06±0,06 |
9,78±0,51 | 6,21±0,39 | 0,53±0,02 | ||
рин. // рNi | <0,01 // <0,05 | ٭ // ٭ | ٭ // <0,001 | |
<0,02 // <0,001 | ٭ // ٭ | ٭ // <0,05 | ||
Молибдат аммония 1 месяц | М±m | 137,24±1,03 | 6,01±0,19 | 2,58±0,06 |
11,82±0,56 | 7,21±0,37 | 0,73±0,05 | ||
ркровь//экскрец. | <0,001 // <0,001 | <0,001 // <0,002 | <0,01 // <0,001 | |
Молибдат аммония 2 месяца | М±m | 135,12±1,16 | 6,32±0,27 | 2,67±0,08 |
12,64±0,52 | 7,45±0,35 | 0,82±0,06 | ||
ркровь//экскрец. | <0,001 // <0,001 | <0,001 // <0,001 | <0,001 // <0,001 | |
Молибдат аммония+Ирлит 1 месяц | М±m | 140,32±1,34 | 4,51±0,23 | 2,45±0,05 |
10,25±0,83 | 5,52±0,37 | 0,59±0,03 | ||
рин. // рMo | ٭ // ٭ | ٭ // ٭ | <0,05 // ٭ | |
٭ // ٭ | ٭ // ٭ | <0,05 // <0,02 | ||
Молибдат аммония+Ирлит 2 месяца | М±m | 138,91±0,82 | 4,69±0,26 | 2,51±0,06 |
11,84±0,92 | 5,81±0,29 | 0,64±0,04 | ||
рин. // рMo | <0,05 // ٭ | ٭ // ٭ | <0,05 // <0,05 | |
<0,01 // ٭ | ٭ // ٭ | <0,05 // <0,05 | ||
Молибдат аммония+НУМС 1 месяц | М±m | 140,05±0,98 | 5,32±0,26 | 2,52±0,08 |
10,86±0,61 | 6,22±0,28 | 0,63±0,04 | ||
рин. // рMo | <0,01 // ٭ | ٭ // ٭ | <0,02 // ٭ | |
<0,01 // ٭ | ٭ // ٭ | <0,01 // <0,05 |
Примечание ٭ отсутствие достоверности изменений. Обозначения - как в табл. 1.
Изучение влияния молибдата аммония на функцию почек у крыс показало, что ежедневное внутрижелудочное его введение в дозе 50,0 мг/кг в течение двух недель повысило
спонтанный диурез на 27,8% (0,101±0,006 мл/час/100г, р<0,001), с продолжением интоксикации диуретический эффект усиливался, уже превосходя интактный контроль в конце первого месяца на 65,8% (0,131±0,005 мл/час/100г) и на 84,8% (0,146±0,004 мл/час/100г) – через два месяца.
При совместном введении молибдата аммония и Ирлита (табл.1) спонтанный диурез через две недели был такой же как в контроле, а в одно - и двухмесячных экспериментах снизился на 16,8% (р<0,002) и 9,0% (р<0,002). Уменьшение диуреза было и при приеме НУМС на фоне интоксикации: на 19,9% (р<0,01) – через две недели и на 11,5% (р<0,05) – через месяц.
Изучение основных процессов мочеобразования после двухнедельного введения молибдата аммония выявило снижение скорости клубочковой фильтрации до 15,78±0,56 мл/час/100г (р<0,002), а отмеченное повышение диуреза было обусловлено угнетением (р<0,001) канальцевой реабсорбции воды с 99,57±0,03% до 99,36±0,04%, которая в конце первого месяца, на фоне продолжающегося снижения гломерулярной фильтрации (14,88±0,62 мл/час/100г, р<0,001), стала еще меньше – 99,12±0,04% (р<0,001) и с продолжением интоксикации снизилась до 99,0±0,04% к концу второго месяца, хотя клубочковая фильтрация в это время оставалась на прежнем уровне (табл.1). Изменение основных процессов мочеобразования сопровождалось постоянным повышением содержания креатинина в плазме крови (контроль 81,24±3,36 мкмоль/л): на 7,1% – через две недели; на 13,5% – в конце первого месяца (р<0,05) и на 22,1% (р<0,01) – при завершении опытов.
При совместном введении молибдата аммония и Ирлита скорость клубочковой фильтрации по сравнению с данными интактных крыс увеличилась, хотя и была меньше интактного контроля, а ослабление диуретического действия молибдата аммония было обусловлено усилением канальцевой реабсорбции воды (табл.1). Аналогичные изменения происходили у крыс при приеме на фоне интоксикации НУМС (табл.1). Уровень креатинина в плазме крови в этом случае стал незначительно меньше результатов с интоксикацией.
В отношении влияния молибдата аммония на содержание белка в моче и крови проведенные исследования показали, что после двух недель интоксикации степень протеинурии от уровня контроля (0,11±0,009 мг/мл) повысилась в 2,6 раза, достигнув величины 0,29±0,02 мг/мл. Уровень общего белка в плазме крови при этом оставался близким к контролю, но в конце первого месяца, когда протеинурия превышала контроль в 5,9 раза, он снизился до 61,28±3,04 г/л. При завершении опытов содержание белка в моче увеличилось в 12,7 раза (табл.1), что, очевидно, наряду с отмеченным патоморфологическим состоянием печени, было причиной развившейся гипопротеинемии (56,82±2,45 г/л, р<0,01).
Введение сорбентов на фоне развивающейся интоксикации молибдатом аммония вызвало уменьшение протеинурии, которая при двухнедельном приеме Ирлита стала на 38,0% (р<0,001) меньше данных, полученных после введения крысам только ксенобиотика, а уровень белка в плазме крови нормализовался. С продолжением интоксикации до конца первого, а затем и второго месяцев степень протеинурии (табл.1) также снижалась (на 41,6%, р<0,001 и на 28,2%, р<0,02), а содержание белка в крови в конце второго месяца стало 59,36±2,24 г/л. В варианте с НУМС содержание белка в плазме крови в первые две недели оставалось в пределах нормы, а в конце месяца было 61,25±2,73 г/л. Меньше была и степень протеинурии – на 17,2% через две недели и на 24,2% (р<0,05) – в конце месяца (табл.1).
Таким образом, хроническое введение крысам молибдата аммония повышает в плазме крови содержание креатинина и снижает уровень общего белка, вызывает протеинурию и, несмотря на уменьшение скорости клубочковой фильтрации, оказывает диуретическое действие в результате снижения канальцевой реабсорбции воды. Приём сорбентов (особенно Ирлита) на фоне молибденовой интоксикации в результате возрастания канальцевой реабсорбции воды уменьшает диуретическое действие металла, снижает выраженность протеинурии и способствует повышению содержания белка в крови. Причем при необходимости проведения недлительной профилактики токсических влияний молибдена можно использовать оба сорбента, а при более длительной – целесообразнее применять Ирлит.
Для объяснения причины отмеченного снижения канальцевой реабсорбции воды в конце первого месяца в слоях почек определяли содержание натрия и мочевины, то есть осмолярность интерстиция. Интоксикация крыс молибдатом аммония снизила содержание натрия в корковом веществе на 5,2%, в мозговом – на 8,4% и в почечном сосочке – на 10,2%. Аналогичная картина наблюдалась и в отношении мочевины, уровень которой в корковом веществе с контрольной величины в 19,87±0,82 мкмоль/г влажного веса снизился на 15,6% (р<0,05), в мозговом веществе с 57,62±1,82 мкмоль/г влажного веса – на 19,3% (р<0,001) и в почечном сосочке с 168,12±4,24 мкмоль/г влажного веса – на 25,4% (р<0,001). Если осмотическое давление отдельно в каждом слое почечной ткани интактных крыс по суммарному содержанию в них натрия и мочевины принять за 100%, то после месячного введения молибдата аммония произошло снижение на 9,9%, 15,2% и 19,8% соответственно в каждом слое. Очевидно, что именно такое уменьшение кортико-папиллярного осмолярного градиента является одним из условий, определяющих снижение канальцевой реабсорбции воды и повышение диуреза.
При совместном месячном введении молибдата аммония и Ирлита содержание натрия в ткани почек стало почти таким же, как у контрольных, а уровень мочевины в слоях почек по сравнению с результатами у интоксицированных крыс достоверно увеличился: на 15,0% и 14,8% в корковом (р<0,05) и мозговом (р<0,05) веществе и на 21,4% (р<0,002) – в почечном сосочке. В группе крыс, которым на фоне интоксикации вводили НУМС, содержание мочевины увеличилось в мозговом веществе на 18,5% (р<0,05) и в почечном сосочке – на 22,8% (р<0,05). Суммарная осмолярность в слоях почек повысилась на 10,2%, 11,25% и 17,9% (при приёме Ирлита) и на 6,1%, 15,0% и 15,9% (при приёме НУМС), что и усиливало канальцевую реабсорбцию воды.
Таким образом, хроническое введение крысам молибдата аммония снижает в слоях ткани почек содержание натрия и мочевины, уменьшая осмолярность интерстиция и канальцевую реабсорбцию воды, а приём сорбентов Ирлита и НУМС, повышая содержание мочевины и натрия, увеличивает обратное всасывание воды в канальцах почек и снижает диуретической эффект молибдата аммония.
Экскреция натрия при двухнедельной интоксикации увеличилась до 10,58±0,43 мкмоль/час/100г (р<0,01), что было на 29,9% (р<0,001) больше контроля, но содержание его в плазме крови практически не изменилось (140,64±1,58 ммоль/л). Причиной усиления натриуреза, несмотря на снижение фильтрационного заряда натрия с 2499,8±75,1 мкмоль/час/100г до 2146,9±93,75 мкмоль/час/100г (р<0,01), было уменьшение канальцевой реабсорбции с 99,66±0,055% до 99,48±0,04% (р<0,02). При месячной интоксикации снижение фильтрационного заряда стало значительней (2022,3±104,8 мкмоль/час/100г, р<0,002), но и обратное всасывание натрия в канальцах почек еще сильнее уменьшилось (р<0,002), в результате чего увеличилась экскреция (табл.2), что привело к гипонатриемии (р<0,001). При завершении экспериментов в конце второго месяца уровень натрия в крови снизился до 135,12±1,16 ммоль/л, а выделение его с мочой продолжало нарастать (на 55,2%, р<0,001), вследствие того, что уменьшалась канальцевая реабсорбция (р<0,001), несмотря на снижение фильтрационного заряда натрия (р<0,001).
При совместном введении Ирлита и молибдата аммония в течение двух недель экскреция натрия начала снижаться, а фильтрационный заряд и канальцевая реабсорбции иона – повышаться, и уровень иона в плазме крови нормализовался. С продолжением интоксикации до конца месяца экскреция натрия, по сравнению с введением только одного токсиканта, уменьшилась на 13,3% (таб.2). При завершении экспериментов до конца второго месяца приём Ирлита хоть и продолжал сдерживать влияние молибдата аммония на обмен натрия, но уже не столь значительно, и его выделение с мочой было только на 6,4% меньше результата при интоксикации. Введение крысам молибдата аммония и НУМС в течение месяца (табл.2) не оказало столь заметного, как Ирлит, влияния на содержание натрия в плазме крови и его обработку в почках (натриурез стал меньше только на 8,2%).
Таким образом, хроническое введение крысам молибдата аммония в результате снижения канальцевой реабсорбции натрия усиливает его выделение с мочой и вызывает гипонатриемию, а прием сорбентов, особенно Ирлита в течение одного месяца, уменьшает степень этих изменений.
Введение крысам молибдата аммония в течение двух недель способствовало повышению содержания калия в плазме крови с 4,45±0,18 ммоль/л до 5,63±0,22 ммоль/л (р<0,001), а экскреция увеличилась на 19,4% с 5,52±0,33 мкмоль/час/100г до 6,59±0,29 мкмоль/час/100г (р<0,05). Фильтрационный заряд калия не менялся. Продолжение интоксикации еще в течение двух недель (табл.2) усилило гиперкалиемию на 35,0% (р<0,001), а калиурез – на 30,6% (р<0,002), но наиболее выраженные изменения были в конце второго месяца введения молибдата аммония, когда повысились на 40,0% (р<0,001) содержание калия в плазме крови, на 34,9% (р<0,001) – его экскреция (табл.2). Фильтрационный заряд также увеличился (р<0,02).
При совместном введении молибдата аммония и сорбентов по всем исследуемым показателям отмечались изменения в сторону нормализации, и по результатам месячных экспериментов Ирлит оказывал более выраженное нормализующее влияние на обмен калия (табл.2).
Таким образом, введение крысам молибдата аммония вызывает гиперкалиемию и гиперкалийурез, которые не выявляются при совместном приёме на фоне интоксикации сорбентов Ирлит и НУМС, особенно Ирлита.
В отношении влияния молибдата аммония на обмен кальция можно отметить, что двухнедельная интоксикация в результате снижения канальцевой реабсорбции кальция с интактного уровня в 98,3±0,06% до 97,69±0,08% (р<0,001) повысила его экскрецию с мочой на 23,4% (р<0,01). При этом незначительно увеличилось содержание кальция в плазме крови, а фильтрационный заряд, вследствие падения скорости клубочковой фильтрации, наоборот, снизился. Месячное введение молибдата аммония вызвало гиперкальциемию (р<0,01), и одновременно в результате большего снижения канальцевой реабсорбции (р<0,001) при оставшемся на прежнем уровне фильтрационном заряде повышалось выделение кальция с мочой, уже превосходя контроль на 69,7% (р<0,001) (табл.2). При продолжении молибденовой интоксикации еще в течение одного месяца содержание кальция в крови увеличилось до 2,67±0,08 ммоль/л, и одновременно при этом росла экскреция, которая превосходила контроль на 74,4% (р<0,001). Количество кальция, профильтровавшегося через клубочки нефронов, несмотря на гиперкальциемию, не менялось за счёт снижения скорости клубочковой фильтрации, а отмеченный кальциурез был обусловлен более выраженным снижением канальцевой реабсорбции до 96,73±0,09% (р<0,001).
То, что в условиях хронической молибденовой интоксикации кальцийурез сопровождался гиперкальциемией при неизменившемся поступлении кальция с пищей, говорит о том, что содержание кальция в крови пополняется из костей, что было отмечено еще в 1989 году
В варианте совместного двухнедельного приёма молибдата и Ирлита концентрация кальция в плазме крови, экскреция, фильтрационный заряд и канальцевая реабсорбция кальция нормализовались (табл.2), а при месячном эксперименте отмечалось усиление канальцевой реабсорбции кальция (р<0,001) и уменьшение гиперкальциуреза (р<0,02). Концентрация кальция в крови незначительно снизилась. В конце второго месяца профилактического приема Ирлита на фоне интоксикации уровень кальция в плазме крови (р<0,05) и его экскреция (р<0,05) снизились (табл.2), что было обусловлено повышением до 97,53±0,09% канальцевой реабсорбцией иона. При совместном введении молибдата аммония и НУМС содержание кальция в плазме крови, его экскреция, фильтрационный заряд и канальцевая реабсорбция стали ближе к контролю, но если проводить сравнение эффективности приёма сорбентов, то Ирлит в двухнедельных опытах уменьшал кальциурический эффект молибдена на 19,0%, в одно - и двухмесячных – на 19,2% и 21,9%, гиперкальциемию снизил на 2,5%, 5,3% и 5,9% соответственно, а НУМС снижал экскрецию кальция на 27,6% и 13,7%, уменьшение гиперкальциемии было на 2,5% и 5,4%. То есть при необходимости проведения недлительной профилактики изменений обмена кальция, вызванных интоксикацией молибдатом аммония, целесообразно применять НУМС, а при более длительной – Ирлит.
Таким образом, введение крысам молибдата аммония уже через две недели, в результате снижения обратного всасывания кальция в канальцевом аппарате почек, вызывает кальциурез. Продолжение интоксикации приводит к усилению экскреции кальция вследствие большего снижения обратного всасывания иона в канальцах почек. Одновременно с кальциурезом через один месяц введения молибдата, вследствие его способности вымывать кальций из костей, возникает гиперкальциемия. При совместном введении молибдата аммония и сорбентов, способных связывать и выводить из организма металл с калом, в результате чего уменьшается его токсический эффект, исследуемые показатели меняются в сторону нормализации. При этом НУМС эффективнее при приёме на недлительное время (две недели), а Ирлит – при необходимости более длительного приёма.
Исследование почечных эффектов хронического введения паравольфрамата аммония не выявило изменений показателей основных процессов мочеобразования в условиях спонтанного диуреза, но в условиях водного диуреза в конце второго месяца интоксикации отмечалось уменьшение процента выведения водной нагрузки, что было обусловлено уменьшением клубочковой фильтрации на втором часе и более высокими цифрами канальцевой реабсорбции воды. То есть степень повреждающего влияния паравольфрамата аммония на функции почек у крыс не столь значительна, как у хлорида никеля и молибдата аммония, и проявляется в виде функциональной недостаточности канальцево-клубочкового аппарата в условиях водной нагрузки.
Сердечно-сосудистая система одной из первых подвергается токсическому воздействию ксенобиотиков. Хроническая интоксикация крыс хлоридом никеля, молибдатом и паравольфраматом аммония вызывала развитие токсической кардиопатии, которая наряду с отдельными специфическими признаками, характерными для каждого металла, имела общие проявления. Так, введение крысам хлорида никеля повысило среднее артериальное давление на 7,2% (через один месяц) и 12,2% (через два месяца) в результате усиления на 28,2% и 43,5% удельного периферического сосудистого сопротивления, несмотря на 16,6% и 20,2% снижение сердечного индекса (рис.1), т. е. системная гемодинамика приобрела признаки гипокинетического типа.
Интоксикация крыс молибдатом аммония в течение одного месяца увеличила среднее артериальное давление на 9,9% вследствие увеличения (р<0,001) удельного периферического сосудистого сопротивления, хотя сердечный индекс при неменяющейся частоте сердечных сокращений снижался (р<0,01). С продолжением введения молибдата аммония (рис.1) еще в течение одного месяца, среднее артериальное давление уже снизилось на 12,5% в результате более значительного снижения (на 29,5%) сердечного индекса.
Введение паравольфрамата аммония вызвало изменения гемодинамических показателей, аналогичные тем, которые были при интоксикации молибдатом аммония: через один месяц – рост среднего артериального давления вследствие усиления сосудистого сопротивления (р<0,001), несмотря на снижение сердечного индекса (р<0,05); через два месяца – снижение на 25,1% артериального давления, причиной которого было уменьшение на 26,0% сердечного индекса.
Что могло способствовать изменению удельного периферического сосудистого сопротивления и сердечного выброса при интоксикации крыс? Введение никеля приводит к нарушению вазоконстрикторных и вазодилятационных свойств эндотелия сосудов, их повреждению, активации адгезии тромбоцитов, высвобождению фактора роста и стимуляции пролиферации гладкомышечных клеток артерий ( C., 1987). Всё это, а также снижение продукции оксида азота в эндотелии сосудов, нарушение кальциевого гомеостаза, дисбаланс перекисного окисления липидов и антиоксидантной защиты с активацией процессов прооксидантной направленности, дезорганизацией клеточных структур могут стать причиной повышения сосудистого сопротивления (Demontis M. P. et al., 1998; Satarug S. Et al., 2005). Кроме того, хроническая интоксикация цветными металлами приводит к выраженным дистрофическим изменениям миокарда со снижением его сократительной способности. Так, никель, конкурируя с ионами кальция, уменьшает силу сердечного удара и снижает левожелудочковую контрактильность, а молибден, вследствие разобщения окислительного фосфорилирования, оказывает токсическое влияние на пластический и энергетический обмен миокарда ( и соавт., 2009; и соавт., 2009). К тому же образующиеся при кардиопатиях аутоантитела уменьшают на мембране кардиомиоцитов плотность β-адренорецепторов, снижает содержание Gs-белка, аденилатциклазы, цАМФ и ток кальция в клетку, что способствует снижению сократимости миокарда (, 2007). В проведенных нами исследованиях наряду с отмеченным снижением β-адренореактивности усиливалась α-адренореактивность, что проявлялось в виде повышения прессорных ответов на введение норадреналина.
Профилактическое использование энтеросорбентов уменьшало эффекты хронической интоксикации солями тяжелых цветных металлов на состояние сердечно-сосудистой системы и адренореактивность. Так, введение Ирлита на фоне месячной интоксикации крыс хлоридом никеля незначительно ослабило негативное влияние ксенобиотика на системную гемодинамику (рис.1). А использование энтеросорбента в течение двух месяцев способствовало меньшему снижению ударного (р<0,05) и сердечного индексов (р<0,05), менее выраженному повышению удельного периферического сосудистого сопротивления (р<0,01) и, соответственно, изменению артериального давления (рис.1). Степень адренореактивного ответа на введение норадреналина и адреналина была выражена слабее.
Аналогичные изменения системной гемодинамики и адренореактивности наблюдались и при профилактическом приёме НУМС на фоне никелевой интоксикации в течение одного месяца (рис.1). При этом положительная тенденция в изменениях была более выражена при приёме НУМС. Такая же динамика отмечалась при использовании сорбентов на фоне интоксикации молибдатом аммония, особенно через два месяца введения Ирлита, когда ударный и сердечный индексы стали достоверно
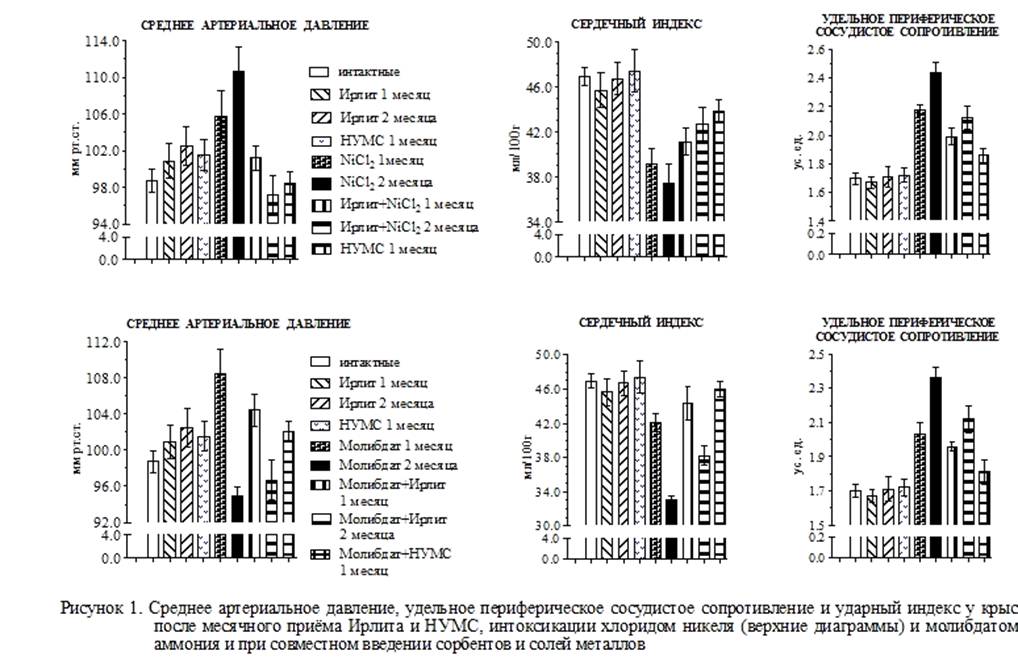
(р<0,01) выше, а удельное периферическое сосудистое сопротивление ниже, чем у крыс с интоксикацией.
Таким образом, прием энтеросорбентов, ограничивая всасывание солей тяжелых металлов из желудочно-кишечного тракта и усиливая их выведение из организма, способствует меньшему их накоплению в тканях и повреждающему действию.
Различные патологические состояния, в том числе интоксикации солями металлов переменной валентности и различными ксенобиотиками, способствуют накоплению активных форм кислорода, активации перекисного окисления липидов и снижению антиоксидантной защиты клеток, что способствует развитию оксидативного стресса (Маршалл В. Дж., 2000; , 2001; Wiseman Н., Halliwell В., 1996).
Содержание метгемоглобина в крови у интактных крыс было 0,91±0,07%, и оно не изменилось после приёма сорбентов, а введение хлорида никеля, молибдата аммония и паравольфрамата аммония повысило его в 7,3, 6,4 и 2,15 раза соответственно. При совместном с интоксикацией введении сорбентов метгемоглобинемия была не столь значительной (3,95±0,28% и 3,27±0,25% при приёме Ирлита с хлоридом никеля и молибдатом аммония; 4,36±0,37% и 3,55±0,36% с НУМС), а с паравольфраматом аммония уровень метгемоглобина почти нормализовался.
Приём сорбентов также не изменил содержание в плазме крови гидроперекисей и малонового диальдегида в эритроцитах, активность каталазы и супероксиддисмутазы остались близкими к контрольным значениям. При введении крысам хлорида никеля в течение одного месяца достоверно (р<0,001) повысились уровни гидроперекисей на 80,2% и малонового диальдегида на 53,7% (контроль – 2,89±0,16 мкмоль/л и 29,25±0,41 мкмоль/л). Более интенсивное повышение гидроперекисей отражало активацию перексисного окисления липидов и образование первичных продуктов свободнорадикального окисления. Одновременно снижалась активность каталазы на 23,4%, а супероксиддисмутазы – на 11,1% (контроль – 6,21±0,35 х10-4 МЕ/гHb и 70,3±1,74 ед. ингибир.). Менее выраженное снижение активности супероксиддисмутазы, очевидно, связано с тем, что кофактором её активного центра является никель (Barondeau D. P. et al., 2004; Wuerges J., et al., 2004).
При совместном введении крысам хлорида никеля и Ирлита содержание гидроперекисей и малонового диальдегида снизилось на 24,4% и 14,1%, а при приёме НУМС – на 21,0% и 9,1%. Одновременно усилилась активность каталазы на 19,1% и супероксиддисмутазы на 9,0% с Ирлитом; на 15,3% и 8,1% – с НУМС.
Во взаимоотношении системы перекисного окисления липидов и антиоксидантной защиты у крыс, получавших молибдат аммония, также отмечался дисбаланс в сторону активации прооксидантных процессов, и содержание гидроперекисей и малонового диальдегида повысилось до 4,68±0,29 мкмоль/л (на 61,9%, р<0,001) и 39,16±0,94 мкмоль/л (на 33,8%, р<0,001), а активность супероксиддисмутазы снизилась до 59,45±1,72 ед. ингибир. (р<0,001) и каталазы – до 5,18±0,26 х10-4 МЕ/гHb (р<0,05). На фоне профилактического использования сорбентов содержание гидроперекисей и малонового диальдегида уменьшилось на 19,5% и 12,1% (Ирлит) и на 16,3% и 11,2% (НУМС), а активность супероксиддисмутазы как после Ирлита (р<0,05), так и НУМС (р<0,01) повысилась.
Исследования, проведенные на фоне экспозиции паравольфраматом аммония, показали активацию системы свободного радикального окисления с повышением концентрации малонового диальдегида (р<0,001) и гидроперекисей (р<0,01) с одновременным снижением активности супероксиддисмутазы (р<0,01), но степень изменений была не столь выраженной, как при интоксикации крыс хлоридом никеля и молибдатом аммония, а профилактическое использование энтеросорбентов, особенно Ирлита, способствовало нормализации исследуемых показателей.
Таким образом, хроническое введение крысам хлорида никеля, молибдата и паравольфрамата аммония способствует увеличению содержания метгемоглобина, не способного к выполнению кислород-транспортной функции, что приводит к гемической гипоксии, неполному восстановлению кислорода в дыхательной цепи, образованию активных форм кислорода, активации процесса перекисного окисления липидов и снижению антиоксидантной защиты. Эти процессы были особенно выраженных при интоксикации хлоридом никеля и молибдатом аммония. Приём сорбентов Ирлита и НУМС уменьшает содержание метгемоглобина, гидроперекисей и малонового диальдегида и усиливает активность супероксиддисмутазы и каталазы.
Полученные в ходе работы результаты представлены в патофизиологической схеме, показывающей, что двухмесячное ежедневное внутрижелудочное введение крысам линии Вистар хлорида никеля (25,0 мг/кг), молибдата аммония (50,0 мг/кг) и паравольфрамата аммония (50,0 мг/кг) вызывает повышение концентрации металлов

 |
 |
![]() Патофизиологическая схема хронической интоксикации крыс хлоридом никеля, молибдатом аммония и паравольфраматом аммония
Патофизиологическая схема хронической интоксикации крыс хлоридом никеля, молибдатом аммония и паравольфраматом аммония
в крови, что приводит к метгемоглобинемии, нарушению дисбаланса перекисного окисления липидов и антиоксидантной защиты, накоплению их в печени, почках, миокарде и сосудах, вызывая токсическую нефро - и кардиопатии, на фоне которых отмечается увеличение спонтанного диуреза, гиперпротеинурия и гипопротенемия, гипернатри - и кальциурез, гипонатри-и кальциемия, гиперкалиемия и гиперкалиурез, гипокинетический тип системной гемодинамики, изменяется адренореактивность. Внутрижелудочный, через день, прием на фоне интоксикации нанокомпозитных энтеросорбентов – природной глины Ирлит-1 и модифицированного углеродного НУМС (по 2,5 мл/100г 6,0% растворов) в результате усиления связывания металлов в желудочно-кишечном тракте и повышения их выведения с калом снижает концентрации металлов в крови и их накопление в органах, ослабляет пероксидацию и повышает антиоксидантную защиту, уменьшает степень нарушений функции почек и системной гемодинамики с восстановлением адренореактивности.
О Б Щ И Е В Ы В О Д Ы
1. Ежедневное, в течение двух месяцев, внутрижелудочное введение крысам линии Вистар хлорида никеля в дозе 25,0 мг/кг и молибдата аммония в дозе 50,0 мг/кг (из расчёта массовых долей металлов) способствует созданию модели хронической никелевой и молибденовой интоксикации, со значительным увеличением содержания этих металлов в крови, моче и кале, а также в ткани почек, печени и миокарда.
2. Внутрижелудочное через день введение крысам линии Вистар, на фоне интоксикации хлоридом никеля и молибдатом аммония, природного сорбента Ирлит (в течение двух месяцев) и модифицированного нанокомпозитного углеродного сорбента НУМС (в течение одного месяца) снижает уровнь никеля и молибдена в крови и моче и их накопление в тканях, но повышает содержание в кале. При этом НУМС более эффективно препятствует накоплению молибдена в печени и миокарде, а Ирлит – молибдена в почках и никеля во всех изучаемых органах.
3. Хроническая интоксикация крыс хлоридом никеля и молибдатом аммония повышает содержание креатинина в крови, увеличивает спонтанный диурез в результате торможения канальцевой реабсорбции воды, обусловленной уменьшением осмолярности ткани почек, вследствие уменьшения содержания мочевины и натрия; вызывает протеинурию и гипопротеинемию; снижает канальцевую реабсорбцию натрия и кальция, усиливая их экскрецию и способствуя развитию гипонатри - и кальциемии; оказывает калиуретическое и гиперкалиемическое действие.
4. Совместное введение ксенобиотиков и энтеросорбентов Ирлита и НУМС способствует в результате усиления выведения токсикантов из организма уменьшению их повреждающего влияния на функции почек, проявляющемуся в усилении канальцевой реабсорбции воды и снижении диуретического эффекта, ослаблении протеинурии и гипопротеинемии, а также отмеченными изменениями ионовыделительной функции почек, при этом эффективность НУМС ограничивается двумя неделями, а у Ирлита сохраняется в течение месяца и проявляется более выраженно.
5. При хронической интоксикации хлоридом никеля происходит повышение среднего артериального давления вследствие выраженного увеличения периферического сосудистого сопротивления. При этом возрастает α-адренореактивность и снижается β-адренореактивность сердечно-сосудистой системы. Профилактическое применение энтеросорбентов в условиях хронической интоксикации приводит к снижению выраженности изменений показателей системной гемодинамики и адренореактивности при хроническом воздействии хлорида никеля.
6. При хронической интоксикации молибдатом аммония через месяц эксперимента происходит повышение среднего артериального давления, вследствие выраженного увеличения периферического сосудистого сопротивления, а через два месяца – падение среднего артериального давления в результате снижения сердечного индекса. При этом возрастает α-адренореактивность и снижается β-адренореактивность сердечно-сосудистой системы. Профилактическое применение энтеросорбентов приводит к снижению выраженности изменений показателей системной гемодинамики и адренореактивности при хроническом воздействии молибдата аммония.
7. Ежедневное, в течение двух месяцев, внутрижелудочное введение крысам линии Вистар паравольфрамата аммония в дозе 50,0 мг/кг (из расчёта массовой доли металла) способствует созданию модели хронической вольфрамовой интоксикации, при которой в условиях спонтанного диуреза наблюдается натрийуретическое действие, существенно не меняется водовыделительная функция почек, но снижается способность к выведению водной нагрузки. Введение паравольфрамата аммония в течение одного месяца повышает, вследствие прироста удельного периферического сосудистого сопротивления, среднее артериальное давление, которое к концу второго месяца снижается за счет падения ударного и сердечного индексов. Профилактическое применение энтеросорбентов Ирлита и НУМС, уменьшая поступление вольфрама в организм, ослабляет выраженность гистологических проявлений и функциональных изменений со стороны сердечно-сосудистой системы и почек.
8. Токсическое действие солей тяжелых цветных металлов при внутрижелудочном введении подтверждается гистоморфологическими изменениями органов, выявляются выраженные альтеративные, дистрофические, некробиотические и дисциркуляторные изменения во внутренних органах, особенно в печени и почках, степень проявлений которых уменьшается при одновременном приёме сорбентов Ирлита и НУМС.
9. Хроническая интоксикация крыс хлоридом никеля, молибдатом аммония и паравольфраматом аммония вызывает метгемоглобинемию, способствует образованию активных форм кислорода, которые усиливают процесс перекисного окисления липидов (по накоплению в плазме крови гидроперекисей и малонового диальдегида в эритроцитах) и ослабляют антиоксидантную защиту, о чем можно судить по данным снижения активности каталазы и супероксиддисмутазы в эритроцитах. Эти изменения особенно выражены при интоксикации хлоридом никеля и молибдатом аммония, а приём на фоне интоксикации сорбентов Ирлита и НУМС уменьшает в крови уровень метгемоглобина, содержание гидроперекисей и малонового диальдегида и усиливает активность каталазы и супероксиддисмутазы.
Список работ, опубликованных по теме диссертации
1. Албегова хлорида никеля на функции почек у крыс // Научные труды II съезда физиологов СНГ. – Кишинэу, 2008. – С.136.
2. Албегова природного минерала Ирлит-1 и сорбента НУМС-0-3 БМЦ на функции почек при хронической интоксикации хлоридом никеля // Научные труды II съезда физиологов СНГ. – Кишинэу, 2008. – С.136.
3. , , Головизина эффект усиления экскреции некоторых токсичных элементов при интрагастральном введении никеля и нанокомпозитного углерод - углеродного сорбента // Труды международной научно-практической конференции «Нанотехнологии – производству 2007». – Москва, 2008. – С.480.
4. Албегова вольфрамата аммония на ионо - водовыделительную функцию почек и системную гемодинамику у крыс // Тезисы доклада VII Всероссийской конференции с международным участием, посвященной 160-летию со дня рождения «Механизмы функционирования висцеральных систем». – Санкт-Петербург, 2009. – С.22-23.
5. , , Кабисов применения нанокомпозитных материалов как энтеросорбентов для профилактики нефро - и кардиотоксического действия металлов // Материалы III Международной научно-практической конференции «Актуальные проблемы биологии, нанотехнологий и медицины». – Ростов-на-Дону, 2009. – С.74-75.
6. , , Албегова применение глины Ирлит-1 и НУМС-0-3 БМЦ при нарушениях ионо-водовыделительной функции почек на фоне хронической интоксикации молибденом у крыс // Материалы 10-й юбилейной научной сессии, посвященной 70-летию СОГМА «Актуальные проблемы медицины» – Владикавказ, 2009. – С.25.
7. , , Албегова применения глины «Ирлит-1» и НУМС на почечные и гемодинамические эффекты у крыс, подвергшихся хроническому воздействию хлорида никеля // Материалы 10-й юбилейной научной сессии, посвященной 70-летию СОГМА «Актуальные проблемы медицины» – Владикавказ, 2009. – С.27.
8. , , Албегова никеля на гемодинамические эффекты и адренореактивность у крыс // Материалы 10-й юбилейной научной сессии, посвященной 70-летию СОГМА «Актуальные проблемы медицины» – Владикавказ, 2009. – С.30.
9. , Брин хронической токсической никелевой нефропатии // X Международный конгресс «Здоровье и образование в XXI веке» «Инновационные технологии в биологии и медицине». – Москва, 2009. – С.66.
10. Албегова свободно-радикальных процессов у крыс при хронической интоксикации хлоридом никеля // X Международный конгресс «Здоровье и образование в XXI веке» «Инновационные технологии в биологии и медицине». – Москва, 2009. – С.66-67.
11. , Кабисов анализ влияния Ирлита-1 и НУМС на гемодинамические эффекты хронической молибденовой интоксикации у крыс // VII Международная конференция «Устойчивое развитие горных территорий в условиях глобальных изменений». – Владикавказ, 2010 (электронный ресурс).
12. , Гаглоева -электролитный профиль слоев почки у крыс с хронической интоксикацией хлоридом никеля и на фоне профилактического использования сорбентов // Тезисы докладов XXI съезда физиологического общества им. . – Калуга, 2010. – С.14-15.
13. Албегова сорбционных свойств нанокомпозитных энтеросорбентов НУМС и Ирлитов in vitro и in vivo // Научные труды III съезда физиологов СНГ. –Ялта, 2011. –С.283.
14. , , О возможности профилактировать экопатогенное влияние металлургического производства с помощью нанокомпозитных природных цеолитоподобных глин Северной Осетии – Ирлитов // Горные регионы XXI век: Сборник научных трудов. – Владикавказ, 2011. – С.112-122.
15. , , Закс изменения внутренних органов крыс при хронической интоксикации солями никеля // Вестник международной академии наук экологии и безопасности жизнедеятельности. – 2010. –Том 15, № 2. – С.67-70.
16. , , Закс изменения внутренних органов крыс при хронической интоксикации солями молибдена // Вестник международной академии наук экологии и безопасности жизнедеятельности. –2010. – Том 15, № 2. – С.70-73.
17. , , Молдаван энтеросорбентов на почечные проявления хронической молибденовой интоксикации // Вестник международной академии наук экологии и безопасности жизнедеятельности. – 2010. – Том 15, № 4. – С.81-85.
18. , , Боциева проявления хронической молибденовой интоксикации // Вестник международной академии наук экологии и безопасности жизнедеятельности. – 2010. – Том 15, № 4. – С.85-88.
19. , , Молдаван энтеросорбентов на гемодинамические показатели и свободнорадикальные процессы у крыс при моделировании хронической интоксикации хлоридом никеля // Вестник новых медицинских технологий. – 2010. – С.91-93.
20. , , Закс системы гемодинамики, морфологии миокарда и свободорадикальных процессов при хронической молибденовой интоксикации // Кубанский научный медицинский вестник. – 2010. – № 8 (122). – С.13-16.
21. , , Гаглоева применения энтеросорбентов у животных с хронической интоксикацией хлоридом никеля // Кубанский научный медицинский вестник. – 2010. – №1 (115). – С.5-8.
22. , , Кайтмазова чувствительности интерферонового статуса к хлориду никеля и молибдату аммония // Вестник новых медицинских технологий. – 2010. – Том XVII, №1. – С.187-188.
23. , , Кабисов энтеросорбентов для профилактики кардиотоксического действия никеля в эксперименте // Владикавказский медико-биологический вестник. – . – Том IX, вып. 15, 16. –С.59-62.
24. Албегова нанокомпозитными энтеросорбентами кардиотоксического действия вольфрама в эксперименте // Владикавказский медико-биологический вестник. – 2011. – Том XII, вып.19. – С.43-47.
25. , , Гаглоева нанокомпозитных энтеросорбентов на накопление молибдена в тканях крыс // Кубанский научный медицинский вестник. – 2011. – № 3 (126). – С. 16-18.
26. , , Закс хронической интоксикации хлоридом никеля на морфологические изменения внутренних органов и накопление металла у крыс // Вестник новых медицинских технологий. – 2011. – Том XVIII, № 1. – С.160-161.
27. , , Кабисов энтеросорбентами кардиотоксического действия молибдена в эксперименте // Медицинский вестник Северного Кавказа. – 2011. – № 2 (22). – С. 56-59.
28. Албегова изменения внутренних органов крыс и система ПОЛ – АОЗ при хронической интоксикации солями вольфрама // Устойчивое развитие горных территорий. – Владикавказ, 2011. – № 2 (8). – С.13-16.
29. , , Плиева иммунная и интерфероновая недостаточность у больных детей с язвенной болезнью желудка и двенадцатиперстной кишки, проживающих в зоне экологического неблагополучия // Владикавказский медико-биологический вестник. –2011. – Том X, вып.17. – С.87-90.
30. Албегова нанокомпозитного энтеросорбента НУМС на функцию почек в условиях водной нагрузки на фоне хронической интоксикации хлоридом никеля // Материалы V региональной научно-практической конференции. – Владикавказ, 2012. – С.153-157.
31. , , О возможности профилактирования эко-патогенных влияний никеля с помощью природного нанопористого сорбента Ирлит // Материалы международной заочной научно-практической конференции «Биология, химия, физика: теоретические и практические аспекты». – Новосибирск, 2012. – С.65-69.
32. Патент 2364948 Российская федерация. МКИG09В23/28. Способ моделирования хронической токсической нефропатии / , : заявитель и патентообладатель ГОУ ВПО СОГМА Росздрав России. – /14, заявл. 16.04.2008; опубл. 20.08.2009 // Бюл. – 2009. – № 23.
33. Патент 2400824 Российская федерация. МКИG09В23/28. Способ профилактики токсического действия никеля у экспериментальных животных при хроническом отравлении / , , : заявитель и патентообладатель ГОУ ВПО СОГМА Росздрав России. – /14, заявл. 21.07.2009; опубл. 27.09.2010 // Бюл. – 2010. – № 27.
34. Патент 2402824 Российская федерация. МКИG09В23/28. Способ моделирования хронической токсической кардиопатии / , , : заявитель и патентообладатель ГОУ ВПО СОГМА Росздрав России. – /14, заявл. 21.07.2009; опубл. 27.10.2010 // Бюл. – 2010. – № 30.
35. Патент 2410765 Российская федерация. МКИG09В23/28. Способ профилактики токсического действия никеля у экспериментальных животных при хроническом отравлении / , , : заявитель и патентообладатель ГОУ ВПО СОГМА Росздрав России. – /14, заявл. 21.07.2009; опубл. 27.01.2011 // Бюл. – 2011. – № 3.
36. Патент 2410766 Российская федерация. МКИG09В23/28, МКИА61К35/02, МКИА61Р9/00. Способ профилактики хронической токсической кардиопатии у экспериментальных животных / , , : заявитель и патентообладатель ГОУ ВПО СОГМА Росздрав России. – /14, заявл. 01.09.2009; опубл. 27.01.2011 // Бюл. – 2011. – № 3.
37. Патент 2410767 Российская федерация. МКИG09В23/28, МКИА61К35/02, МКИА61Р39/00. Способ профилактики токсического действия молибдена у экспериментальных животных при хроническом отравлении / , , : заявитель и патентообладатель ГОУ ВПО СОГМА Росздрав России. – /14, заявл. 23.10.2009; опубл. 27.01.2011 // Бюл. –2011. –№ 3.
38. Патент 2411588 Российская федерация. МКИG09В23/28. Способ моделирования хронической токсической нефропатии / : заявитель и патентообладатель ГОУ ВПО СОГМА Росздрав России. – /14, заявл. 21.07.2009; опубл. 10.02.2011 // Бюл. – 2011. – № 4.
39. Патент 2412489 Российская федерация. МКИG09В23/28. Способ профилактики хронической токсической кардиопатии у экспериментальных животных / , , : заявитель и патентообладатель ГОУ ВПО СОГМА Росздрав России. – /14, заявл. 01.09.2009; опубл. 20.02.2011 // Бюл. – 2011. – № 5.
40. Патент 2413309 Российская федерация. МКИG09В23/28. Способ профилактики токсического действия молибдена у экспериментальных животных при хроническом отравлении / : заявитель и патентообладатель ГОУ ВПО СОГМА Росздрав России. – /15, заявл. 23.10.2009; опубл. 27.02.2011 // Бюл. – 2011. – № 6.
41. Патент 2424579 Российская федерация. МКИG09В23/28, МКИА61К35/02, МКИА61Р9/00. Способ профилактики хронической токсической кардиопатии у экспериментальных животных / , , : заявитель и патентообладатель ГОУ ВПО СОГМА Росздрав России. – /14, заявл. 22.03.2010; опубл. 20.07.2011 // Бюл. – 2011. – № 20.
42. Патент 2426173 Российская федерация. МКИG09В23/28. Способ моделирования хронической токсической кардиопатии / , , : заявитель и патентообладатель ГОУ ВПО СОГМА Росздрав России. – /14, заявл. 22.03.2010; опубл. 10.08.2011 // Бюл. – 2011. – № 22.




