ЛАБОРАТОРНАЯ РАБОТА ПО ТЕПЛОФИЗИКЕ № 2
АДИАБАТИЧЕСКИЙ И ИЗОХОРИЧЕСКИЙ ПРОЦЕССЫ
Ознакомьтесь с теорией в конспекте и учебнике (Савельев, т. 1, § 104, 103). Запустите программу. Выберите «Термодинамика и молекулярная физика», затем, в зависимости от пункта работы: «Адиабатический процесс» или «Изохорический процесс».
ЦЕЛЬ РАБОТЫ:
Знакомство с компьютерной моделью, описывающей адиабатический и изохорический процессы в идеальном газе. Экспериментальное подтверждение закономерностей адиабатического и изохорического процессов. Экспериментальное определение показателя адиабаты, количества степеней свободы и структуры молекул газа в данной модели.КРАТКАЯ ТЕОРИЯ:
Адиабатический процесс.
СОСТОЯНИЕ системы имеет фиксированные значения макроскопических параметров, описывающих систему в целом. Параметры, характеризующие систему в целом, называются ПАРАМЕТРАМИ СОСТОЯНИЯ. Примерами являются температура, давление, объем и т. д.
РАВНОВЕСНЫМ называется такое состояние системы, при котором все параметры системы имеют определенные значения, остающееся неизменными сколь угодно долго при неизменных внешних условиях.
ОБРАТИМЫМ называется процесс, при реализации которого в обратном направлении система проходит через те же состояния, что и при прямом ходе, но в обратной последовательности. Равновесные процессы всегда обратимы.
КРУГОВЫМ процессом (ЦИКЛОМ) называется процесс, при котором система после ряда изменений возвращается в исходное состояние.
УРАВНЕНИЕ СОСТОЯНИЯ идеального газа (уравнение Менделеева–Клапейрона)
![]() .
.
ТЕПЛОЕМКОСТЬ тела численно равна отношению количества тепла ∂Q, сообщенного телу, к изменению температуры тела dT, которое при этом произошло:
СТЕЛА = 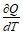 .
.
УДЕЛЬНОЙ теплоемкостью вещества называется отношение теплоемкости к массе тела.
Если тело не меняет свой объем, то оно не совершает работы, поэтому при постоянном объеме тела переданное телу тепло ∂Q идет на изменение его внутренней энергии dU.
ТЕПЛОЕМКОСТЬ ПРИ ПОСТОЯННОМ ОБЪЕМЕ:
СV = 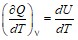 .
.
ТЕПЛОЕМКОСТЬ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ идеального газа, молекулы которого имеют i степеней свободы
CP = ![]() (1).
(1).
ОТНОШЕНИЕ ![]() является константой (в определенном диапазоне температур) для данного газа. Эта константа называется показателем адиабаты.
является константой (в определенном диапазоне температур) для данного газа. Эта константа называется показателем адиабаты.
Формула ![]() (2) устанавливает связь отношения теплоемкостей γ с числом степеней свободы молекулы газа i.
(2) устанавливает связь отношения теплоемкостей γ с числом степеней свободы молекулы газа i.
ЧИСЛО (количество) СТЕПЕНЕЙ СВОБОДЫ есть минимальное количество независимых координат, необходимых для однозначного описания положения молекулы в пространстве ИЛИ минимальное количество независимых движений, суперпозиция которых дает любое движение молекулы.
ПОСТУПАТЕЛЬНОЕ ДВИЖЕНИЕ всегда дает 3 степени свободы.
ВРАЩАТЕЛЬНОЕ ДВИЖЕНИЕ дает 2 степени свободы для линейной молекулы и 3 степени свободы, если атомы в молекуле не расположены на одной линии.
КОЛЕБАТЕЛЬНОЕ ДВИЖЕНИЕ дает 2nКОЛ степеней свободы, где nКОЛ – количество независимых колебаний атомов в молекуле (у двухатомной молекулы nКОЛ = 1).
АДИАБАТИЧЕСКИМ называется процесс, происходящий без теплообмена с внешней средой (∂Q = 0). Уравнение адиабаты:
PVγ = const (3).
Изохорический процесс.
Изохорический процесс - это процесс квазистатического нагревания или охлаждения вещества (в данном случае идеального газа ) при постоянном объеме V.
На плоскости (P, T) изохорические процессы при разных значениях объема V изображаются семейством прямых линий Р~Т (закон Шарля). Для одного моля идеального газа ![]()
![]() ,
,
где R=8.31 Дж/(моль К) - универсальная газовая постоянная.
В изохорическом процессе газ не совершает работы, т. е. A = 0.
Первый закон термодинамики для изохорического процесса записывается в виде
Q = U(T2) - U(T1) = ДU
Здесь U(T1) и U(T2) - внутренняя энергия газа в начальном и конечном состояниях.
При изохорическом нагревании тепло поглощается газом (Q>0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q< 0); внутренняя энергия газа уменьшается.
МЕТОДИКА И ПОРЯДОК ИЗМЕРЕНИЙ
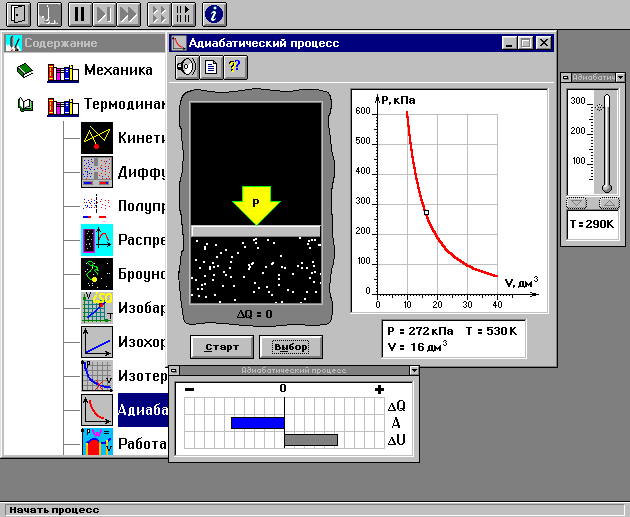
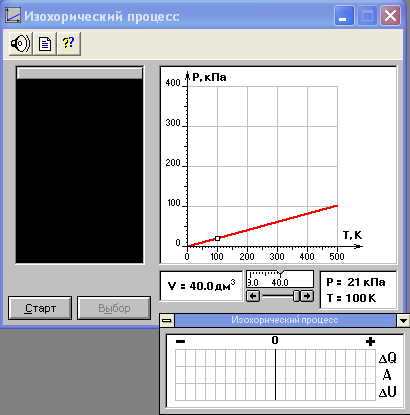
Внимательно рассмотрите картинку на рисунке. Ознакомьтесь с графиками в правой части изображения.
Зарисуйте необходимое в свой конспект лабораторной работы.
Получите у преподавателя допуск для выполнения измерений.
ИЗМЕРЕНИЯ:
Адиабатический процесс.
Установите начальное значение объема Vнач = 40 дм3 и начальную температуру Т1 газа, близкую к числам из табл. 1. Для этого нажмите кнопку «ВЫБОР», переместите маркер мыши так, чтобы его острие находилось в указанной точке вблизи границы столбика на градуснике, и нажмите и удерживая левую кнопку мыши двигайте столбик. Нажмите мышью кнопку «Старт» на экране и наблюдайте перемещение поршня на левой картинке модели и перемещение точки по красной кривой теоретической адиабаты. Попробуйте останавливать процесс нажатием кнопки «СТОП». Последующий запуск процесса осуществляется нажатием кнопки «Старт». После автоматической остановки процесса запустите его снова, нажав кнопку «Старт», и останавливайте, нажимая кнопку «Стоп», когда крестик на теоретической адиабате (красная кривая) будет находиться вблизи следующих значений объема: 15, 20, 25, 30, 35 и 40 дм3 (6 значений), записывая при остановке значения объема, температуры и давления в табл. 2. Установите новое значение температуры Т2, взяв его из табл. 1, задавая Vнач = 40 дм3 и повторите измерения, записывая результаты в табл. 3.ТАБЛИЦА 1. Начальные значения температуры (не перерисовывать)
Бригада | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Т1 | 50 | 70 | 100 | 120 | 140 | 170 | 200 | 220 |
Т2 | 230 | 240 | 250 | 260 | 270 | 280 | 290 | 300 |
ТАБЛИЦЫ 2, 3 Результаты измерений
Т, К |
V, дм3 |
p, кПа |
Изохорический процесс.
Установите начальное значение объема Vнач = 40 дм3 согласно числам из табл. 1. Для этого нажмите кнопку «ВЫБОР», и, нажимая мышью непосредственно на значения выбора объёма либо на стрелки, установите необходимое значение объёма в центре шкалы. Нажмите мышью кнопку «Старт» на экране и наблюдайте перемещение перемещение точки по красной кривой теоретической изохоры. Попробуйте останавливать процесс нажатием кнопки «СТОП». Последующий запуск процесса осуществляется нажатием кнопки «Старт». После автоматической остановки процесса запустите его снова, нажав кнопку «Старт», и останавливайте, нажимая кнопку «Стоп», когда крестик на теоретической изохоре будет находиться вблизи следующих значений температуры: 100, 150, 200, 250, 300, 350, 400 К (7 значений), записывая при остановке значения объема, температуры и давления в табл. 2. Установите новое значение объёма V2, взяв его из табл. 1, и повторите измерения, записывая результаты в табл. 3.ТАБЛИЦА 1. Начальные значения объёма (не перерисовывать)
Бригада | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
V1 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 11 |
V2 | 39 | 23 | 37 | 12 | 13 | 14 | 22 | 38 |
ТАБЛИЦЫ 2, 3 Результаты измерений
Т, К |
V, дм3 |
p, кПа |
ОБРАБОТКА РЕЗУЛЬТАТОВ И ОФОРМЛЕНИЕ ОТЧЕТА:
Адиабатический процесс.
Постройте на одном рисунке графики экспериментальных зависимостей логарифма давления от логарифма объема для обеих адиабат (указав на них начальные температуры). Для каждой адиабаты определите по графику экспериментальное значение показателя, используя формулуИзохорический процесс.
1. Постройте на одном рисунке графики экспериментальных зависимостей логарифма давления от логарифма температуры (указав на них постоянные параметры).
2. Рассчитайте произведённую работу процессом, изменение внутренней энергии и изменение теплоты.
3. Запишите ответы и проанализируйте ответы и графики.
Вопросы и задания для самоконтроля
Что такое параметры состояния системы? Дайте определение равновесного состояния системы. Какой процесс называется обратимым? Что такое цикл? Что такое уравнение состояния? Для какого физического газа можно применить модель «идеальный газ»? Какому уравнению подчиняется состояние идеального газа? Напишите его. Дайте определение теплоемкости тела. Дайте определение удельной теплоемкости. Напишите формулу для теплоемкости при постоянном объеме. Напишите формулу для теплоемкости идеального газа при постоянном давлении. Что такое число степеней свободы? Чему оно равно для одноатомной молекулы? Что такое показатель адиабаты? Напишите формулу связи показателя адиабаты с числом степеней свободы молекулы идеального газа. Дайте определение адиабатического процесса. Напишите уравнение адиабатического процесса. Дайте определение изопроцесса. Перечислите известные изопроцессы. Напишите уравнение и нарисуйте PV-диаграмму изотермического процесса. Напишите уравнение и нарисуйте PV-диаграмму изобарического процесса. Напишите уравнение и нарисуйте PV-диаграмму изохорического процесса.
ФИЗИЧЕСКИЕ КОНСТАНТЫ
Название | Символ | Значение | Размерность |
Гравитационная постоянная | γ или G | 6,67∙10–11 | Н∙м2∙кг–2 |
Ускорение свободного падения на поверхности Земли | g0 | 9,8 | м∙с-2 |
Скорость света в вакууме | c | 3∙108 | м∙с–1 |
Постоянная Авогадро | NA | 6,02∙1026 | кмоль–1 |
Универсальная газовая постоянная | R | 8,31∙103 | Дж∙кмоль–1∙К–1 |
Постоянная Больцмана | k | 1,38∙10–23 | Дж∙К–1 |
Элементарный заряд | e | 1,6∙10–19 | Кл |
Масса электрона | me | 9,11∙10–31 | кг |
Постоянная Фарадея | F | 9,65∙104 | Кл∙моль–1 |
Электрическая постоянная | εо | 8,85∙10–12 | Ф∙м–1 |
Магнитная постоянная | μо | 4π∙10–7 | Гн∙м–1 |
Постоянная Планка | h | 6,62∙10–34 | Дж∙с |
ПРИСТАВКИ И МНОЖИТЕЛИ
для образования десятичных кратных и дольных единиц
Приставка | Символ | Множитель | Приставка | Символ | Множитель |
дека | да | 101 | деци | д | 10–1 |
гекто | г | 102 | санти | с | 10–2 |
кило | к | 103 | милли | м | 10–3 |
мега | М | 106 | микро | мк | 10–6 |
гига | Г | 109 | нано | н | 10–9 |
тера | Т | 1012 | пико | п | 10–12 |
Задачи.
1. При нагревании некоторой массы газа при постоянном объёме на ДТ = 40К давление Р увеличилось на ДР/Р= 10%. Рассчитайте начальную температуру газа.
2. Пусть 1 моль идеального газа адиабатически сжимается от объёма V1 = 40 дм3 до V2 = 20. Наальная температура процесса - 300К. Определите разность давлений ДР = Р2 – Р1.
3. С какой скоростью должны лететь две мухи навстречу друг другу, чтобы после столкновения от них «мокрого места не осталось»? Температура окружающей среды – 20 °С.
4. В жилой комнате было холодно. После того как затопили батареи, температура воздуха повысилась на Дt = 20°. Объем комнаты V = 150 м3. Как изменилась внутренняя энергия воздуха, находящегося в комнате?





