Д. С. СКОРОБОГАТЬКО
Научный руководитель – СЕРГИЕВСКИЙ В. В., д. х.н., профессор, РУДАКОВ А. М, к. ф-м. н., доцент
Московский инженерно-физический институт (государственный университет)
МОДЕЛИРОВАНИЕ ТЕРМОДИНАМИЧЕСКИХ СВОЙСТВ БИНАРНЫХ СМЕСЕЙ ТРИЭТИЛАМИНА И ДИЭТИЛОВОГО ЭФИРА С ХЛОРОФОРМОМ
В рамках модели нестехиометрических взаимодействий проведено математическое моделирование концентрационных зависимостей активности растворителя в смесях триэтиламина и диэтилового эфира с хлороформ, а также избыточных объемов системы триэтиламин – хлороформ во всем диапазоне составов.
В настоящее время разработано большое число различных математических моделей для адекватного описания термодинамических свойств растворов во всем концентрационном диапазоне. Часто недостатком этих моделей является большое количество подгоночных параметров (два и более), физический смысл которых не установлен.
На кафедре химии МИФИ была разработана кластерная модель, в основе которой лежит представление о нестехиометрической сольватации растворенного вещества молекулами растворителя. Эта модель использовалась для описания свойств растворов с ограниченным смешением компонентов (водные растворы углеводов, линейных спиртов, ПЭГ с разной молекулярной массой).
Цель данной работы заключается в распространении рассматриваемой модели на системы с неограниченным смешением компонентов для описания их термодинамических свойств. Среди таких систем наибольший интерес представляют системы, образование комплексов в которых происходит с помощью водородной связи.
В основе термодинамического анализа неидеальных систем лежит метод термодинамических активностей. Источником экспериментальных данных об активности компонентов в растворе были данные по измерению суммарного давления паров компонентов [1,2]. Системы триэтиламин-хлороформ и диэтиловый эфир-хлороформ характеризуются слабым взаимодействием между компонентами в растворе. Образование комплексов происходит посредством водородной связи.
При отрицательной неидеальности для активности растворителя (а1) в рамках кластерной модели [3] справедливо следующее уравнение:
а1=x11+hexp(hx2) (1)
где х1, х2 – мольные доли растворителя и растворенного вещества соответственно, h – единственный параметр модели, являющийся числом нестехиометрической сольватации, т. е. среднее число молекул растворителя, связанное с молекулой растворенного вещества в стандартном состоянии. Параметры модели и стандартное отклонение расчета активности растворителя (S) приведены в таблице. Кроме того, степень соответствия результатов моделирования и эксперимента иллюстрируется данными рисунка.
Система | T, К | h | S |
Триэтиламин - хлороформ | 298.15 | 0.6 | 0.8 |
283.15 | 0.75 | 0.4 | |
Диэтиловый эфир - хлороформ | 298.15 | 0.35 | 2.8 |
В системе триэтиламин-хлороформ значение h убывает с ростом температуры, что характерно для систем с водородной связью.
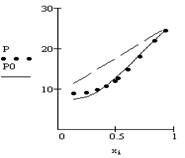
Рис. Зависимость общего давления пара от концентрации для системы
триэтиламин-хлороформ при Т=298.15 К
В рамках рассматриваемой модели зависимость избыточного объема VE от концентрации растворителя выражается уравнением:
VЕ = - VSt0 h x1ln(x1), (2)
где x1 – мольная доля растворителя, VSt0 – изменение объема при присоединении молекулы растворителя к сольвату в расчете на моль. (VSt0). Для системы триэтиламин - хлороформ при Т = 298,15 К оценка VSt0 составила - 7.4 см3/моль. Максимальное отклонение от экспериментальных данных по избыточному объему составило 15%.
Список литературы
1. Chand A. // J. Chem. Thermodyn. 1975. V. 7. P. 401.
2. Handa Y. // Canad. J. Chemistry. 1975. V. 53. P. 3299.
3. , // Инженерная физика. 2001. № 1. C. 33-37.



