Окисление загрязнений сточных вод протекает тем полнее, чем больше отношение БПКполн : ХПК (отношение БПКполн : ХПК должно быть не менее 0,4).
Как показывает опыт, биохимическому окислению легко поддаются низшие одноатомные спирты, сложные эфиры, карбоновые кислоты. Легко окисляются также бензойная кислота, гликоли, ацетон, глицерин, анилин и ряд других веществ. При длительной адаптации микроорганизмов достигается распад даже таких устойчивых соединений, как толуол, ксилол, углеводороды нефти, хлорзамещенные углеводороды и др. Однако окисление некоторых из органических веществ происходит настолько медленно, что содержащие их ПСВ нецелесообразно подвергать биологической очистке. Наиболее неблагоприятное влияние на ход биохимических процессов оказывает присутствие в сточных водах солей тяжелых металлов.
В результате длительной направленной селекции микроорганизмов, выращиваемых только на одном веществе, служащем им единственным источником углерода, могут быть получены такие культуры, которые будут усваивать это вещество даже при высоких его концентрациях. Эти культуры могут быть успешно использованы при очистке сточных вод, загрязненных каким-либо одним веществом, например фенолом; в большинстве же случаев целесообразно использовать биоценоз микроорганизмов (активный ил).
Виды микроорганизмов этого биоценоза отбираются в процессе длительной работы на сточной воде данного состава. Изменение качества очищаемой воды и ее концентрации обусловливает необходимость адаптации микроорганизмов. Их способность к адаптации имеет большое значение при биологической очистке производственных сточных вод.
Процесс очистки протекает более устойчиво и полно в тех случаях, когда очищают смесь производственных и бытовых сточных вод. Объясняется это тем, что бытовые воды содержат необходимые биогенные элементы, а также служат для разбавления. Часто для быстрой инокуляции очистных сооружений микроорганизмами - минерализаторами к производственным водам добавляют бытовые воды, особенно в пусковой период. После «созревания» очистных сооружений, когда микроорганизмы приспособятся к утилизации специфических загрязнений ПСВ, приток бытовых вод может быть уменьшен или прекращен вообще.
Микробиологическое окисление ПСВ описывается кинетическим уравнением реакции первого порядка:
k =![]() ln
ln![]() или k =
или k =![]() 2,303 lg
2,303 lg![]() ,
,
где СА0 – начальная концентрация вещества, вступающего в реакцию;
СА – текущая концентрация вещества*
τ – время, прошедшее от начала реакции. Н
При биологической очистке начальной концентрации вещества соответствует БПКполн, текущей – (БПКполн – БПКτ), тогда
k =![]() 2,303 lg
2,303 lg![]() .
.
k* =![]() lg
lg![]() ,
,
где k* = k/2,303 – константа биоокисления, сут-1.
При потенциировании уравнения получим: БПКτ = БПКполн· (1 – 10–k*τ)
Приблизительно константу биоокисления можно вычислить, если принять, что окисление растворенных органических веществ на 99% является полным. В этом случае в ПСВ остается 1% загрязнений, т. е. БПКполн / (БПКполн – БПКτ) = 100.
k* =![]() lg
lg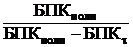 =
= ![]() lg100 = 2/ τполн.
lg100 = 2/ τполн.
Таким образом, k*= 2/ τполн.
Технологические показатели работы
биологических очистных сооружений (БОС):
1. Эффективность (степень) ЭБПК5 очистки ПСВ по БПК5
ЭБПК5 = ![]() 100%
100%
2. Нагрузка на единицу объема БОС Нv по БПК5
Нv = Qсв∙24∙БПК5 / Vа общ = 24∙БПК5 / τа ср,![]() ,
,
где Qсв – объемный расход сточных вод, м3·час;-
τ аср – средняя продолжительность аэрации, час.
3. Нагрузка Н на 1г беззольного вещества активного ила по БПК5
Н = ![]() ,
,![]()
где Сср – средняя концентрация (доза) ила в системе;
Зл – зольность (доля минеральных веществ) активного ила.
4. Окислительная мощность ОМ 1 г беззольного вещества активного ила по БПК5
ОМ = Н ∙ ЭБПК5,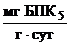
5. Скорость окисления wок 1 г беззольного вещества активного ила по БПК5
wок = ОМ / 24,![]()
3 ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример1. Смешиваются сточные воды с расходом 2, 10 и 100 тыс. м3·сут-1 и концентрациями по БПКполн соответственно 500, 380 и 220 мг О·л-1. Определите БПКполн смеси и отметьте условия, при которых задача может быть решена.
Решение:
Задача может быть решена, если при смешении в стоках не происходит никаких химических изменений и компоненты не оказывают взаимного токсического или стимулирующего действия.
БПКполн см.= 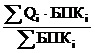 =
= ![]() = 0,2366 т·тыс. м-3 = 237 мг О·л-1.
= 0,2366 т·тыс. м-3 = 237 мг О·л-1.
Ответ: БПКполн смеси равно 237 мг О·л-1.
Пример 2. Вычислите БПК5 и ХПК раствора этанола с концентрацией 200 мг·л-1, если константа k* процесса окисления (при определении БПК) равна 0,2 сут-1. Удельное БПКполн спирта равно1,82 мг О·мг-1.
Решение:
Определим удельное ХПК этанола. Уравнение полного окисления этанола: С2Н5ОН + 3О2 = 2СО2 + 3Н2О.
ХПКуд = ![]() =
= ![]() ,
,
где n – стехиометрический коэффициент перед кислородом в уравнении полного окисления вещества;
M(O2) – молярная масса кислорода, г·моль-1
M – молярная масса вещества, г·моль-1.
ХПКуд = 3∙32 / (12∙2 + 1∙6 + 16∙1) = 2,08 мг О·мг-1.
Следовательно, ХПК = ХПКуд ∙ С = 2,08 мгО·мг-1·200 мг·л-1 = 416 мгО·л-1.
БПКполн = БПКполн уд.∙С = 1,82∙200 = 364 мг О·л-1.
Зная БПКполн, вычислим БПК5 по кинетическому уравнению реакции первого порядка: БПКτ = БПКполн∙(1 – 10-k*τ); БПК5 = 364∙(1 – 10-0,2∙5) = 326 мг О·л-1.
Ответ: ХПК раствора этанола равно 416 мг О·л-1, БПК5 этого же раствора – 326 мг О·л-1.
Пример 3. Вычислите среднюю статистическую простейшую формулу беззольного вещества и удельное ХПК ила, если анализом по методу сжигания пробы активного ила найдено, что беззольное вещество имеет следующий состав (масс. %): С–49, Н – 8, N – 10 О – 33.
Решение:
Обозначим формулу беззольного вещества активного ила СхНуNzOw. Тогда отношение количеств элементов, входящих в состав вещества, равно
х : у : z : w = ![]() =
= ![]() = 4,08 : 8 : 0,71 : 2,06
= 4,08 : 8 : 0,71 : 2,06
х : у : z : w = 5,76 : 11,2 : 1 : 2,9 ≈ 6 : 11 : 1 : 3, и формула беззольного вещества – С6Н11NO3.
Уравнение полного окисления беззольного вещества:
С6Н11NO3 + 14,5О2 = 6СО2 + 0,5N2 + 5,5Н2О
ХПКуд = ![]() =
= ![]() ,
,
где n – стехиометрический коэффициент перед кислородом в уравнении полного окисления вещества;
M(O2) – молярная масса кислорода, г·моль-1;
M – молярная масса вещества, г·моль-1.
ХПКуд = 14,5∙32 / (6∙12 + 1∙11 + 14∙1 + 16∙3) = 3,2 г О/г = 3,2 мг О·мг-1.
Ответ: Простейшая формула беззольного вещества активного ила С6Н11NO3. Удельное ХПК активного ила равно 3,2 мг·мг-1.
Пример 4. Необходимо снизить концентрацию пропанола в сточной воде от 5 г/дм3 до 0,25 мг/дм3 (ПДК) путем биохимического разложения. Известны начальные скорости процесса при двух концентрациях спирта: при С0 = 5 г/дм3 скорость процесса равна 2,15 г∙л-1∙час-1; при С0 = 7 г/дм3 скорость процесса равна 3,00 г∙л-1∙час-1. Определите порядок реакции и константу скорости реакции. Вычислите время, за которое будет достигнута концентрация спирта, равная ПДК, при заданных начальных концентрациях.
Решение:
Для определения порядка реакции можно использовать метод начальных скоростей:
υ10 = kC10n
υ20 = kC20n
Прологарифмируем уравнения и вычтем из второго уравнения первое.
lgυ10 = lgk + nlgC10
lgυ20 = lgk + nlgC20
lgυ20 − lgυ10 = nlgC20 − nlgC10 = n(lgC20− lgC10)
n = (lgυ20 − lgυ10)/(lgC20− lgC10) или n = lg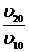 / lg
/ lg![]()
n = lg![]() / lg
/ lg![]() = 0,145/0,146 = 0,99 ≈ 1
= 0,145/0,146 = 0,99 ≈ 1

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 |





