Приложение
Приложени1. Технологическая карта урока
СВОЙСТВА КАРБОНОВЫХ КИСЛОТ. Ф. И.___________________
Вспомните взаимное влияние атомов в молекуле карбоновой кислоты.
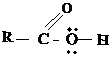
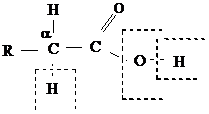 Для монокарбоновых кислот характерна высокая реакционная способность:
Для монокарбоновых кислот характерна высокая реакционная способность:
- Разрыв связи О-Н реакция обусловлена подвижностью атома водорода гидроксильной группы.
- Разрыв связи С-О реакция замещения гидроксильной группы.
- Разрыв связи С-Н у α-углеродного атома реакции замещения с участием радикала.
Домашнее задание: §30 стр.191-193 упр.2,3
Первая группа реакций.
Реакции на разрыв связи О-Н – замещение атома водорода (Н)
Вспомните, какие химические свойства характерны для соляной кислоты?
Проверьте, обладает ли уксусная кислота этими же свойствами? Для этого проведите лабораторные опыты не только с уксусной кислотой, но и с соляной. Сравните результаты опытов и сделайте вывод.
 |
Совет: для лучшей эффективности
сравнения опыты с той и другой
кислотой проводить одновременно
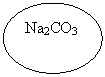
 Какая кислота на ваш взгляд наиболее
Какая кислота на ваш взгляд наиболее
активна? Почему?
Записываем в тетрадь вывод:
Допишите уравнения реакций для уксусной кислоты, используя табличные данные.
Сравнение химических свойств соляной и уксусной кислот.
Свойства кислот | Соляная кислота (неорганическая) | Уксусная кислота (органическая) |
1. Диссоциация | HCl | CH3 COOH |
1. Взаимодействие с металлами до Н | 2HCl + Zn = ZnCl2 + H2 | CH3 COOH + Zn → |
2. Взаимодействие со щелочами | HCl + NaOH = NaCl + H2O | CH3 COOH + NaOH → |
3. Взаимодействие с основными оксидами. | HCl + CaO = CaCl2 + H2O | CH3 COOH + CaO → |
4. Взаимодействие с солями слабых кислот (карбонатами) | 2HCl + Na2CO3 = 2NaCl + H2O + CO2 | CH3 COOH + Na2CO3 → |
Вторая группа реакций.
Реакции на разрыв связи С-О – замещение гидроксильной группы (ОН)
1. Взаимодействие со спиртами с образованием сложных эфиров
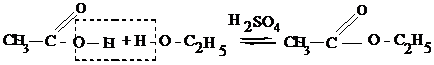
2. Взаимодействие с галогенидами фосфора PCl5, PCl3
O O
CH3 – C ¤ ¤ - OH + PCl5 → CH3 – C ¤ ¤ - Cl + POCl3 + HCl
ацетил ацетилхлорид
3. Межмолекулярная дегидратация карбоновых кислот до ангидридов – это производные карбоновых кислот, состоящие из двух кислотных радикалов (ацилов) соединенных через кислород.
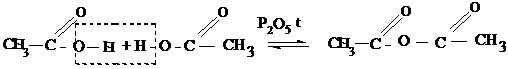
Задание. Запишите уравнения реакций для пропионовой кислоты с этиловым спиртом, с хлоридом фосфора (V) и реакцию межмолекулярной дегидратации.
1.
2.
3.
Третья группа реакций.
Реакции на разрыв связи С-Н у α-углеродного атома – реакции замещения с участием радикала.
1. Реакция галогенирования атома водорода у α-углеродного атома:
Н H
| |

![]()
![]() Н – С – СООН + Cl – Cl → H C – COOH + HCl хлоруксусная кислота намного
Н – С – СООН + Cl – Cl → H C – COOH + HCl хлоруксусная кислота намного
| сильнее уксусной
Н Cl
Становится еще
более подвижным
Запишите самостоятельно общий вывод о свойствах карбоновых кислот.
Вывод:
F --------------------------------------------------
F --------------------------------------------------
F --------------------------------------------------




