ДИАГНОСТИКА СОЛЕУСТОЙЧИВОСТИ ПОДВОЙНЫХ СОРТОВ ВИНОГРАДА С ПОМОЩЬЮ МЕТОДОВ КУЛЬТУРЫ ТКАНЕЙ IN VITRO
, младший научный сотрудник,
, канд. с.-х. наук,
, канд. с.-х. наук,
Национальный научный центр «Институт виноградарства и виноделия им. », г. Одесса, Украина
E-mail: elena. *****@***ru
Приведены результаты исследований роста микроклонов подвойных сортов винограда, выращенных на питательной среде с активным кальцием. Показано, что в условиях засоления высота стебля и масса вегетативной части растений уменьшались, снижалось содержание пигментов в тканях листьев и изменялась флуоресценция хлорофилла. Полученные экспериментальные данные свидетельствуют об эффективности влияния засоления in vitro на микроклоны винограда и возможности диагностики устойчивости винограда к карбонатному хлорозу в условиях in vitro.
Ключевые слова: виноград, культура тканей in vitro, микрочеренки, активный кальций, биометрические показатели, содержание пигментов, индукция флуоресценции хлорофилла.
Почвенное засоление – стрессовый фактор среды, который приводит к ухудшению физиологического состояния неустойчивых растений и существенному снижению их продуктивности. Согласно литературным данным виноград лучше других плодовых культур приспосабливается к условиям засоления и сохраняет это свойство в следующих поколениях. Известно, что виноград может нормально расти и плодоносить на почвах, которые содержат не более 0,3-0,4% вредных солей (от сухого веса почвы). Наиболее существенно на виноград влияет засоление почвы карбонатом кальция. Под воздействием активного кальция у растений появляются признаки хлороза: нарушается образование хлорофилла в листьях и снижается активность фотосинтеза, угнетается развитие и плодоношение кустов [1, 2].
Определение устойчивости к засолению новых сортов винограда является одной из важных задач сортоиспытания. Согласно принятой методике выделенные формы винограда оценивают на устойчивость к карбонатам в течение нескольких лет, что предполагает определенные трудовые и материальные затраты – на выращивание саженцев, их высаживание на участке, уход, проведение ежегодных фенологических и агробиологических учетов и др. [3]. С помощью методов культуры тканей и органов in vitro можно провести исследования некоторых ценных показателей винограда, в том числе и солеустойчивости, после выделения элитных форм, еще в первый год их развития, до вступления в плодо - и лозоношение, что потребует намного меньше времени и материальных затрат.
Солеустойчивость винограда в условиях культуры тканей in vitro начали исследовать в 70-х годах. Преимущественно искусственное засоление создавали путем внесения в питательную среду хлорида натрия [4, 5]. Для изучения устойчивости винограда к карбонатному хлорозу в питательной среде создавали дефицит железа и добавляли бикарбонаты калия и натрия [6]. В более поздних работах [7, 8] для засоления среды применяли те же стрессовые агенты, а исследования дополнили некоторыми физиологическими и биохимическими анализами. Полученные результаты подчеркивают целесообразность применения культуры in vitro для тестирования устойчивости винограда к карбонатному хлорозу, однако методики требуют доработки, поскольку не учитывают все факторы стрессового влияния на растения. Поэтому, целью нашей работы было создать условия засоления активным кальцием и оценить устойчивость микроклональных растений винограда в условиях in vitro.
Материалы и методы исследований. Работу выполняли в отделе питомниководства и размножения винограда ННЦ «ИВиВ им. ». Исследования проводили на подвоях селекции ННЦ "ИВиВ им. " Добрыня и Таировский 1. В полевых условиях сорт Добрыня выдерживает от 14 до 19% активного кальция, то есть является довольно устойчивым к карбонатному хлорозу; для перспективной подвойной формы Таировский 1 полевых данных устойчивости к карбонатам нет. Микроклоны винограда выращивали на питательной среде Мурасиге и Скуга по стандартной технологии. Одноглазковые микрочеренки высаживали на питательные среды с различным содержанием карбоната кальция CaCO3. Поскольку карбонат кальция практически нерастворим в воде, его действующая концентрация в среде культивирования была намного ниже внесенного количества. Содержание «активного кальция» в растворе определяли по адаптированной к нашим условиям методике Друино-Галле [9]. Было установлено, что доступными были 2,5-7,5% «активного кальция» (по шкале Галле). В контрольном варианте экспланты высаживали на стандартную питательную среду, без добавления CaCO3. В каждом варианте высаживали по 15 микрочеренков, исследования проводили в двух повторностях. Через 30 и 50 дней после высаживания эксплантов определяли агробиологические показатели роста микроклонов. Для оценки состояния фотосинтетического аппарата исследовали содержание пигментов в тканях листьев [10] и измеряли интенсивность флуоресценции хлорофилла листьев растений с помощью хронофлуориметра «Флоратест» [11].
Результаты. Одним из основных показателей, который показывает степень стрессового воздействия на растительный организм, является сила роста. Под влиянием засоления заметно снижается величина всех параметров, которые характеризуют процессы роста – высота растений, размеры отдельных органов и др. [12]
В условиях культуры тканей in vitro определили, что условия засоления отрицательно влияли на приживаемость микрочеренков винограда. Так, на средах с активным кальцием этот показатель уменьшался уже на 5-7-й день после высаживания, тогда как у контрольных эксплантов уровень приживаемости оставался высоким (95-100%). В зависимости от уровня засоления приживалось 74-80% черенков сорта Добрыня и 80-90% черенков формы Таировский 1. На 10-й день количество жизнеспособных эксплантов на засоленных средах уменьшалось, наименьшим этот показатель был в варианте 7,5% CaCO3. Пролиферация почек начиналась на 5-7 день. Так, в контрольном варианте у 35-50% черенков наблюдали развитие боковых почек, на средах с активным кальцием этот показатель снижался - до 27-40% у формы Таировский 1 и до 9-30% у сорта Добрыня. На 10-й день у части эксплантов было отмечено появление корней, как в контрольном, так и опытных вариантах. Корнеобразование было заметно ниже только в варианте 7,5% CaCO3, а на среде с 5,0-6,3% CaCO3 корней образовывались даже больше, чем в контроле. Однако, на 15-20-й день у черенков на стрессовых средах было отмечено частичное повреждение листовых пластинок.
Через 30 и 50 дней у сформированных растений измеряли высоту и массу прироста, подсчитывали количество листьев и корней. Полученные данные свидетельствуют, что микроклоны винограда формы Таировский 1 по сравнению с сортом Добрыня в целом имели более длинный стебель и большее количество листьев, однако масса вегетативной части и количество корней у них было меньшим, особенно в вариантах 5,0-7,5% CaCO3 (табл.). Через 50 дней отметили значительный прирост высоты стебля микроклонов как в контрольном (на 118,9% у сорта Добрыня и 78,9% у Таировского 1), так и у вариантах с 2,5-6,3% CaCO3. Масса побега растений на стрессовых средах уменьшалась с увеличением содержания активного кальция. Например, у микроклонов сорта Добрыня в варианте 5,0% CaCO3 масса прироста составляла 0,43 г, а в варианте 7,5% CaCO3 - 0,38 г, что на 23,2-33,9% меньше, чем в контроле. Масса побега у подвоя Таировский 1 на средах с активным кальцием снижалась еще больше - на 32,7-69,4% по сравнению с контролем. Таким образом, внесение соли CaCO3 в питательную среду приводило к удлинению стебля растений, в основном за счет увеличения длины междоузлий, кроме того такие растения имели меньшее количество листьев и корней. Рост биомассы зеленой части микроклонов значительно замедлялся, что может свидетельствовать об угнетении процессов биосинтеза в организме растений под влиянием избыточного количества кальция в среде.
Согласно исследованиям многих ученых в условиях засоления у большинства культурных растений подавляется процесс фотосинтеза, снижается функциональная активность хлорофилла [2]. Например, у сильно пораженного карбонатным хлорозом винограда сорта Изабелла количество хлорофилла в листьях была в 3-4 раза ниже, чем у здоровых кустов [1].
Таблица
Показатели роста микроклонов винограда на среде с активным кальцием (через 30 и 50 дней после высаживания)
Вариант | Высота растений, см | Количество листьев, шт. | Количество корней, шт. | Масса побега через 50 дней, г | |||
через 30 дней | через 50 дней | через 30 дней | через 50 дней | через 30 дней | через 50 дней | ||
Добрыня | |||||||
Контроль | 3,70 | 8,10 | 3,40 | 6,80 | 4,20 | 3,75 | 0,56 |
2,5% CaCO3 | 4,15 | 4,85* | 3,85 | 4,40* | 2,45* | 1,40* | 0,46 |
3,8% CaCO3 | 2,85* | 6,50* | 3,00 | 4,60* | 2,25* | 2,40* | 0,52 |
5,0% CaCO3 | 2,43* | 7,20 | 1,65* | 5,75* | 2,65* | 1,90* | 0,43* |
6,3% CaCO3 | 2,20* | 6,00* | 1,52* | 3,78* | 2,71* | 1,85* | 0,37* |
7,5% CaCO3 | 1,90* | 5,40* | 1,40* | 1,75* | 2,40* | 2,40* | 0,38* |
НСР 0,05 | 0,58 | 1,19 | 0,56 | 0,68 | 0,63 | 0,56 | 0,10 |
Таировский 1 | |||||||
Контроль | 4,08 | 7,30 | 4,15 | 6,88 | 2,00 | 2,28 | 0,49 |
2,5% CaCO3 | 5,00* | 8,08 | 4,36 | 5,48* | 2,58* | 2,56 | 0,35* |
3,8% CaCO3 | 3,92 | 6,01* | 2,80* | 4,53* | 1,83 | 1,80 | 0,49 |
5,0% CaCO3 | 2,90* | 5,65 | 2,50* | 4,67* | 2,10 | 1,75 | 0,33* |
6,3% CaCO3 | 2,56* | 5,63 | 2,82* | 4,60* | 2,28 | 2,33 | 0,17* |
7,5% CaCO3 | 3,15* | 4,67* | 4,30 | 3,25* | 1,35* | 1,83 | 0,15* |
НСР 0,05 | 0,54 | 0,80 | 0,83 | 1,03 | 0,42 | 0,52 | 0,07 |
Примечание: * - достоверная разница с контролем.
Согласно полученным данным количество хлорофиллов «а» и «b» и каротиноидов в листьях микроклонов, выращенных на средах с активным кальцием, было значительно ниже, чем у контрольных растений. Так, у подвоя Добрыня на 30-й день культивирования сумма хлорофиллов в тканях листьев уменьшалась на 41,9-71,3% (рис. 1), содержание каротиноидов - соответственно на 24,0-66,0%. Через 50 дней у растений этого сорта было отмечено некоторое увеличение количества пигментов, однако эти значения были меньше, чем в контроле.
У формы Таировский 1 разница между показателями контрольных и опытных вариантов была меньше, чем у сорта Добрыня. У растений на средах с активным кальцием содержание хлорофиллов «а» и «b» снижалось по сравнению с контролем на 38,7-52,3%, каротиноидов - на 32,9-51,9% (рис. 1). Однако, через 50 дней у растений Таировского 1, в отличие от Добрыни, зафиксировали значительное падение содержания пигментов в тканях листьев, в некоторых вариантах - более чем в два раза. Это показывает ухудшение состояния микроклонов в условиях засоления питательной среды активным кальцием, что подтверждается и показателями роста, в частности, меньшими значениями высоты стебля и биомассы прироста.
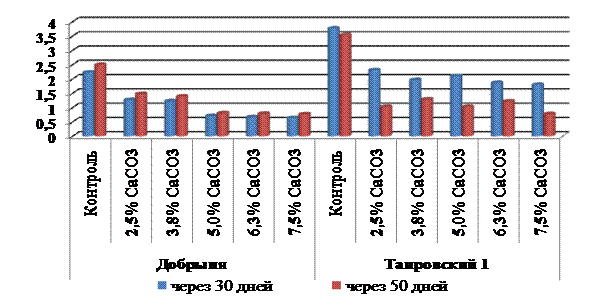
Рисунок 1 – Сумма хлорофиллов а и b в тканях подвоев (мг/г сырого веса) после высаживания на среду с активным кальцием
Во многих научных исследованиях показана тесная взаимосвязь индукционных процессов флуоресценции хлорофилла листьев с функционированием фотосинтетического апарата и физиологического состояния растений в целом [13, 14]. Условия засоления существенно влияют на флуоресценцию хлорофилла листьев растений и кинетику отдельных ее этапов, однако изменения не столь значительны, как, например, в случае стрессовых температур и обезвоживания. В основном наблюдают световой спад переменной флуоресценции хлорофилла и увеличение начальной скорости ее нарастания [14].
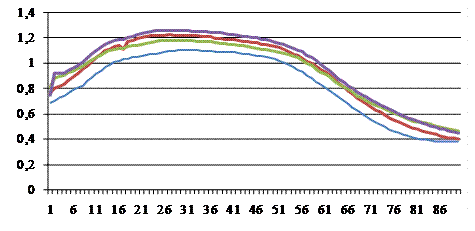
В ходе исследований отметили разницу между индукцией флуоресценции хлорофилла (ИФХ) листьев контрольных растений и растений, выращенных на засоленных средах, причем проявились и сортовые особенности подвоев (рис. 2). Определили, что у микроклонов винограда сорта Добрыня во всех опытных вариантах интенсивность флуоресценции была выше, чем в контроле.
|
|
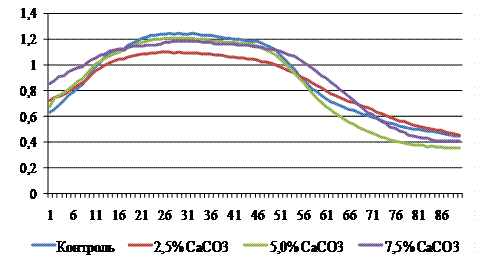
Рисунок 2 – График интенсивности флуоресценции хлорофилла листьев микроклонов подвоев винограда (отн. ед.), выращенных на питательных средах с активным кальцием
Максимальные величины флуоресценции достигали 1,1783-1,2681 отн. ед. (для сравнения - в контроле максимум флуоресценции составил 1,1085 отн. ед.). Наиболее высокие значения были в вариантах 6,3-7,5% CaCO3. У подвоя Таировский 1 наибольший выход флуоресценции зафиксировали в контрольном варианте (Fmax = 1,2373 отн. ед.), у вариантах с активным кальцием графики ИФХ находились на более низком кинетическом уровне, чем в контроле (на 11,6-28,8%). Интенсивность флуоресценции контрольных растений подвоя Добрыня была ниже, чем в опытных. Для сорта Таировский 1 была характерной противоположная закономерность: все микроклоны, выращенные на среде с активным кальцием, имели меньшие максимальные показатели флуоресценции по сравнению с контролем, что вместе с уменьшением количества хлорофиллов свидетельствует об общем угнетении фотосинтетической активности растений под влиянием активного кальция.
Таким образом, выращивание микроклонов винограда на среде с карбонатом кальция сопровождалось появлением у растений основных признаков хлороза - угнетением развития, уменьшением вегетативной массы и снижением содержания пигментов в тканях. Следует отметить, что у формы Таировский 1 признаки хлороза были выражены сильнее, чем у сорта Добрыня. Проведенные исследования свидетельствуют об эффективности влияния искусственного засоления на микроклоны винограда, а также о наличии сортоспецифической реакции растений на стресс и подтверждают целесообразность приема культивирования микрочеренков на среде с активным кальцием для оценки солеустойчивости винограда. На основании полученных результатов установлена возможность диагностики устойчивости винограда к карбонатному хлорозу в условиях in vitro.
Список литературы
1. Мишуренко питомник / .– [2-е изд.]. – М.: Колос, 1964. – 343 с.
2. Унгурян и виноград / . – Кишинев: Штиинца, 1979. – 212 с.
3. Методика государственного сортоиспытания плодовых, ягодных культур и винограда / Государственная комиссия по сортоиспытанию сельскохозяйственных культур при Министерстве сельского хозяйства СССР. – М.: Изд-во Колос, 1961. – Вып. V. – 160 с.
4. Alexander Dmc. E. Effect of chloride in solution culture on growth and chloride uptake of Sultana and Salt Creek grape vines / Dmc. E. Alexander, J. Groot Obbink // Aust. J. Exp. Agric. Animal. Husb. – 1971. – Vol. 11. – Pp. 357-361.
5. Sivritepe M. Determination of salt tolerance in some grapevine cultivars (Vitis vinifera) under in vitro conditions / M. Sivritepe, A. Eris // Turkish J. BiolVol. 23. - Pp. 473-485.
6. Bavaresco L. Investigations on some physiological parameters involved in chlorosis occurrence in grafted grapevines / L. Bavaresco, М. Fregoni, Р. Fraschini // J. Plant Nutri– № 15. – Р. .
7. Tangolar S. G. Use of in vitro method to evaluate some grapevine varieties for tolerance and susceptibility to sodium bicarbonate-induced chlorosis / S. G. Tangolar, G. Ünlüb, S. Tangolarb et al. / In Vitro Cellular & Developmental Biology – PlantVol. 44, Is. 3. - Рp. 233-237.
8. Wei L. C. In vitro cultured subclover root can develop Fe deficiency stress response / L. C. Wei, W. R. Ocumpaugh, R. H. Loeppert // Physiol Plant. – 1997. – Vol. 100. – Pp. 975-981.
9. Оценка пригодности почв под виноградниками (методические рекомендации) / [, , и др.] – Симферополь: ВНИИВиПП «Магарач», УНИИВиВ им. , 1990. – 42 с.
10. Починок биохимического анализа растений / . – К. : Наукова думка, 1976. – 334 с.
11. Інструментальне вивчення фотосинтетичного апарату за допомогою індукції флуоресценції хлорофілу: методичні вказівки для студентів біологічного факультету / , Д. Ю Корнеев, , О. І. Китаєв. – К.: Видавничо-поліграфічний центр «Київський університет», 2000. – 15 с.
12. Строгонов и функции клеток при засолении / , , и др. — М.: Наука, 1970. — 318 с.
13. Рубин процессы фотосинтеза / // Соросовский образовательный журнал. – 1997. – № 10. – С.
14. Карапетян флуоресценция хлорофилла как показатель физиологического состояния растений / , // Физиология растений. – 1986. – Т. 33, № 5. – С. .




